Antyaromatyczność
Antykaromatyczność jest właściwością chemiczną cząsteczki cyklicznej z układem elektronów π , która ma wyższą energię, tj. jest mniej stabilna ze względu na obecność w niej 4n zdelokalizowanych (π lub wolnych par) elektronów, w przeciwieństwie do aromatyczności . W przeciwieństwie do związków aromatycznych , które kierują się regułą Hückla ([4 n +2] elektrony π) i są wysoce stabilne, związki antyaromatyczne są wysoce niestabilne i wysoce reaktywne. Aby uniknąć niestabilności antyaromatyczności, cząsteczki mogą zmieniać kształt, stając się niepłaskie, a tym samym przerywając niektóre interakcje π. W przeciwieństwie do diamagnetycznego prądu pierścieniowego występującego w związkach aromatycznych , związki antyaromatyczne mają paramagnetyczny prąd pierścieniowy, który można zaobserwować za pomocą spektroskopii NMR .
Przykładami związków przeciwaromatycznych są pentalen (A), bifenylen (B), kation cyklopentadienylu (C). Prototypowy przykład antyaromatyczności, cyklobutadienu , jest przedmiotem debaty, a niektórzy naukowcy argumentują, że antyaromatyczność nie jest głównym czynnikiem przyczyniającym się do jego destabilizacji.
Cyklooktatetraen jest przykładem cząsteczki przyjmującej niepłaską geometrię, aby uniknąć destabilizacji wynikającej z antyaromatyczności. Gdyby był płaski, miałby pojedynczy ośmioelektronowy układ π wokół pierścienia, ale zamiast tego przyjmuje kształt przypominający łódkę z czterema pojedynczymi wiązaniami π. Ponieważ związki antyaromatyczne są często krótkotrwałe i trudne w obróbce eksperymentalnej, energia destabilizacji antyaromatycznej jest często modelowana raczej za pomocą symulacji niż eksperymentów.
Definicja
Termin „antiaromatyzm” został po raz pierwszy zaproponowany przez Ronalda Breslowa w 1967 r. jako „sytuacja, w której destabilizuje cykliczna delokalizacja elektronów”. Kryteria IUPAC dotyczące antyaromatyczności są następujące:
- Cząsteczka musi być cykliczna.
- Cząsteczka musi być płaska.
- Cząsteczka musi mieć kompletny układ sprzężonych elektronów π w pierścieniu.
- Cząsteczka musi mieć 4 n elektronów π, gdzie n jest dowolną liczbą całkowitą w sprzężonym systemie π.
Różni się to od aromatyczności tylko czwartym kryterium: cząsteczki aromatyczne mają 4 n +2 elektronów π w sprzężonym układzie π, a zatem działają zgodnie z regułą Hückela . Cząsteczki niearomatyczne są albo niecykliczne, niepłaskie, albo nie mają kompletnego sprzężonego układu π w pierścieniu.
| Aromatyczny | antyaromatyczny | Niearomatyczny | |
|---|---|---|---|
| Cykliczny? | Tak | Tak | Zawiedzie co najmniej jedno z nich |
| Czy całkowicie sprzężony układ orbitali p w pierścieniu cząsteczki? | Tak | Tak | |
| Planarny? | Tak | Tak | |
| Ile elektronów π znajduje się w układzie sprzężonym? | 4n+2 (tj. 2, 6, 10, …) | 4n (4, 8, 12, …) | Nie dotyczy |
Posiadanie płaskiego układu pierścieni jest niezbędne do maksymalizacji nakładania się orbitali p , które tworzą sprzężony układ π. To wyjaśnia, dlaczego bycie płaską, cykliczną cząsteczką jest kluczową cechą zarówno cząsteczek aromatycznych, jak i antyaromatycznych. Jednak w rzeczywistości trudno jest określić, czy cząsteczka jest całkowicie skoniugowana, po prostu patrząc na jej strukturę: czasami cząsteczki mogą się zniekształcać, aby złagodzić napięcie, a to zniekształcenie może potencjalnie zakłócić koniugację. W związku z tym należy podjąć dodatkowe wysiłki w celu ustalenia, czy dana cząsteczka jest rzeczywiście antyaromatyczna.
Związek przeciwaromatyczny może wykazywać swoje działanie przeciwaromatyczne zarówno kinetycznie, jak i termodynamicznie. Jak zostanie omówione później, związki antyaromatyczne wykazują wyjątkowo wysoką reaktywność chemiczną (wysoka reaktywność nie „wskazuje” na związek antyaromatyczny, sugeruje jedynie, że związek może być antyaromatyczny). Związek antyaromatyczny można również rozpoznać termodynamicznie, mierząc energię cyklicznego sprzężonego układu elektronów π. W związku antyaromatycznym ilość energii koniugacji w cząsteczce będzie znacznie wyższa niż w odpowiednim związku odniesienia.
W rzeczywistości zaleca się obszerną analizę struktury potencjalnie antyaromatycznego związku przed stwierdzeniem, że jest on rzeczywiście antyaromatyczny. Jeśli nie istnieje określona eksperymentalnie struktura danej cząsteczki, należy przeprowadzić analizę obliczeniową. Energia potencjalna cząsteczki należy zbadać pod kątem różnych geometrii, aby ocenić wszelkie zniekształcenia z symetrycznej płaskiej konformacji. Ta procedura jest zalecana, ponieważ w przeszłości było wiele przypadków, w których cząsteczki, które na papierze wydawały się antyaromatyczne, okazały się takie nie być w rzeczywistości. Najbardziej znaną (i intensywnie dyskutowaną) z tych cząsteczek jest cyklobutadien, co zostanie omówione później.
Przykładami związków przeciwaromatycznych są pentalen (A), bifenylen (B), kation cyklopentadienylu (C). Prototypowy przykład antyaromatyczności, cyklobutadienu , jest przedmiotem debaty, a niektórzy naukowcy argumentują, że antyaromatyczność nie jest głównym czynnikiem przyczyniającym się do jego destabilizacji. Cyklooktatetraen na pierwszy rzut oka wydaje się być antyaromatyczny, ale jest doskonałym przykładem cząsteczki przyjmującej niepłaską geometrię, aby uniknąć destabilizacji wynikającej z antyaromatyczności. Ponieważ związki antyaromatyczne są często krótkotrwałe i trudne w obróbce eksperymentalnej, energia destabilizacji antyaromatycznej jest często modelowana raczej za pomocą symulacji niż eksperymentów.
Spektroskopia NMR
Paramagnetyczny prąd pierścieniowy wynikający z delokalizacji elektronów w związkach antyaromatycznych można zaobserwować za pomocą NMR . Ten prąd pierścieniowy prowadzi do odsłaniania (przesunięcia pola w dół) jąder wewnątrz pierścienia i ekranowania (przesunięcia w górę pola) jąder na zewnątrz pierścienia. [12]annulen jest węglowodorem antyaromatycznym, który jest wystarczająco duży, aby mieć protony zarówno wewnątrz, jak i na zewnątrz pierścienia. Przesunięcie chemiczne dla protonów wewnątrz jego pierścienia wynosi 5,91 ppm, a dla protonów poza pierścieniem 7,86 ppm, w porównaniu do normalnego zakresu 4,5-6,5 ppm dla niearomatycznych alkenów. Efekt ten ma mniejszą wielkość niż odpowiadające mu przesunięcia w związkach aromatycznych.
Wiele związków aromatycznych i antyaromatycznych ( benzen i cyklobutadien ) jest zbyt małych, aby mieć protony wewnątrz pierścienia, gdzie efekty ekranowania i odsłaniania mogą być bardziej przydatne diagnostycznie w określaniu, czy związek jest aromatyczny, antyaromatyczny czy niearomatyczny. Analiza niezależnego przesunięcia chemicznego jądra (NICS) to metoda obliczania ekranowania (lub odsłaniania) pierścienia w środku układu pierścieniowego w celu przewidywania aromatyczności lub antyaromatyczności. Ujemna wartość NICS wskazuje na aromatyczność, a wartość dodatnia na antyaromatyczność.
Przykłady
Chociaż istnieje wiele cząsteczek, które na papierze wydają się być antyaromatyczne, liczba cząsteczek, które są antyaromatyczne w rzeczywistości, jest znacznie mniejsza. Jest to potęgowane przez fakt, że zazwyczaj nie można tworzyć pochodnych cząsteczek antyaromatycznych przez dodanie większej liczby pierścieni węglowodorowych przeciwaromatycznych itp., Ponieważ cząsteczka zazwyczaj traci albo swój płaski charakter, albo sprzężony układ elektronów π i staje się niearomatyczna. W tej sekcji uwzględniono tylko przykłady związków antyaromatycznych, które nie podlegają dyskusji.
Pentalen jest związkiem antyaromatycznym, który od dziesięcioleci jest dobrze badany zarówno eksperymentalnie, jak i obliczeniowo. Jest dicykliczny, płaski i ma osiem elektronów π, spełniając definicję antyaromatyczności IUPAC. Stany dianionowe i dykationowe pentalenu są aromatyczne, ponieważ są zgodne z regułą Hückela 4 n + 2 π-elektronów.
Heksadehydro-[12]annulen
Podobnie jak jego odpowiednik [12]annulen , heksadehydro-[12]annulen jest również przeciwaromatyczny. Jego struktura została zbadana obliczeniowo za pomocą ab initio i teorii funkcjonału gęstości i potwierdzono, że jest antyaromatyczna.
cyklobutadien
Cyklobutadien jest klasycznym podręcznikowym przykładem związku przeciwaromatycznego. Konwencjonalnie uważa się, że jest planarny, cykliczny i ma 4 elektrony π (4 n dla n = 1) w układzie sprzężonym.
Jednak od dawna kwestionowano, czy cyklobutadien jest rzeczywiście antyaromatyczny, a ostatnie odkrycia sugerują, że może tak nie być. Cyklobutadien jest szczególnie zdestabilizowany, co pierwotnie przypisywano działaniu antyaromatycznemu. Jednak cyklobutadien przyjmuje bardziej charakter podwójnego wiązania w dwóch swoich wiązaniach równoległych niż inne, a elektrony π nie są zdelokalizowane między dwoma wiązaniami przypominającymi wiązania podwójne, co nadaje mu kształt prostokąta w przeciwieństwie do zwykłego kwadratu. Jako taki cyklobutadien zachowuje się jak dwa oddzielne alkeny połączone dwoma pojedynczymi wiązaniami, a zatem jest raczej niearomatyczny niż antyaromatyczny.
Pomimo braku tego π-antiaromatycznego efektu destabilizacji, żaden z jego 4 n krewnych elektronów π (cyklooktatetraen itp.) Nie miał nawet zbliżonej destabilizacji, co sugeruje, że w przypadku cyklobutadienu dzieje się coś więcej. Stwierdzono, że połączenie odkształcenia kątowego , odkształcenia skrętnego i odpychania Pauliego prowadzi do skrajnej destabilizacji doświadczanej w tej cząsteczce.
To odkrycie jest niezręczne, ponieważ zaprzecza podstawowym naukom o antyaromatyczności. W tej chwili zakłada się, że cyklobutadien będzie nadal używany do wprowadzania pojęcia antyaromatyczności do podręczników dla wygody, mimo że klasyfikacja go jako antyaromatycznego technicznie może nie być trafna.
Kation cyklopentadienylu
Kation cyklopentadienylowy to kolejny podręcznikowy przykład związku przeciwaromatycznego. Konwencjonalnie uważa się, że jest planarny, cykliczny i ma 4 elektrony π (4 n dla n = 1) w układzie sprzężonym.
Jednak od dawna kwestionowano, czy kation cyklopentadienylu jest rzeczywiście antyaromatyczny, a ostatnie odkrycia sugerują, że może tak nie być. Stan singletowy o najniższej energii jest antyaromatyczny, ale stan trypletowy o najniższej energii jest aromatyczny ze względu na regułę Bairda , a badania przeprowadzone w 2007 roku wykazały, że stan trypletowy jest stanem podstawowym .
Cyklooktatetraen
Cyklooktatetraen to kolejny przykład cząsteczki, która nie jest antyaromatyczna, chociaż początkowo może się tak wydawać. Cyclooctatetraene przyjmuje konformację wanny (tj. przypominającą łódkę). Ponieważ nie jest płaski, chociaż ma 4 n elektronów π, elektrony te nie są zdelokalizowane i sprzężone. Cząsteczka jest zatem niearomatyczna.
Wpływ na reaktywność
Związki antyaromatyczne, często bardzo niestabilne, mogą być wysoce reaktywne w celu złagodzenia destabilizacji antyaromatycznej. Na przykład cyklobutadien szybko dimeryzuje bez potencjalnej bariery energetycznej w reakcji cykloaddycji 2 + 2, tworząc tricyklooktadien. Podczas gdy antyaromatyczny charakter cyklobutadienu jest przedmiotem debaty, zwykle przywołuje się ulgę w działaniu antyaromatycznym jako siłę napędową tej reakcji.
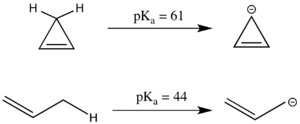
Antyaromatyczność może również mieć znaczący wpływ na pKa . Liniowy związek propen ma ap Ka równe 44, co jest stosunkowo kwaśne dla centrum węglowego sp 3 , ponieważ powstały anion allilowy może być stabilizowany rezonansowo. Wydaje się, że analogiczny układ cykliczny ma jeszcze bardziej ustabilizowany rezonans, ponieważ ładunek ujemny można przenieść na trzy węgle zamiast dwóch. Jednak anion cyklopropenylu ma 4 elektrony π w układzie cyklicznym i w rzeczywistości ma znacznie wyższe p Ka niż 1-propen, ponieważ jest antyaromatyczny, a tym samym destabilizowany. Ponieważ związki antyaromatyczne są często krótkotrwałe i trudne w obróbce eksperymentalnej, energia destabilizacji antyaromatycznej jest często modelowana raczej za pomocą symulacji niż eksperymentów.
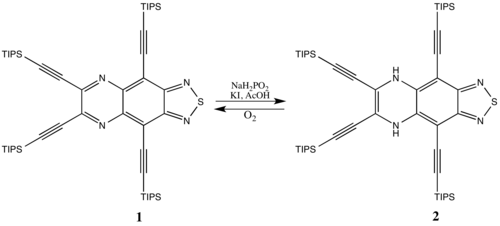
Niektóre związki antyaromatyczne są stabilne, zwłaszcza większe układy cykliczne (w których destabilizacja antyaromatyczna nie jest tak znacząca). Na przykład gatunki aromatyczne 1 można zredukować do 2 ze stosunkowo niewielką karą za utworzenie układu przeciwaromatycznego. Środek przeciwaromatyczny 2 z czasem powraca do związków aromatycznych 1 w reakcji z tlenem w powietrzu, ponieważ preferowana jest aromatyczność.
Utrata antyaromatowości może czasami być siłą napędową reakcji. W następującej tautomeryzacji keto-enolu produkt enol jest bardziej stabilny niż pierwotny keton, mimo że keton zawiera aromatyczną część benzenu (niebieski). Jednak istnieje również ugrupowanie laktonu przeciwaromatycznego (zielone). Zwolnienie destabilizacji antyaromatycznej zapewnia siłę napędową, która przewyższa nawet utratę aromatycznego benzenu.