Domena białkowa UBA
| UBA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
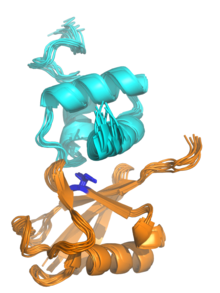 Struktura NMR domeny UBA z białka ubikwiliny-1 (góra, cyjan) związanego z ubikwityną (dół, pomarańcz), ilustrująca strukturę wiązki trzech helis w domenie UBA. Izoleucyna 44, środek hydrofobowego plastra na powierzchni ubikwityny, który oddziałuje z wieloma domenami wiążącymi ubikwitynę , jest podświetlony na niebiesko. Renderowane z .
| |||||||||
| Identyfikatory | |||||||||
| Symbol | UBA | ||||||||
| Pfam | PF00627 | ||||||||
| Klan Pfam | CL0214 | ||||||||
| InterPro | IPR015940 | ||||||||
| PROZYTA | PDOC50030 | ||||||||
| SCOP2 | 1efu / ZAKRES / SUPFAM | ||||||||
| CDD | cd00194 | ||||||||
| |||||||||
Domeny związane z ubikwityną (UBA) to domeny białkowe , które niekowalencyjnie oddziałują z ubikwityną poprzez interakcje białko-białko . Ubikwityna jest małym białkiem, które jest kowalencyjnie połączone z innymi białkami jako część wewnątrzkomórkowych szlaków sygnałowych, często jako sygnał do degradacji białek . Domeny UBA należą do najczęstszych domen wiążących ubikwitynę .
Funkcjonować
Białka zawierające domeny UBA biorą udział w różnych dodatkowych procesach komórkowych, takich jak naprawa przez wycinanie nukleotydów (NER), duplikacja ciał biegunów wrzeciona i wzrost komórek .
Degradacja białek za pośrednictwem systemu proteasomów ubikwityny (UPS) umożliwia komórce selektywną negatywną regulację białek wewnątrzkomórkowych. Degradacja białek pomaga w utrzymaniu kontroli jakości białek, sygnalizacji i progresji cyklu komórkowego. Zaproponowano UBA, aby ograniczyć wydłużenie łańcucha ubikwityny i skierować poliubikwitynowane białka do proteasomu 26S w celu degradacji. Zostały zidentyfikowane w modułowych białkach zaangażowanych w handel białkami, naprawę DNA , degradację proteasomów i regulację cyklu komórkowego.
Struktura
Domeny UBA mają wspólny motyw sekwencji składający się z około 45 reszt aminokwasowych . Składają się w struktury wiązek trzech helis .
Przykłady
Ludzki homolog drożdży Rad23A jest jednym z przykładów białka naprawy wycinania nukleotydów , które zawiera zarówno wewnętrzną, jak i C-końcową domenę UBA . Struktura rozwiązania ludzkiego Rad23A UBA(2) wykazała , że domena tworzy zwartą wiązkę trzech helis.
Porównanie struktur UBA (1) i UBA(2) ujawnia, że oba tworzą bardzo podobne fałdy i mają zachowaną dużą hydrofobową powierzchnię, która może być wspólną powierzchnią oddziałującą z białkami obecną w różnych domenach UBA . Dowody na to, że ubikwityna wiąże się z domenami UBA, prowadzą do przewidywania, że hydrofobowa powierzchnia domen UBA oddziałuje z hydrofobową powierzchnią pięcioniciowego arkusza beta ubikwityny.
Ta domena jest podobna w sekwencji do N-końcowej domeny czynnika wydłużania translacji EF1B (lub EF-Ts) z bakterii, mitochondriów i chloroplastów .
