Drobnoustroje związane z astmą
Przewlekłe zakażenia Mycoplasma pneumoniae i Chlamydia pneumoniae są związane z wystąpieniem i zaostrzeniem astmy . Te infekcje bakteryjne powodują przewlekłe zapalenie dolnych dróg oddechowych , upośledzenie klirensu śluzowo-rzęskowego, zwiększenie produkcji śluzu i ostatecznie astmę. Co więcej, dzieci, które we wczesnym dzieciństwie doświadczają ciężkich wirusowych infekcji dróg oddechowych, mają duże prawdopodobieństwo zachorowania na astmę w późniejszym dzieciństwie. Te wirusowe infekcje dróg oddechowych są najczęściej powodowane przez syncytialny wirus oddechowy (RSV) i ludzki rinowirus (HRV). Chociaż infekcje RSV zwiększają ryzyko astmy we wczesnym dzieciństwie, związek między astmą a RSV zmniejsza się wraz z wiekiem. Z drugiej strony HRV jest ważną przyczyną zapalenia oskrzelików i jest silnie związana z rozwojem astmy. U dzieci i dorosłych z rozpoznaną astmą wirusowe infekcje górnych dróg oddechowych (URI), zwłaszcza zakażenia HRV, mogą powodować ostre zaostrzenia astmy. Zatem Chlamydia pneumoniae , Mycoplasma pneumoniae i ludzkie rinowirusy są drobnoustrojami, które odgrywają główną rolę w astmie nieatopowej.
Astma
Według Hertzena (2002) wspólną cechą pacjentów z astmą jest posiadanie komórek nabłonkowych, które reagują na uraz poprzez zwiększenie zdolności wytwarzania cytokin prozapalnych i profibrogennych, zamiast naprawy uszkodzonej warstwy nabłonkowej. W rezultacie stan zapalny i związany z nim proces gojenia prowadzi do powstawania blizn i przebudowy tkanek, które są objawami występującymi u prawie wszystkich chorych na astmę. Zatem astma jest przewlekłą chorobą zapalną dróg oddechowych. Astmę dzieli się na dwie podgrupy: atopową (zewnętrzną) i nieatopową (wewnętrzną). Podgrupa atopowa jest ściśle związana z rodzinnym wywiadem choroby, podczas gdy podgrupa nieatopowa ma swój początek w wieku dorosłym i nie jest spowodowana dziedziczeniem. Wiadomo, że astma nieatopowa ma cięższy przebieg kliniczny niż astma atopowa. Astma nieatopowa może być spowodowana przewlekłymi infekcjami wirusowymi, bakteryjnymi lub kolonizacją bakteriami chorobotwórczymi.
Rozróżnienie między astmą atopową i nieatopową jest zróżnicowane. „Atopowe” definiuje się jako mające jeden lub więcej pozytywnych testów skórnych na zestaw typowych alergenów wziewnych, jednak w porównaniu z osobami bez astmy, zarówno atopowi, jak i nieatopowi astmatycy mają podwyższone poziomy IgE w surowicy (przeciwciało „alergiczne”), co jak się uważa bardziej bezpośrednio odpowiedzialne za objawy astmy. Niedawna metaanaliza wykazała, że ogólne populacyjne ryzyko IgE swoistej dla C. pneumoniae w przewlekłej astmie wynosiło 47% i było silnie i dodatnio związane z ciężkością choroby. Ryzyko związane z populacją to odsetek chorób, które można potencjalnie przypisać badanemu czynnikowi ryzyka, co wskazuje na możliwość zakażenia tym „ukrytym patogenem” jako istotny czynnik przyczyniający się do zapadalności na astmę i chorobowość.
Powiązane mikroorganizmy
Chlamydophila pneumoniae
Ogólne opisy
Chlamydophila pneumoniae , wcześniej znana jako Chlamydia pneumoniae , jest bakterią należącą do typu Chlamydiae, rzędu Chlamydiales i rodzaju Chlamydophila . Ma kształt pręcika i jest Gram-ujemny. Ma charakterystyczne ciałko elementarne w kształcie gruszki (EB), które jest otoczone przestrzenią peryplazmatyczną, co odróżnia je morfologicznie od okrągłych EB C. trachomatis i C. psittaci . C. pneumoniae jest nieruchoma i wykorzystuje oddychanie tlenowe. Jako bezwzględna bakteria wewnątrzkomórkowa, C. pneumoniae jest zarówno pasożytem, jak i mezofilem.
Biologiczne interakcje z żywicielem
C. pneumoniae może rosnąć w monocytach, makrofagach, komórkach śródbłonka i mięśni gładkich. Replikuje się w cytoplazmie komórki gospodarza. Ze względu na to, że nie posiada zdolności syntezy własnego ATP, jest całkowicie zależny od energii wytwarzanej przez gospodarza. Ponowna infekcja gospodarza przez C. pneumoniae jest powszechna, ponieważ pamięć odporności wywoływana przez C. pneumoniae jest krótkotrwała i częściowa. Ponadto C. pneumoniae ma tendencję do utrzymywania się z powodu niedoborów IFN-γ, penicyliny i składników odżywczych. Niedobory te uniemożliwiają C. pneumoniae zakończenie normalnego cyklu rozwojowego, co prowadzi do powstawania nieprawidłowych, niezakaźnych C. pneumoniae , które utrzymują się w ludzkim gospodarzu. Zakażenie C. zapaleniem płuc może być nie tylko uporczywe i przewlekłe, ale także powodować nieodwracalne uszkodzenia tkanek i procesy bliznowacenia, które są objawami u pacjentów z astmą. Zakażenie C. pneumoniae wywołuje zarówno humoralną, jak i komórkową odpowiedź immunologiczną. Spośród dwóch odpowiedzi immunologicznych, komórkowa odpowiedź immunologiczna, która obejmuje w szczególności limfocyty T CD8+, jest kluczowa dla wyeliminowania C. pneumoniae , podczas gdy humoralna odpowiedź immunologiczna wydaje się być raczej nieskuteczna w ochronie przed infekcją C. pneumoniae. W rzeczywistości limfocyty T CD8+ są tak ważne, że jeśli nie występują u gospodarza, infekcja C. pneumonia postępuje szybko. Chociaż komórkowa odpowiedź immunologiczna jest odpowiedzialna za eliminację C. pneumoniae , ta odpowiedź może być szkodliwa dla gospodarza, ponieważ sprzyja rozwojowi stanu zapalnego, który może prowadzić do astmy.
Role w astmie
Istnieje silny związek C. pneumoniae z długotrwałą astmą wśród astmy nieatopowej w porównaniu z astmą atopową. W rzeczywistości ciężkość astmy można określić na podstawie podwyższonego miana C. pneumoniae , ale nie innych potencjalnych patogenów, takich jak Mycoplasma pneumoniae , adenowirus, grypa A i B lub wirus grypy rzekomej. Przypuszcza się, że C. pneumoniae jest związana z astmą, ponieważ stwierdzono, że C. pneumoniae powoduje ciliostazę w komórkach nabłonka oskrzeli. Tymczasem dane seroepidemiologiczne również dostarczają dowodów na poparcie, że C. pneumoniae odgrywa rolę w astmie, wzmacniając stan zapalny i inicjując proces chorobowy. Związek C. pneumoniae i astmy zaczyna się od C. pneumoniae wytwarzającej białka szoku cieplnego o masie cząsteczkowej 60 kDa, które zapewniają przedłużoną stymulację antygenową. To szczególne białko szoku cieplnego jest znane jako członek rodziny białek stresowych hsp60, które można znaleźć zarówno u eukariontów, jak i u prokariotów. Wytwarzanie hsp60 pozostaje niezmienione nawet wtedy, gdy C. pneumoniae jest w stanie uśpienia i nie replikuje się, ponieważ ten hsp60 służy jako antygen ochronny. Jego stymulacja antygenowa silnie wzmacnia przewlekły stan zapalny poprzez zwiększenie produkcji cytokin prozapalnych, czynnika martwicy nowotworów (TNF)-α, interleukiny (IL)-1β, IL-6 i IFN-γ przez zakażone komórki, co ostatecznie prowadzi do immunopatologicznego uszkodzenia tkanek i blizny w płucach chorych na astmę. Ponadto zakażenie C. pneumonia indukuje również odpowiedzi immunoglobulin w surowicy IgA i IgG, które są związane z przewlekłą astmą. Co najbardziej uderzające, niedawny przegląd systematyczny i metaanaliza wykazały, że C. pneumoniae były związane z prawie połową badanych przypadków astmy. Wreszcie, coraz więcej dowodów z badań na modelach zwierzęcych wskazuje, że C. pneumoniae nie tylko tworzy „fenotyp astmy”, ale także indukuje wcześniej niealergiczne zwierzęta do wykazywania reakcji alergicznych na egzogenne (tj. nie chlamydiowe) alergeny.
Mycoplasma pneumoniae
Ogólne opisy
M. pneumoniae to bakteria należąca do gromady Firmicutes, klasy Mollicutes, rzędu Mycoplasmatales i rodziny Mycoplasmataceae. Jest albo nitkowaty, albo kulisty. Pojedyncze wrzecionowate komórki M. pneumoniae mają długość od 1 do 2 µm i szerokość od 0,1 do 0,2 µm. M. pneumoniae jest ruchliwą, mezofilną bakterią, która wykazuje obligatoryjne oddychanie tlenowe. Jest to zewnątrzkomórkowa bakteria związana z gospodarzem, która nie ma ściany komórkowej i nie jest w stanie przetrwać poza gospodarzem z powodu niestabilności osmotycznej w środowisku.
Biologiczne interakcje z żywicielem
M. pneumoniae może powodować infekcje u ludzi, zwierząt, roślin i kultur komórkowych. Jest to bakteria pasożytnicza, która atakuje błony śluzowe górnych i dolnych dróg oddechowych, w tym nosogardło, gardło, tchawicę, oskrzela, oskrzeliki i pęcherzyki płucne. Aby przeżyć, M. pneumoniae potrzebuje niezbędnych składników odżywczych i związków, takich jak aminokwasy, cholesterol, prekursory do syntezy kwasów nukleinowych oraz kwasy tłuszczowe pozyskiwane z komórek nabłonka błony śluzowej gospodarza. Jego białka adhezyjne przyłączają się do komórek nabłonka tchawicy za pośrednictwem sialoglikoprotein lub receptorów sialoglikolipidowych, które znajdują się na powierzchni komórek. Po przyczepieniu może spowodować uszkodzenie komórki nabłonka oddechowego. , że uszkodzenie komórek nabłonka gospodarza spowodowane M. pneumoniae jest spowodowane wytwarzaniem wysoce reaktywnych form: nadtlenku wodoru (H 2 O 2 ) i rodników ponadtlenkowych (O 2 – ). M. pneumoniae ma potencjał do lokalizacji wewnątrzkomórkowej. Istnienie wewnątrzkomórkowe M. pneumoniae może ułatwiać powstawanie stanów utajonych lub przewlekłych, omijać mechanizmy immunologiczne mykoplazmy, jego zdolność do przekraczania barier śluzówkowych i uzyskiwania dostępu do tkanek wewnętrznych. Poza tym fuzja błony komórkowej mykoplazmy z błoną gospodarza nie tylko powoduje uwolnienie różnych enzymów hydrolitycznych wytwarzanych przez mykoplazmę , ale także prowadzi do wstawienia składników błony mykoplazmy do błony komórkowej gospodarza, co może potencjalnie zmienić miejsca rozpoznawania receptorów i wpływają na indukcję i ekspresję cytokin. Jak stwierdzili Nisar i in. (2007), M. pneumonia może utrzymywać się w drogach oddechowych do kilku miesięcy po wyzdrowieniu z ostrego zapalenia płuc. W rzeczywistości M. pneumoniae można hodować z wydzielin oddechowych nawet po leczeniu pacjentów z zapaleniem płuc skutecznymi antybiotykami. Tak więc infekcja M. pneumoniae jest przewlekła i uporczywa. Poza tym Nisar i in. (2007) dodaje również, że infekcja M. pneumonia powoduje nieprawidłowości strukturalne płuc, skutkujące zmniejszeniem szybkości przepływu wydechowego i zwiększeniem nadreaktywności dróg oddechowych u osób bez astmy.
Role w astmie
Infekcja M. pneumonia jest odpowiedzialna za wywołanie zaostrzenia astmy u 3,3 do 50% w takich przypadkach. Ponadto zapalenie wywołane przez M. pneumoniae może również poprzedzać wystąpienie astmy, ponieważ u pacjentów z ostrą infekcją wywołaną przez M. pneumonia , po której następuje rozwój astmy, następuje znaczna poprawa czynności płuc i objawów astmy po zastosowaniu leczenia przeciwdrobnoustrojowego przeciwko zapaleniu płuc wywołanemu przez M. . Uwalnianie cytokin prozapalnych w odpowiedzi na zakażenie M. pneumoniae zostało wskazane jako możliwy mechanizm prowadzący do astmy oskrzelowej. Dzieje się tak dlatego, że wzrost produkcji cytokin skutkuje ciągłą odpowiedzią zapalną w drogach oddechowych, po której następują negatywne skutki, takie jak immunopatologiczne uszkodzenie tkanek i bliznowacenie, jak opisano w sekcji Rola C. pneumonia w astmie . Ponadto stwierdzono, że pacjenci z astmą mają zwiększone uwalnianie cytokin typu II, zwłaszcza IL4 i IL5, ale normalny lub niski poziom wytwarzania cytokin typu I. Podobnie infekcja M. pneumoniae sprzyja odpowiedzi T pomocniczej typu 2, dlatego M. pneumoniae mają zwiększoną ekspresję czynnika martwicy nowotworu a, IL4 i IL5 w drogach oddechowych. Dominująca choroba dróg oddechowych typu T pomocniczego 2 spowodowana zakażeniem M. zapaleniem płuc może prowadzić do nadreaktywności IgE-zależnej i funkcji eozynofili, co prowadzi do wystąpienia astmy. Istnieje również możliwość, że infekcja M. pneumoniae może niszczyć komórki błony śluzowej dróg oddechowych i ułatwiać penetrację antygenów do błony śluzowej. Badanie przeprowadzone przez Laitinena i in. (1976) sugeruje, że infekcja M. pneumoniae obnaża powierzchnię nabłonka i odsłania drażniące receptory. Ponadto M. pneumoniae indukuje aktywację komórek tucznych poprzez uwalnianie serotoniny i heksozoaminidazy. Wytwarzając antygen, M. pneumonia jest w stanie zainicjować odpowiedź przeciwciał. Jego antygen wchodzi w interakcję z IgE, która przyłącza się do komórek tucznych, prowadząc do stymulacji uwalniania histaminy, po której następuje niedrożność dróg oddechowych.
Ludzkie rinowirusy (HRV)
Ogólne opisy
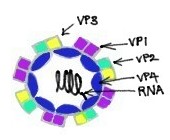
Wiadomo, że rinowirusy są najważniejszymi powszechnymi wirusami przeziębienia. Są to wirusy o dodatniej nici ssRNA bez stadium DNA i są klasyfikowane w rodzinie Picornaviridae. Rinowirusy są małe, mają długość około 30 nm i nie zawierają otoczki. Ich dwudziestościenne kapsydy zawierają 4 białka: VP1, VP2, VP3 i VP4. VP1, VP2 i VP3 znajdują się na powierzchni kapsydu i są odpowiedzialne za różnorodność antygenową rinowirusów. Natomiast VP4 znajduje się wewnątrz wirusa, a jego funkcją jest zakotwiczenie rdzenia RNA w kapsydzie wirusowym. Dzieląc podstawowe właściwości z enterowirusami, takie jak rozmiar, kształt, skład kwasu nukleinowego i odporność na eter, rinowirusy różnią się od enterowirusów większą gęstością wyporności i podatnością na inaktywację, jeśli są wystawione na działanie kwaśnego środowiska. Niemniej jednak mają wspólnego przodka z enterowirusami.
Biologiczne interakcje z żywicielem
Optymalna temperatura replikacji rinowirusa to 33-35°C, co odpowiada temperaturze błony śluzowej nosa. W temperaturze 37°C tempo replikacji wirusa spada do 10% do 50% wartości optymalnej. Może to być główny powód, dla którego rinowirusy mogą replikować się lepiej w kanałach nosowych i górnym drzewie tchawiczo-oskrzelowym niż w dolnych drogach oddechowych. Większość serotypów rinowirusów wiąże się z cząsteczką adhezji międzykomórkowej (ICAM), podczas gdy około 10% serotypów wiąże się z receptorem lipoprotein o małej gęstości. Zwykle rinowirusy infekują małe skupiska komórek w warstwie nabłonka z niewielką cytotoksycznością komórkową. Chociaż w zakażonym nabłonku nosa obserwuje się wzrost liczby neutrofili polimorfojądrowych, infekcja powoduje niewielkie lub żadne uszkodzenie błony śluzowej. Niemniej jednak infekcja rinowirusem prowadzi do objawów przeziębienia, które jest przede wszystkim chorobą górnych dróg oddechowych. Receptory rinowirusów są niewrażliwe na neuraminidazę, ale są wrażliwe na enzymy proteolityczne.
Role w astmie
U pacjentów z astmą w wieku od 9 do 11 lat 80% do 85% zaostrzeń astmy związanych ze zmniejszonym szczytowym przepływem wydechowym i świszczącym oddechem było spowodowanych wirusowymi infekcjami górnych dróg oddechowych (URI). Wysokie wskaźniki ataków astmy spowodowane infekcją rinowirusem występują również u dorosłych. Okazuje się, że rinowirusy są zdolne do indukowania komórek nabłonkowych do wytwarzania prozapalnych cytokin, które powodują nadreaktywność dróg oddechowych, neurogenne odpowiedzi zapalne, wydzielanie śluzu, rekrutację i aktywację komórek zapalnych oraz wyciek osocza. Aby poprzeć to stwierdzenie, pacjenci z astmą zakażeni rinowirusem wykazali wzrost nadreaktywności dróg oddechowych, niedrożności dróg oddechowych i stanów zapalnych. Podobnie infekcja rinowirusem spowodowała, że osoby z alergicznym zapaleniem błony śluzowej nosa, ale bez astmy w wywiadzie, miały znacznie zwiększoną nadreaktywność dróg oddechowych, jak również znacznie zwiększoną częstość późnych reakcji astmatycznych. Pokazuje to, że oprócz powodowania nadreaktywności dróg oddechowych rinowirus sprzyja również wystąpieniu astmy nieatopowej. Ponadto infekcja rinowirusem sprzyja również rekrutacji eozynofili do segmentów dróg oddechowych po prowokacji antygenem, a tym samym nasila odpowiedź zapalną dróg oddechowych na antygeny, prowadząc do rozwoju astmy.