Efekt ortogonalny
Efekt orto odnosi się głównie do zespołu efektów sterycznych i niektórych oddziaływań wiązań wraz z efektami polarnymi wywołanymi przez różne podstawniki znajdujące się w danej cząsteczce, powodujące zmiany jej właściwości chemicznych i fizycznych. W ogólnym sensie efekt orto jest związany z podstawionymi związkami benzenu.
Istnieją trzy główne efekty orto w podstawionych związkach benzenu: [ wymagane wyjaśnienie ]
- Efekt orto w podstawionym kwasie benzoesowym (pierwszy efekt orto) : Orto-podstawione kwasy benzoesowe są silniejszymi kwasami niż ich izomery meta i para, niezależnie od natury podstawnika
- Efekt orto w podstawionej anilinie (drugi efekt orto / efekt SIP) : aniliny podstawione w orto są słabszymi zasadami niż ich izomery meta i para, niezależnie od natury podstawnika
- Efekt orto w elektrofilowym podstawieniu aromatycznym dipodstawionych związków benzenu (trzeci efekt orto) : Odnosi się do zestawu efektów sterycznych, które określają regioselektywność napływającego elektrofilu w dipodstawionych związkach benzenu, gdzie grupa meta-kierująca jest meta do orto-para- grupa reżyserska.
Pierwszy efekt orto w podstawionych kwasach benzoesowych
Gdy jakakolwiek grupa jest obecna w pozycji orto do grupy karboksylowej w podstawionym kwasie benzoesowym, wtedy kwasowy charakter tego związku staje się co najmniej bardziej niż kwas benzoesowy. Generalnie orto-podstawione kwasy benzoesowe są silniejszymi kwasami niż ich izomery meta i para. Poniższa tabela przedstawia wartości pKa różnych monopodstawionych kwasów benzoesowych.
- Efekt orto jest duży dla kwasów nitrobenzoesowych, które wykazują prawie 20-krotny wzrost kwasowości, około 8-krotny współczynnik dla kwasów halobenzoesowych i 2,5 do 3-krotny wzrost dla podstawników metylowych i cyjanowych.
- Kwasy metoksybenzoesowe są wyjątkowe pod tym względem, że izomery orto i meta mają prawie identyczne pKa ( ok. 4,1), prawdopodobnie z powodu wyjątkowego oddawania elektronów p-π z tlenu.
Ogólne wyjaśnienie pierwszego efektu orto
Gdy grupa jest obecna w pozycji orto do grupy kwasu karboksylowego w podstawionym kwasie benzoesowym, zawada steryczna zmusza grupę karboksylową do wykręcenia się z płaszczyzny pierścienia benzenowego. Hamuje to rezonans grupy karboksylowej z pierścieniem fenylowym, co zwiększa kwasowość grupy karboksylowej, która w innym przypadku została zmniejszona z powodu destabilizującej koniugacji krzyżowej. W rzeczywistości ta destabilizująca koniugacja krzyżowa jest również uważana za przyczynę zmniejszonej kwasowości kwasu benzoesowego w porównaniu z kwasem mrówkowym.
Również obecność donora wiązania wodorowego w pobliżu grupy karboksylowej może zwiększać jej kwasowość, jak wykazano w przypadku trzech izomerycznych kwasów hydroksybenzoesowych (patrz tabela powyżej). Wewnątrzcząsteczkowe wiązanie wodorowe donora orto-OH z tlenem karbonylu grupy karboksylowej, działając jako akceptor, zwiększa ładunek dodatni na węglu karbonylu, aw konsekwencji kwasowość karboksylu OH.
wartości pKa
| Podstawnik | Pozycja na ringu | ||
|---|---|---|---|
| Orto | Meta | ust | |
| H | 4.2 | 4.2 | 4.2 |
| CH 3 | 3.9 | 4.3 | 4.4 |
| F | 3.3 | 4.3 | 4.4 |
| Kl | 2.9 | 3.8 | 4.0 |
| br | 2.8 | 3.8 | 4.0 |
| I | 2.9 | 3.9 | 4.0 |
| O ja | 4.1 | 4.1 | 4.5 |
| NIE 2 | 2.2 | 3.5 | 3.4 |
| OH | 2,98 | 4.08 | 4.58 |
Drugi efekt orto: efekt orto w podstawionej anilinie (steryczne hamowanie protonowania).
Gdy jakakolwiek grupa jest obecna w pozycji orto do NH2 w anilinie, wtedy zasadowy charakter tego związku staje się co najmniej mniejszy niż aniliny. Na przykład zobacz kolejność zasadowości następującej podstawionej aniliny: -
- p-toluidyna > m-toluidyna > anilina > o-toluidyna
- Anilina > m-Nitroanilina > p-Nitroanilina > o-Nitroanilina
- Anilina > p-Haloanilina > m-Haloanilina > o-Haloanilina
- p-aminofenol pKb=8,50 > o-aminofenol pKb=9,28 > anilina pKb=9,38 > m-aminofenol pKb=9,80
Ogólne wyjaśnienie drugiego efektu orto
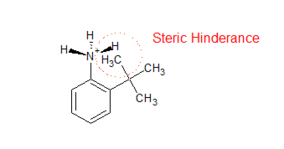
- Protonowanie podstawionej aniliny jest hamowane z powodu zawady sterycznej. Po protonowaniu hybrydyzacja azotu w grupie aminowej zmienia się od sp 2 do sp 3 , czyniąc grupę niepłaską. Powoduje to zawadę przestrzenną między orto-podstawioną grupą a atomem H grupy aminowej, co powoduje, że sprzężony kwas jest mniej stabilny, a tym samym zmniejsza zasadowość podstawionej aniliny (patrz rysunek po prawej).
Trzeci efekt orto: efekt orto w elektrofilowym podstawieniu aromatycznym dipodstawionych związków benzenu
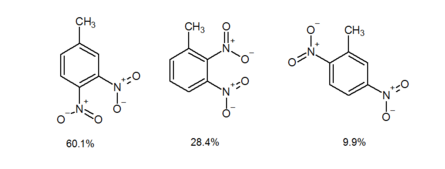
Kiedy meta-kierująca grupa jest meta do grupy orto-para-kierującej, grupa przychodząca idzie przede wszystkim orto do grupy meta-kierującej, a nie do para. Nazywa się to efektem orto. Nie ma jeszcze dobrego wyjaśnienia efektu orto, chociaż prawdopodobnie istnieje wewnątrzcząsteczkowa pomoc ze strony grupy metakierującej. Na przykład elektrofilowe nitrowanie aromatyczne 1-metylo-3-nitrobenzenu daje 4-metylo-1,2-dinitrobenzen i 1-metylo-2,3-dinitrobenzen z wydajnością odpowiednio 60,1% i 28,4%. W przeciwieństwie do tego, 2-metylo-1,4-dinitrobenzen (2c) jest izolowany z wydajnością zaledwie 9,9%. Jak pokazano w powyższym przykładzie, gdy podstawnik akceptorowy π (πAS) jest meta do podstawnika donorowego π (πDS), elektrofilowe nitrowanie aromatyczne zachodzi raczej w kierunku orto do πAS niż para.
Podobne wyniki zaobserwowano również w przypadku nitrowania kwasu 3-metylobenzoesowego, w którym jako główne związki otrzymano kwas 5-metylo-2-nitrobenzoesowy i kwas 3-metylo-2-nitrobenzoesowy, natomiast kwas 3-metylo-4-nitrobenzoesowy jako związek drugorzędny. Również podczas nitrowania kwasu 3-bromobenzoesowego jako główny produkt otrzymano kwas 5-bromo-2-nitrobenzoesowy (wydajność 83%), a jako produkt drugorzędny kwas 3-bromo-2-nitrobenzoesowy (wydajność 13%). Co ciekawe, nie wykryto potencjalnego izomeru kwasu 3-bromo-4-nitrobenzoesowego.
Efekt orto w reakcjach Dielsa-Aldera
W reakcjach Dielsa-Aldera z normalnym zapotrzebowaniem na elektrony dienofile podstawione przez Z reagują z 1-podstawionymi butadienami, dając 3,4-dipodstawione cyklohekseny, niezależnie od charakteru podstawników dienowych. Jest to również znane jako efekt orto.
Notatki
Linki zewnętrzne
- Tematy uzupełniające § Efekt orto – Wydział Chemii Uniwersytetu Stanowego Michigan