Efekt pola (chemia)
Efekt pola to polaryzacja cząsteczki w przestrzeni . Efekt jest wynikiem pola elektrycznego wytwarzanego przez lokalizację ładunku w cząsteczce. To pole, które jest zależne od podstawnika i konformacji , może wpływać na strukturę i reaktywność poprzez manipulowanie położeniem gęstości elektronowej w wiązaniach i/lub całej cząsteczce. Polaryzacja cząsteczki poprzez jej wiązania jest odrębnym zjawiskiem zwanym indukcją . Efekty pola są stosunkowo słabe i szybko maleją wraz z odległością, ale nadal stwierdzono, że zmieniają właściwości molekularne, takie jak kwasowość.
Źródła terenowe
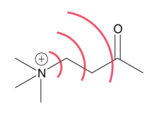
Efekty polowe mogą wynikać z elektrycznego pola dipolowego wiązania zawierającego atom elektroujemny lub podstawnik odciągający elektrony, a także z atomu lub podstawnika posiadającego ładunek formalny. Kierunkowość dipola i koncentracja ładunku mogą definiować kształt pola elektrycznego cząsteczki , które będzie manipulować lokalizacją gęstości elektronów w kierunku lub z dala od interesujących miejsc, takich jak kwaśny wodór. Efekty polowe są zwykle związane z ustawieniem pola dipolowego względem centrum reakcji. Ponieważ są to efekty przestrzenne, ważną kwestią jest trójwymiarowa struktura cząsteczki. Pole może zostać przerwane przez inne wiązania lub atomy przed propagacją do interesującego miejsca reaktywnego. Atomy o różnych elektroujemnościach mogą zbliżać się do siebie, powodując polaryzację wiązań w przestrzeni, która naśladuje efekt indukcyjny poprzez wiązania. Bicykloheptan i bicyklooktan (widoczny po lewej) to dwa związki, w których zmiana kwasowości wraz z substytucją została przypisana efektowi pola. stała dielektryczna jest niska , więc pole elektryczne może rozprzestrzeniać się przy minimalnym oporze.
Użyteczność efektu
Dipol może wyrównać się, aby ustabilizować lub zdestabilizować tworzenie się lub utratę ładunku, zmniejszając w ten sposób (jeśli jest ustabilizowany) lub zwiększając (jeśli jest zdestabilizowany) barierę aktywacji dla zdarzenia chemicznego. Efekty polowe mogą zatem dostroić kwasowość lub zasadowość wiązań w ich polach poprzez oddanie lub wycofanie gęstości ładunku. W odniesieniu do kwasowości powszechnie zauważa się, że indukcyjnie podstawnik odciągający elektrony w pobliżu kwaśnego protonu obniży pKa (tj. zwiększy kwasowość) i odpowiednio podstawnik dostarczający elektrony podniesie pKa . Taki sam skutek będzie miała reorganizacja ładunku ze względu na efekty polowe. Pole dipolowe rozchodzące się w przestrzeni wokół lub w środku cząsteczki w kierunku kwaśnego protonu zmniejszy kwasowość, podczas gdy dipol skierowany w przeciwną stronę zwiększy kwasowość i jednocześnie wydłuży wiązanie XH. Efekty te mogą zatem pomóc w dostrojeniu kwasowości / zasadowości cząsteczki w celu protonowania / deprotonowania określonego związku lub zwiększenia zdolności donora wiązań wodorowych do rozpoznawaniu molekularnym lub wykrywaniu anionów. Wykazano również, że efekty pola w podstawionych arenach dominują na mapach potencjału elektrostatycznego, które są mapami gęstości elektronów używanymi do wyjaśnienia interakcji międzycząsteczkowych.
Dowody na efekty polowe
Zlokalizowane efekty elektroniczne to połączenie efektów indukcyjnych i polowych. Ze względu na podobieństwo tych efektów trudno jest oddzielić ich wkład w strukturę elektronową cząsteczki. Istnieje jednak obszerna literatura poświęcona zrozumieniu względnego znaczenia indukcji i efektów polowych poprzez analizę pokrewnych związków w celu ilościowego określenia każdego efektu w oparciu o obecne podstawniki i geometrię cząsteczkową. Na przykład trzy związki po prawej stronie, wszystkie oktany , różnią się jedynie liczbą łączników między grupą odciągającą elektrony X a kwasową grupą funkcyjną, które są w przybliżeniu tej samej odległości przestrzennej w każdym związku. Wiadomo, że podstawnik odciągający elektrony obniża pKa danego protonu (tzn. zwiększa kwasowość) indukcyjnie. Jeśli indukcja była dominującym efektem w tych związkach, kwasowość powinna wzrastać liniowo wraz z liczbą dostępnych szlaków indukcyjnych (łączników). Jednak dane eksperymentalne pokazują, że wpływ na kwasowość w pokrewnych oktanach i kubanach jest bardzo podobny, a zatem dominujący efekt musi zachodzić w przestrzeni.
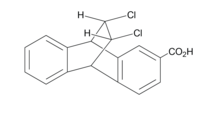
izomerach syn i anti kwasu cis-11,12-dichloro-9,10-dihydro-9,10-etano-2-antroowego, widocznych poniżej i po lewej stronie, chlorki zapewniają efekt pola. Stężenie ładunku ujemnego na każdym chlorze ma efekt przestrzenny, który można zobaczyć we względnych wartościach pKa. Kiedy chlorki są skierowane na grupę karboksylową, pKa jest wyższe, ponieważ utrata protonu jest mniej korzystna ze względu na wzrost ładunku ujemnego w tym obszarze. Utrata protonu skutkuje ładunkiem ujemnym, który jest mniej stabilny, jeśli istnieje już nieodłączna koncentracja elektronów. Można to przypisać efektowi pola, ponieważ w tym samym związku z chlorami skierowanymi z dala od grupy kwasowej pKa jest niższe, a gdyby efekt był indukcyjny, pozycja konformacyjna nie miałaby znaczenia.