Karben Fischera
w Karben Fischera jest dwuwartościowym ligandem organicznym związku metaloorganicznym . W karbenie Fischera ligand karbenowy jest ligandem σ-donorowym π-akceptorowym. Ponieważ π-backdonation z centrum metalu jest na ogół słaby, węgiel karbenowy jest elektrofilowy .
Karbeny Fischera zostały nazwane na cześć Ernsta Otto Fischera .
Struktura
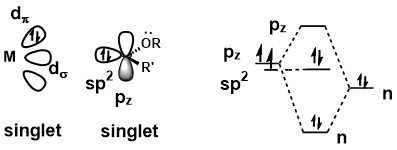
Kompleks karbenu metalu można uznać za karben Fischera, gdy karben jest w stanie singletowym . Delokalizacja samotnej pary z podstawnika na węglu karbenu podnosi energię orbitalu p z , zmuszając w ten sposób dwa elektrony karbenu do pozostania jako para elektronów. Wiązanie pomiędzy karbenem i metalowym centrum wymaga silnego oddania σ z orbitalu sp 2 do pustego orbitalu d na metalowym środku i słabego oddania zwrotnego π z metalowego centrum do pustego orbitalu p z . Ponieważ darowizna π jest słaba, węgiel karbenowy ma charakter elektrofilowy.
Ze względu na tę właściwość wiązania karbeny Fischera często charakteryzują się:
- środek metalowy o niskim stopniu utlenienia
- środkowe i późne metale przejściowe Fe(0), Mo(0), Cr(0)
- Ligandy metali akceptorowych π
- Podstawniki π-donorowe na atomie karbenu, takie jak grupy alkoksylowe i alkilowane grupy aminowe.
Przygotowanie
Najczęstszą strategią otrzymywania karbenu Fischera jest reakcja kompleksu karbonylu metalu ze związkami litoorganicznymi. Odpowiednia struktura podobna do enolanu litu jest wysoce stabilizowana, a zatem musi zostać wygaszona przez wysoce elektrofilowy odczynnik alkilujący, taki jak sól Meerweina. Alkilowanie za pomocą MeI można przeprowadzić za pomocą układu przeniesienia fazowego. Alternatywnie kation litu można wymienić na kation tetraalkiloamoniowy, aby uzyskać bardziej reaktywny enolan. Tę sól tetraalkiloamoniową można acylować, otrzymując wysoce elektrofilowy karben Fischera, podobny do mieszanego bezwodnika, który może ulegać podstawieniu nukleofilowemu alkoholem.
Karbeny Fischera z α-wodorem wytwarza się w reakcji anionu karbonylu metalu z formamidem. Traktowanie związku pośredniego nadmiarem chlorku trimetylosililu daje tę konkretną grupę kompleksu karbenowego Fischera.
Opracowanie karbenów Fischera
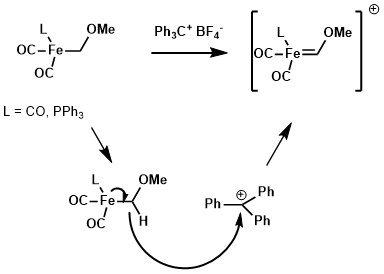
Za pomocą odpowiedniego odczynnika odrywającego wodorki, takiego jak kation tritylowy, wodorek na ligandzie alkilowym kompleksu metalu można oddzielić, tworząc karben Fischera.
Dekarbonylacja z niestabilizowanego karbenoidu metalu
Niedawno naukowcy z Hiszpanii poinformowali, że karben Fischera można skutecznie otrzymać z procesu dekarbonylacji karbenoidu metalu pochodzącego ze stabilizowanego związku diazowego.
Reaktywność
Reaktywność podobna do karbonylu
Węgiel karbenowy karbenu Fischera ma charakter elektrofilowy. Zatem karben Fischera wykazuje podobną reaktywność w porównaniu ze związkiem karbonylowym. Wiele reakcji można zrozumieć, stosując równoważną strukturę karboksylową, taką jak transestryfikacja, addycja Michaela i reakcja aldolowa. Cr(CO) 5 jest silną grupą odciągającą elektrony, powodującą, że proton α jest silnie kwaśny. Karben metoksychromowy z bocznym łańcuchem metylowym ma pKa 12,5 w wodnym roztworze acetonitrylu (stosunek objętościowy 1:1). Dla porównania, octan metylu ma pKa 25,6, co wskazuje na silny odciąganie elektronów przez ugrupowanie Cr(CO) 5 .
Silne odciąganie elektronów przez karben Fischera znajduje również odzwierciedlenie w wielu reakcjach. Na przykład reakcja Dielsa-Aldera między akrylanem metylu a izoprenem zakończyła się w ciągu 7 dni w temperaturze pokojowej z niską selektywnością para-meta. Z drugiej strony, karbenowy odpowiednik Fischera skończył w ciągu 3 godzin w temperaturze pokojowej ze znacznie wyższą selektywnością para-meta.
Urotropina, słaby nukleofil, może uczestniczyć w addycji Michaela do alkinylokarbenu Fischera, dając interesujący produkt podwójnej addycji.
Struktura podobna do enolanu, otrzymana przez deprotonowanie karbenu Fischera, może być alkilowana. Jednakże, ponieważ karboanion jest wysoce stabilizowany, potrzebny jest reaktywny odczynnik alkilujący, taki jak fluorosulfonian metylu (odczynnik „magiczny metyl”) lub bromooctan metylu.
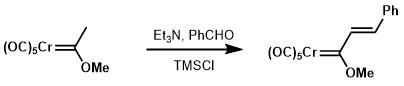
Kondensację aldolową karbenów Fischera można osiągnąć, stosując znacznie słabsze zasady w porównaniu z ich odpowiednikami karbonylowymi, takimi jak trietyloamina.
Demetalacja
Karbeny Fischera można utlenić do odpowiednich związków karbonylowych przy użyciu łagodnych utleniaczy, takich jak azotan cerowo-amonowy (CAN).
Jeśli łańcuch boczny karbenu Fischera zawiera proton α, można go odwracalnie zdeprotonować słabą zasadą, taką jak pirydyna. Ułatwia to tworzenie form wodorku chromu, które mogą ulec redukcyjnej eliminacji z wytworzeniem eteru cis-enolu.
Właściwości fotochemiczne karbenu Fischera
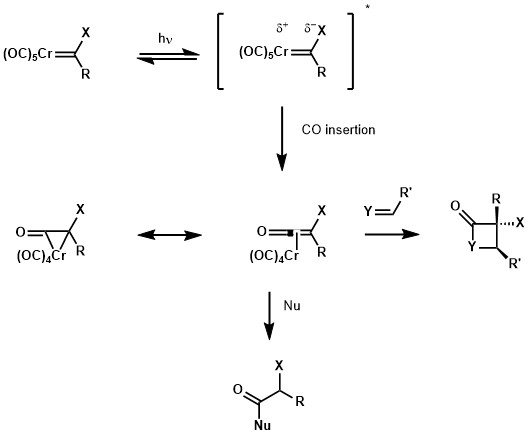
UV-VIS karbenu Fischera wykazało pasmo przenoszenia ładunku metal-ligand w bliskim ultrafiolecie. Z jednej strony to wzbudzenie promuje elektron z orbitalu z centrum metalu do orbitalu z centrum ligandu, czyniąc karben-węgiel bogatszym w elektrony. Z drugiej strony centrum metalu, już ubogie w elektrony z powodu ligandów karbonylowych, staje się bardziej ubogie w elektrony, ułatwiając migracyjną insercję do ligandu CO. Ta migrująca insercja daje metalocyklopropanon chromu, który jest rezonansową formą metalowanego ketenu. Przy reaktywności ketenu gatunek może zostać uwięziony przez kilka nukleofili, takich jak alkohole i aminy, lub może reagować w cykloaddycji [2 + 2] z alkenami, iminami lub aldehydem, dając odpowiednie addukty cyklobutanu, β-laktamu i β-laktonu.