Międzycząsteczkowe cyklopropanacje karbenoidów katalizowane metalami
Katalizowane metalem międzycząsteczkowe cyklopropanacje karbenoidów to reakcje organiczne , w wyniku których powstaje pierścień cyklopropanu z karbenoidów metalu i alkenu . W reakcji Simmonsa-Smitha metalem zaangażowanym jest cynk.
Wstęp
Cyklopropany mogą powstawać w reakcji karbenoidów metali (powstających w reakcji związku diazowego z metalem przejściowym) i olefiny. Chociaż wewnątrzcząsteczkowy wariant tej reakcji jest znany od 1961 r., Nowsze są chemo- i stereoselektywne międzycząsteczkowe reakcje cyklopropanowania katalizowane metalem, wykorzystujące związki diazokarbonylowe. Kompleksy karboksylanu rodu, takie jak tetraoctan dirodu, są najczęściej używane do katalizowania tej przemiany. Opracowano enancjoselektywne cyklopropanacje, które zwykle wykorzystują wstępnie utworzone chiralne kompleksy karboksylanu rodu pochodzące z chiralnych ligandów karboksylanowych.
(1)
Mechanizm i stereochemia
Przeważający mechanizm
Brakuje ostatecznych badań mechanistycznych cyklopropanacji katalizowanej rodem. Jednak mechanizm został zracjonalizowany w oparciu o dystrybucję produktu i stereoselektywność. Atak związku diazowego na centrum metalu generuje obojnaczy kompleks alkilowy metalu, który usuwa gazowy azot, dając metaliczny karbenowy związek pośredni. Skoordynowane dodanie karbenu metalu do olefiny (bez bezpośredniej koordynacji olefiny z metalem) generuje obserwowany produkt cyklopropanu. Konfiguracja olefiny jest zachowywana przez cały proces; jednakże karbeny metali z heterotopowymi powierzchniami mogą generować mieszaninę diastereoizomerów, jak pokazano po prawej stronie równania. (2).
(2)
Konfigurację produktu określa trajektoria zbliżania się olefiny do karbenu metalu. W reakcjach monopodstawionych karbenów metali z końcowymi olefinami olefina prawdopodobnie zbliża się do końca (z podwójnym wiązaniem węgiel-węgiel olefiny prawie równoległym do podwójnego wiązania metal-węgiel karbenu) z grupą olefinową R skierowaną dalej od podstawnika karbenu. Zaproponowano drugi model stanu przejściowego dla reakcji karbenów podstawionych winylem. W tym modelu olefina zbliża się „obok” (z podwójnym wiązaniem węgiel-węgiel olefiny prostopadłym do podwójnego wiązania metal-węgiel karbenu) z grupą R olefiny daleko od grupy winylowej.
Warianty stereoselektywne
Sposoby stereoselektywnej syntezy cyklopropanów ze związków diazokarbonylowych i olefin opierają się albo na zastosowaniu wstępnie utworzonych chiralnych katalizatorów rodowych, albo na chiralnych substancjach pomocniczych na związku diazokarbonylowym. Na przykład Rh2 [ S - DOSP] 4 jest wysoce skutecznym katalizatorem enancjoselektywnej cyklopropanacji alkenów.
(3)
Chiralne środki pomocnicze pochodzące z łatwo dostępnych chiralnych alkoholi (takich jak pantolakton) można stosować do diastereoselektywnych cyklopropanacji z diazoestrami.
(4)
Zakres i ograniczenia
Cyklopropanowanie olefin związkami diazokarbonylowymi jest najczęściej przeprowadzane przy użyciu kompleksów karboksylanu rodu, chociaż pierwotnie stosowano miedź. Zakres olefin jest ogólnie dość szeroki - bogate w elektrony, obojętne i ubogie w elektrony olefiny zostały wydajnie cyklopropanowane przy użyciu układów katalizatorów na bazie rodu. W tej sekcji opisano różne klasy związków diazokarbonylowych, które reagują z olefinami w warunkach katalizy rodowej, dając cyklopropany.
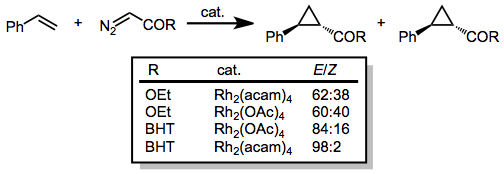
Diazooctany, które mają pojedynczy podstawnik karbonylowy przyłączony do węgla diazowego, były używane do cyklopropanowania szerokiej gamy olefin. Diastereoselektywność dla ( E ) cyklopropanu wzrasta wraz ze wzrostem wielkości grupy estrowej. Dodatkowo dodanie gęstości elektronowej do katalizatora (np. poprzez zastąpienie ligandów octanowych acetamidem, acam) zwiększa diastereoselektywność reakcji.
(5)
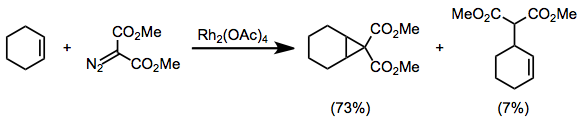
Związki diazokarbonylowe podstawione dwiema grupami odciągającymi elektrony, takie jak diazomaloniany, są podatne na reakcje uboczne w warunkach cyklopropanacji. [3+2] Zaobserwowano produkty uboczne cykloaddycji i insercji CH.
(6)
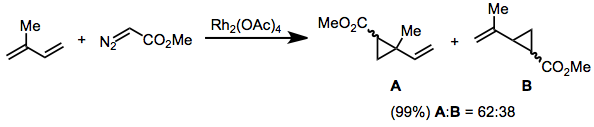
Diazooctany podstawione grupą winylową lub arylową na węglu diazo są niereaktywne w stosunku do trans -alkenów. Wynik ten został wyjaśniony przez wywołanie modelu stanu przejściowego w równaniu. (2). Reakcje tych substratów są wysoce selektywne dla izomeru ( E ) cyklopropanu.
(7)
Diazooctany winylu reagują z dienami, dając cyklopropany diwinylu, które ulegają przegrupowaniu Cope'a, dając cykloheptadieny. Bardziej podstawione podwójne wiązanie dienu reaguje preferencyjnie.
(8)
(9)
Furany reagują podobnie z diazooctanami winylu, chociaż pośredni cyklopropan może przekształcić się albo w produkt przegrupowania Cope'a, albo w otwarty nienasycony związek karbonylowy. Dystrybucja tych produktów jest silnie uzależniona od wzorca substytucji furanu.
(10)
Pirole reagują z diazooctanami winylu, tworząc cykloheptadieny z mostkami azotowymi. Zastosowanie mleczanu metylu jako chiralnego środka pomocniczego na diazooctanie winylu doprowadziło do umiarkowanej diastereoselektywności w tandemowym cyklopropanowaniu / przegrupowaniu Cope pirolu zabezpieczonego Boc.
(11)
Aplikacje syntetyczne
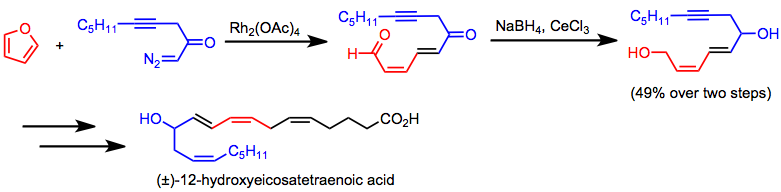
Enancjoselektywną międzycząsteczkową cyklopropanację zastosowano do syntezy chiralnych antybiotyków cyklopropanowych, takich jak cilastatyna. (12) Tandemowa cyklopropanacja/fragmentacja jest kluczowym etapem syntezy kwasu 12-hydroksyeikozatetraenowego.
(12)
Porównanie z innymi metodami
Cyklopropanacja Simmonsa-Smitha, która wykorzystuje karbeny pochodzące z dietylocynku i dijodometanu, jest popularną alternatywą dla cyklopropanacji katalizowanej rodem. W obecności chiralnej diaminy cyklopropanacja Simmonsa-Smitha jest enancjoselektywna; jednakże selektywności nie są tak wysokie, jak odpowiadające im reakcje katalizowane rodem.
(13)
Podstawione karbenoidy cynku można wytworzyć z odpowiednich ketonów lub aldehydów w sekwencji analogicznej do mechanizmu redukcji Clemmensena . Cyklopropanacja olefin tymi związkami pośrednimi zachodzi z umiarkowaną diastereoselektywnością i wydajnością.
(14)
Inne związki diazowe oprócz związków diazokarbonylowych stosowano w katalizowanych rodem cyklopropanacjach; jednak substraty te są znacznie trudniejsze w obróbce i niestabilne niż związki diazokarbonylowe. Dlatego nie zostały one szeroko przyjęte do syntezy organicznej.
(15)
Warunki i procedura doświadczalna
Typowe warunki
Należy zachować szczególną ostrożność podczas obchodzenia się ze związkami diazowymi, które są toksyczne i potencjalnie wybuchowe. Reakcje należy prowadzić pod dobrze wentylowanym dygestorium za osłoną przeciwpodmuchową.
Kompleksy karboksylanu rodu (II) są łatwe do przygotowania i nieskończenie trwałe w powietrzu. Dimeryzacja karbenu jest istotnym problemem w tych reakcjach, ale można ją przezwyciężyć przez powolne dodawanie związku diazowego lub użycie dużego nadmiaru alkenu. Reakcję zwykle prowadzi się w atmosferze obojętnej w warunkach bezwodnych, a najczęściej stosowanym rozpuszczalnikiem jest dichlorometan. Jednak enancjoselektywność asymetrycznych cyklopropanacji może w dużym stopniu zależeć od rozpuszczalnika.
Przykładowa procedura
(16)
Mieszaninę styrenu (44,2 g, 424 mmol) i Rh2 ( S - DOSP) 4 (1,58 g, 0,85 mmol) w pentanie (350 ml) mieszano w temperaturze -78°C w atmosferze argonu. Do tego roztworu dodano ( E )-2-diazo-4-fenylo-3-butenian metylu (17,2 g, 84,8 mmol) w pentanie (0,12 M) w ciągu 30 minut, a następnie mieszaninę reakcyjną mieszano w -78° przez 24 godziny. Mieszaninę następnie zatężono pod próżnią i pozostałość oczyszczono na krzemionce stosując eter/eter naftowy (0:100 do 10:90) jako eluent, otrzymując (1S , 2S ) -metylo-2β-fenylo-1β-[ 2-( Z )-styrylo]cyklopropano-1α-karboksylan (16,05 g, 68%) w postaci białej substancji stałej (temperatura topnienia 57-60°; 98% ee); IR (CHCI3 ) 3110, 3090, 3060, 2980, 2950, 2880, 1735 cm-1; 1H NMR (148) (CDCI3 ) 1,85 (dd, J=7,3, 5,1 Hz, 1H), 2,05 (dd, J=9,1, 5,1 Hz, 1H), 3,04 (dd, J=9,1, 7,3 Hz) , 1H), 3,77 (s, 3H), 6,15 (d, J = 15,9, 1H), 6,37, (d, J = 15,9 Hz, 1H), 7,12-7,28 (m, 10H); 13C NMR (CDCI3 ) 18,5, 33,2, 34,9, 52,3, 124,0, 126,1, 126,7, 127,2, 127,9, 128,3, 129,0, 133,0, 135,4, 137,0, 174,1; [a]25D – 166° (c 1,1, CHCl3 ) ; Analny. Oblicz. dla C 19H 18O 2 : C, 81,99 ; H, 6,52. Znaleziono: C, 81,74; H, 6,53.