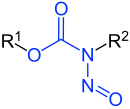
N -Nitrozoamidy
Nitrozoamidy to związki chemiczne zawierające o budowie chemicznej R 1 C(=X)N(–R 2 )–N=O, czyli grupę nitrozową związaną z atomem azotu amidowej lub podobnej grupy funkcyjnej . Konkretne klasy obejmują N -nitrozoamidy, N - nitrozomoczniki , N - nitrozoguanidyny i N - nitrozokarbaminiany . Nitrozoamidy są zwykle reaktywne chemicznie, niestabilne metabolicznie i często rakotwórcze ; jednakże, w przeciwieństwie do N -nitrozoamin , N -nitrozoamidy na ogół nie są zanieczyszczeniami znajdującymi się w żywności .
Używać
Różne chloroetylonitromoczniki (takie jak N,N' -bis(2-chloroetylo)nitromocznik , BCNU) uzyskały zastosowanie medyczne w dziedzinie nowotworów złośliwych . Przypuszcza się, że skuteczność przeciwko komórkom nowotworowym opiera się na alkilowalności centrów cytozyny guaniny w sekwencjach materiału genetycznego, zwłaszcza onkogenów .
Synteza
N -Nitrozoamidy można wytworzyć wychodząc z N -monopodstawionych karboksamidów i kationu nitrozylowego (który powstaje z kationu azotawego w obecności mocnych kwasów z kwasu azotawego ), tutaj zilustrowano dla N -metyloacetamidu ( 1 ). Karboksyamid reaguje atakiem nukleofilowym na kation nitrozylowy. Po wyeliminowaniu protonu z powstałego kationu powstaje N -nitrozoamid ( 2 ):
Toksyczność
Genotoksyczne działanie związków N -nitrozo można przypisać powstawaniu reaktywnych form elektrofilowych w metabolizmie . Spontaniczny rozkład N - nitrozomocznika w środowisku wodnym metabolizmu, tutaj na przykład 1-metylonitromocznika ( 3 ), prowadzi do powstania odpowiednio jonów diazoniowych lub karbenowych. Rozkład następuje do kwasu izocyjanowego i metylodiazowodorotlenek. Przegrupowanie do jonu diazoniowego, a następnie eliminacja azotu prowadzi do jonu karbeniowego ( 4 ), który może alkilować nukleofilowe przecięcia DNA.
W organizmie może zachodzić rozkład N -nitrozomoczników o wyższym stopniu podstawienia. Alternatywnym możliwym tworzeniem jonów diazoniowych i karbenowych jest reakcja enzymatyczna nitrozoamin.
Typowymi objawami towarzyszącymi podczas leczenia raka farmakologicznego za pomocą N -nitrozomoczników są zaburzenia czynności szpiku kostnego (uszkodzenie przedziału komórek macierzystych), tkanki limfatycznej oraz przewodu pokarmowego.
- ^ a b c Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2 , S. 747.
- ^ ab Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2 , S. 752–753.
- ^ Adalbert Wollrab: Organische Chemie. Eine Einführung für Lehramts- und Nebenfachstudenten. 4. Auflage, Springer-Verlag Berlin Heidelberg 2014, ISBN 978-3-642-45144-7 , S. 898.
- Bibliografia Linki zewnętrzne Heinz GO Becker , Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. 24. Auflage, Wiley-VCH Verlag GmbH & Co.KGaA, Weinheim 2015, ISBN 978-3-527-33968-6 , S. 648.
- ^ a b c d e Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2 , S. 753–758.
Linki zewnętrzne
- „nitrozamid” . Wikisłownik . Źródło 2017-08-28 .