Reakcja Fujiwary-Moritaniego
W chemii organicznej reakcja Fujiwary – Moritaniego jest rodzajem reakcji sprzęgania krzyżowego, w której aromatyczne wiązanie CH jest bezpośrednio sprzęgane z olefinowym wiązaniem CH, tworząc nowe wiązanie CC. Ta reakcja jest przeprowadzana w obecności metalu przejściowego, zwykle palladu. Reakcję odkryli Yuzo Fujiwara i Ichiro Moritani w 1967 roku. Do przeprowadzenia tej reakcji katalitycznie potrzebny jest zewnętrzny utleniacz. Zatem tę reakcję można sklasyfikować jako reakcję aktywacji CH , utleniającą reakcję Hecka i olefinację CH. Co zaskakujące, reakcja Fujiwary-Moritaniego została odkryta przed reakcją Hecka .
W tej reakcji eliminuje się potrzebę wstępnej funkcjonalizacji któregokolwiek ze składników, co jest pożądane, ponieważ może skrócić syntezy, zapewnić ekonomiczne drogi atomowe i umożliwić późną funkcjonalizację złożonych cząsteczek. Pomimo potencjału transformacji Fujiwary-Moritaniego, nie jest ona często wykorzystywana przez chemików organicznych ze względu na typowo trudne warunki reakcji, takie jak warunki kwasowe, utleniające i wysoka temperatura, w których większość grup funkcyjnych nie może przetrwać.
Mechanizm
Mechanizm reakcji Fujiwary – Moritaniego nie jest w pełni poznany. Najszerzej akceptowany mechanizm pokazano na rycinie 1. Sekwencja rozpoczyna się od utworzenia kompleksu kationowego palladu-arylu w procesie Friedela-Craftsa lub skoordynowanego procesu metalizacji deprotonowania, który eliminuje kwas octowy w celu wytworzenia związków palladu-arylu. Następnie olefina koordynuje się z palladem i przechodzi insercję migracyjną 1,2 , tworząc wiązanie CC. Następująca eliminacja β-wodorków daje produkt typu styrenu i wodorek palladu. Deprotonowanie tej postaci palladu(II) przez octan (tj. redukcyjna eliminacja pary H-OAc) daje pallad(0), który w obecności utleniacza, np. Cu(II), może zostać ponownie utleniony do palladu(II) ) i ponownie przejść cykl katalityczny.
Przykład przemysłowy
Ube Industries po raz pierwszy odniosło sukces w przemysłowym zastosowaniu reakcji Fujiwary – Moritaniego w 1982 r. W obecności katalitycznej ilości octanu palladu ftalan dimetylu został bezpośrednio przekształcony w związki biarylowe, które następnie odwodniono, otrzymując bezwodnik biftalowy, prekursor polimery poliimidowe. Istnieją dwa różne potencjalne produkty biarylowe, forma symetryczna lub asymetryczna. Osiągnęli selektywną syntezę obu form poprzez kontrolę ligandu.
Najnowsze przykłady
Chociaż pierwotne warunki reakcji Fujiwary-Moritaniego nie są praktyczne, reakcja ta ma istotne znaczenie w tym sensie, że pokazała możliwość innych przekształceń, które zostały później opracowane. Ostatnie postępy w pewnym stopniu ujawniły mechanizm reakcji Fujiwary-Moritaniego, co umożliwiło opracowanie nowych systemów, które umożliwiają podobne przemiany na złożonych substratach.
Jeden z najwcześniejszych przykładów reakcji Fujiwary – Moritaniego w syntezie całkowitej występuje w enancjoselektywnej syntezie całkowitej kwasu klawicypitynowego przez grupę Murakamiego. Użyli stechiometrycznego octanu palladu do sprzęgania 4-bromoindolu i zabezpieczonej dehydroalaniny. Warto zauważyć, że bromek arylu przetrwał warunki reakcji, które umożliwiły zastosowanie ortogonalnych technik olefinowania CH. Rozróżnienie pozycji C3 i C4 było teraz możliwe, podczas gdy konwencjonalne metody sprzęgania krzyżowego z dihalogenowanym indolem miały problemy z regioselektywnością.
Grupa Fagnou wykazała, że możliwe jest bezpośrednie arylowanie CH indolu przy użyciu katalizy palladowej z utleniaczem miedziowym. Chociaż reakcja wymaga wysokiej temperatury, kwaśnego rozpuszczalnika i ilości rozpuszczalnika partnera sprzęgania, ta demonstracja selektywnego i bezpośredniego sprzęgania heteroarylo-arylowego jest godna uwagi.
Grupa Yu opracowała reakcję olefinowania arylu CH, w której kwasy arylokarboksylowe były bezpośrednio sprzęgane z olefinami przez wiązanie arylowe CH. Uwaga: nie jest to reakcja Fujiwary – Moritaniego, ponieważ kieruje nią wolny kwas. Reakcja Fujiwary – Moritaniego charakteryzuje się niekierowaną palladacją C – H zgodną z regioselektywnością reakcji Friedela-Craftsa. Zastosowali również swoją metodologię do całkowitej syntezy kwasu (+)-litospermowego. Warto zauważyć, że wydajność produktu wynosi aż 93% pomimo złożoności obu partnerów sprzęgających. Jest to jeden z najlepszych przykładów, w których olefinowanie CH upraszcza retrosyntezę i demonstruje zbieżną syntezę tego złożonego produktu naturalnego. 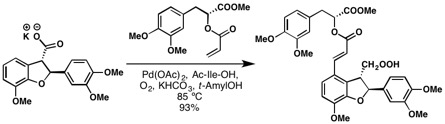
Grupa Lipshutz radykalnie poprawiła warunki reakcji Fujiwary – Moritaniego, opracowując warunki reakcji, które wykorzystują wodę jako rozpuszczalnik i eliminują potrzebę stosowania egzogennego kwasu. Chociaż zakres substratów jest ograniczony do form p-metoksyarylowych, raport Lipshutza sugeruje, że Fujiwra-Moritani może być prowadzony w łagodniejszych warunkach.




