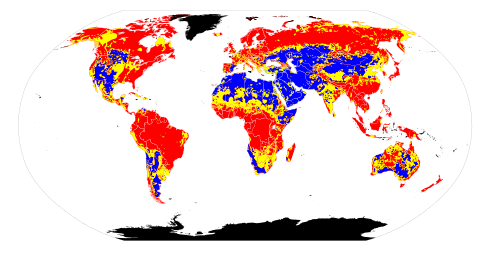
Resztkowy wskaźnik węglanu sodu
Wskaźnik resztkowego węglanu sodu (RSC) wody do nawadniania lub wody glebowej służy do wskazania zagrożenia zasadowością gleby. Indeks RSC służy do określania przydatności wody do nawadniania na glebach gliniastych , które mają wysoką zdolność wymiany kationów . Gdy rozpuszczony sód w porównaniu z rozpuszczonym wapniem i magnezem jest bogaty w wodę, gleba gliniasta pęcznieje lub ulega dyspersji , co drastycznie zmniejsza jej zdolność infiltracji .
W rozproszonej [ wymagane wyjaśnienie ] strukturze gleby korzenie roślin nie są w stanie wniknąć głębiej w glebę z powodu braku wilgoci. Jednak woda o wysokim wskaźniku RSC nie zwiększa ciśnienia osmotycznego , aby utrudnić pobieranie wody przez korzenie roślin, w przeciwieństwie do wody o wysokim zasoleniu . Nawadnianie gleb gliniastych wodą o wysokim wskaźniku RSC prowadzi do powstawania odłogowanych gleb alkalicznych .

Formuła indeksu RSC
RSC wyraża się w jednostkach meq/l . RSC nie powinno być wyższe niż 1, a najlepiej mniejsze niż +0,5 przy uwzględnieniu zużycia wody do nawadniania. Wzór na obliczenie wskaźnika RSC to:
- Indeks RSC = [HCO 3 + CO 3 ] − [Ca + Mg]
- Indeks RSC = HCO 3 /61 + CO 3 /60 – Ca/40 – Mg/24 (w przypadku, gdy stężenia jonów są mierzone w mg/L lub ppm jako sole)
Przy obliczaniu wskaźnika RSC należy wziąć pod uwagę jakość wody w strefie korzeniowej rośliny uprawnej, uwzględniając czynnik wymywania w polu. Na zawartość wapnia w postaci rozpuszczonej ma również wpływ ciśnienie cząstkowe rozpuszczonego CO2 w strefie korzeniowej roślin w wodzie polowej.
Naturalne zanieczyszczenie wody
Soda kalcynowana [Na 2 CO 3 ] może być obecna w naturalnej wodzie w wyniku wietrzenia bazaltu , który jest skałą magmową . Wapno [Ca(OH) 2 ] może być obecne w naturalnej wodzie, gdy woda deszczowa wchodzi w kontakt z kalcynowanymi minerałami, takimi jak popiół powstały ze spalania węgla kamiennego lub brunatnego w kotłach. Antropogeniczne wykorzystanie sody kalcynowanej również ostatecznie zwiększa RSC wody rzecznej.
Tam, gdzie woda rzeczna i gruntowa są wielokrotnie wykorzystywane w ekstensywnie nawadnianych dorzeczach, woda rzeczna dostępna w dolnym biegu jest często nieprzydatna w rolnictwie ze względu na wysoki wskaźnik RSC lub zasadowość. Zasolenie wody nie musi być wysokie.
Zmiękczona woda
W terminologii uzdatniania wody przemysłowej jakość wody o wysokim wskaźniku RSC jest synonimem wody miękkiej , ale pod względem chemicznym bardzo różni się od naturalnie miękkiej wody, która ma bardzo niskie stężenie jonów. Gdy sole wapnia i magnezu występują w wodzie w postaci rozpuszczonej, sole te wytrącają się na powierzchniach wymiany ciepła, tworząc izolującą twardą zgorzelinę/powłokę, która zmniejsza wydajność wymiany ciepła wymienników ciepła. Aby uniknąć osadzania się kamienia w wymiennikach ciepła chłodzonych wodą, woda jest uzdatniana wapnem i/lub sodą kalcynowaną w celu usunięcia twardości wody .
zmiękczania sody wapiennej zachodzą następujące reakcje chemiczne , podczas których wytrącają się sole wapnia i magnezu w postaci węglanu wapnia i wodorotlenku magnezu, które są bardzo słabo rozpuszczalne w wodzie.
- CaSO 4 + Na 2 CO 3 ---> CaCO 3 ↓ + Na 2 SO 4
- CaCl2 + Na2CO3 --- > CaCO3 ↓ + 2NaCl
- MgSO 4 + Ca(OH) 2 + Na 2 CO 3 ---> Mg(OH) 2 ↓ + CaCO 3 ↓ + Na 2 SO 4
- MgCl 2 + Ca(OH) 2 + Na 2 CO 3 ---> Mg(OH) 2 ↓ + CaCO 3 ↓ + 2NaCl
- 2NaHCO 3 + Ca(OH) 2 ---> CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O
- Na2CO3 + Ca(OH) 2 --- > CaCO3 ↓ + 2NaOH
- Ca(HCO 3 ) 2 + Ca(OH) 2 ---> 2CaCO 3 ↓ + 2H 2 O
- Mg(HCO 3 ) 2 + 2Ca(OH) 2 ---> Mg(OH) 2 ↓ + 2CaCO 3 ↓ + 2H 2 O
- MgCO 3 + Ca(OH) 2 ---> Mg(OH) 2 ↓ + CaCO 3 ↓
Nadmiar sody kalcynowanej po wytrąceniu soli wapnia i magnezu znajduje się w węglanach i wodorowęglanach sodu, które nadają wodzie glebowej wysokie pH lub zasadowość .
Jeziora sodowe
Jeziora basenów endoreicznych nazywane są sodowymi lub alkalicznymi, gdy dopływające wody zawierają wysokie stężenia Na 2 CO 3 . pH sodowej jeziora jest na ogół powyżej 9, a czasami zasolenie jest zbliżone do wody słonawej z powodu zubożenia czystej wody w wyniku parowania słonecznego.
Jeziora sodowe są bogate w glony ze względu na zwiększoną dostępność rozpuszczonego CO 2 w wodzie jeziora w porównaniu z jeziorami słodkowodnymi lub słonymi. Węglan sodu i wodorotlenek sodu są w równowadze z dostępnością rozpuszczonego dwutlenku węgla, jak podano poniżej w reakcji chemicznej
- Na2CO3 + H2O <=> 2NaOH + CO2 _
- NaHCO 3 <=> NaOH + CO 2
W ciągu dnia, gdy dostępne jest światło słoneczne, glony przechodzą proces fotosyntezy , który pochłania CO 2 , aby przesunąć reakcję w kierunku tworzenia się NaOH i odwrotnie, w nocy następuje uwalnianie CO 2 z procesu oddychania alg w kierunku Na 2 CO 3 i Tworzenie NaHCO3 . W wodach jeziora sodowego węglany sodu działają jako katalizator wzrostu glonów, zapewniając korzystnie wyższe stężenie rozpuszczonego CO 2 w ciągu dnia. Z powodu fluktuacji rozpuszczonego CO 2 , pH i zasadowość wody również się zmieniają.
.
Zobacz też
- pH gleby
- Wpływ nawadniania na środowisko
- Indeks artykułów związanych z glebą
- Agreti zielone warzywo
- Paliwo z alg
- kultura alg
- Grawitropizm