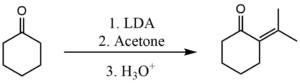Samokondensacja
Samokondensacja to reakcja organiczna , w której związek chemiczny zawierający grupę karbonylową działa zarówno jako elektrofil , jak i nukleofil w kondensacji aldolowej . Nazywa się to również symetryczną kondensacją aldolową , w przeciwieństwie do mieszanej kondensacji aldolowej , w której elektrofil i nukleofil to różne gatunki.
Na przykład dwie cząsteczki acetonu kondensują się do pojedynczego związku tlenku mezytylu w obecności żywicy jonowymiennej :
- 2 CH 3 COCH 3 → (CH 3 ) 2 C=CH(CO)CH 3 + H 2 O
W przypadku zastosowań syntetycznych jest to na ogół niepożądana, ale spontaniczna i preferowana reakcja uboczna kondensacji mieszanego aldolu i potrzebne są specjalne środki ostrożności, aby temu zapobiec.
Zapobieganie samokondensacji
W wielu przypadkach samokondensacja jest niepożądaną reakcją uboczną. Dlatego chemicy przyjęli wiele sposobów zapobiegania temu zjawisku podczas przeprowadzania skrzyżowanej reakcji aldolowej.
Zastosowanie bardziej reaktywnego elektrofila i partnera, którego nie można enolizować
Jeśli acetofenon i benzaldehyd połączy się w obecności wodnego roztworu NaOH , powstanie tylko jeden produkt:
Dzieje się tak, ponieważ benzaldehydowi brakuje jakichkolwiek protonów ulegających enolizowaniu, więc nie może tworzyć enolanu, a benzaldehyd jest znacznie bardziej elektrofilowy niż jakikolwiek nieenolizowany acetofenon w roztworze. Dlatego enolan utworzony z acetofenonu będzie zawsze preferencyjnie atakował benzaldehyd w stosunku do innej cząsteczki acetofenonu.
Ilościowe wytwarzanie jonu enolanowego
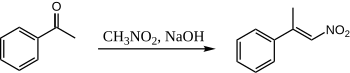
Gdy nitrometan i acetofenon łączy się za pomocą wodnego NaOH, powstaje tylko jeden produkt:
Tutaj acetofenon nigdy nie ma szansy skondensować się ze sobą, ponieważ nitrometan jest o wiele bardziej kwaśny, że nitro „enolan” wytwarza się ilościowo. Nie jest znana żadna opublikowana procedura kondensacji acetofenonu i nitrometanu.
Podobny proces można również zastosować, aby zapobiec samokondensacji między dwoma ketonami. W tym przypadku jednak zastosowana baza musi być mocniejsza. Powszechnie stosowaną zasadą jest diizopropyloamidek litu (LDA). Tutaj stosuje się go w celu przeprowadzenia kondensacji krzyżowej pomiędzy acetonem i cykloheksanonem .
Etap deprotonowania przy użyciu LDA jest tak szybki, że powstały enolan nigdy nie ma szans na reakcję z nieprzereagowanymi cząsteczkami cykloheksanonu. Następnie enolan szybko reaguje z acetonem.
Tworzenie się eteru sililoenolowego
Użycie LDA nie będzie działać przy próbie wytworzenia jonu enolanowego z aldehydów. Są tak reaktywne, że nastąpi samokondensacja. Jednym ze sposobów obejścia tego jest przekształcenie aldehydu w eter sililoenolowy przy użyciu chlorku trimetylosililu i zasady, takiej jak trietyloamina , a następnie przeprowadzenie kondensacji aldolowej. W tym przypadku taktykę tę stosuje się do kondensacji aldehydu octowego i benzaldehydu . Aby ułatwić kondensację, należy zastosować TiCl4 . kwas Lewisa, taki jak
- ^ Kondensacje ketonów przy użyciu żywicy jonowymiennej kwasu sulfonowego N. Lorette; J. Org. Chem. ; 1957; 22 ust. 3; 346-347.
- ^ Clayden, Jonathan. Chemia organiczna. Oxford University Press, Oxford, Nowy Jork, s. 689-720. ISBN 978-0-19-850346-0
- ^ Clayden, Jonathan. Chemia organiczna. Oxford University Press, Oxford, Nowy Jork, s. 689-720. ISBN 978-0-19-850346-0
- ^ Clayden, Jonathan. Chemia organiczna. Oxford University Press, Oxford, Nowy Jork, s. 689-720. ISBN 978-0-19-850346-0