Sortowanie komórek
Sortowanie komórek to proces, w ramach którego określony typ komórek jest oddzielany od innych zawartych w próbce na podstawie jego właściwości fizycznych lub biologicznych, takich jak rozmiar, parametry morfologiczne, żywotność oraz ekspresja białek zarówno zewnątrz-, jak i wewnątrzkomórkowych. Homogenna populacja komórek uzyskana po sortowaniu może być wykorzystywana do różnych zastosowań, w tym do badań, diagnostyki i terapii.
Metody
Metody sortowania komórek dzielą się na dwie główne kategorie: sortowanie komórek aktywowane fluorescencją (FACS) i sortowanie komórek immunomagnetycznych. Jednak ze względu na wieloletnie udoskonalanie i zwiększone zapotrzebowanie na separację komórek, naukowcy pracują nad opracowaniem urządzeń do sortowania mikroprzepływowego, które mają wiele zalet w porównaniu z głównymi typami metod sortowania komórek aktywowanych fluorescencją i sortowania komórek immunomagnetycznych.
Aktywowany fluorescencyjnie
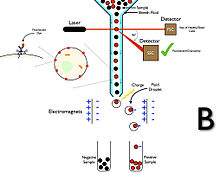
Sortowanie komórek aktywowane fluorescencją jest również znane jako sortowanie komórek cytometrii przepływowej lub powszechnie znane pod akronimem FACS, który jest znakiem towarowym firmy Becton Dickinson and Company . Sortowanie komórek aktywowane fluorescencją wykorzystuje cytometrię przepływową do rozdzielania komórek w oparciu o parametry morfologiczne i ekspresję wielu zewnątrz- i wewnątrzkomórkowych białek. Metoda ta pozwala na wieloparametrowe sortowanie komórek i polega na zamykaniu komórek w małe kropelki cieczy, którym selektywnie nadawane są ładunki elektryczne i sortowane przez zewnętrzne pole elektryczne. Sortowanie komórek aktywowane fluorescencją ma kilka systemów, które współpracują ze sobą, aby osiągnąć pomyślne sortowanie interesujących zdarzeń. Należą do nich systemy fluidalne, optyczne i elektrostatyczne. Układ płynowy musi precyzyjnie odrywać się od strumienia cieczy w małych jednorodnych kropelkach, tak aby kropelki zawierające poszczególne komórki mogły być następnie odchylane elektrostatycznie. stabilizowany drganiami przetwornika ultradźwiękowego na wylocie otworu dyszy. Zakłócenia narastają wykładniczo i prowadzą do rozpadu strumienia na kropelki w precyzyjnym czasie. Interesująca komórka, która powinna zostać posortowana, jest mierzona w strefie wykrywania i przesuwa się w dół strumienia do punktu przerwania. Podczas oddzielania kropelki zawierającej komórkę od nienaruszonego strumienia cieczy, do strumienia cieczy podawany jest impuls napięcia, tak że kropelki zawierające komórki będące przedmiotem zainteresowania mogą być odchylane w polu elektrycznym między dwiema płytami odchylającymi w celu sortowania. Kropelki są następnie wychwytywane przez rurki zbiorcze lub naczynia umieszczone pod płytkami odchylającymi. Sortowanie komórek metodą cytometrii przepływowej zapewnia bardzo wysoką specyficzność w odniesieniu do jednego lub kilku markerów powierzchniowych, ale jednym ograniczeniem jest liczba komórek, które można przetworzyć w ciągu dnia roboczego. Z tego powodu często rozważa się wstępne wzbogacenie populacji będącej przedmiotem zainteresowania przez sortowanie komórek immunomagnetycznych, zwłaszcza gdy komórki docelowe są stosunkowo rzadkie i trzeba przetworzyć dużą partię komórek. Ponadto sortery komórek do cytometrii przepływowej są złożonymi instrumentami, które są zazwyczaj używane tylko przez dobrze wyszkolony personel w urządzeniach do cytometrii przepływowej lub w dobrze wyposażonych laboratoriach, a ponieważ są one zwykle duże, nie zawsze jest możliwe umieszczenie ich w bezpiecznym miejscu biologicznym szafka . Dlatego nie zawsze jest możliwe zapewnienie sterylności próbek, a ponieważ układy płynowe można czyścić, ale nie jest to jednorazowe, istnieje możliwość zanieczyszczenia krzyżowego między próbkami. Innym aspektem, który należy wziąć pod uwagę, jest to, że tworzenie się kropel wewnątrz urządzenia może prowadzić do tworzenia się aerozolu, który jest niebezpieczny dla operatora podczas używania zakaźnych próbek. Te ostatnie rozważania mają szczególne znaczenie, gdy sortowanie komórek jest stosowane w zastosowaniach klinicznych, na przykład w terapii komórkowej, i dlatego powinno być przeprowadzane zgodnie z Dobrej Praktyki Wytwarzania (GMP). Naukowcy mogą wykorzystywać różnorodne barwniki fluorescencyjne do projektowania wielokolorowych paneli w celu osiągnięcia skutecznego, jednoczesnego sortowania wielu, precyzyjnie określonych typów komórek. Diagram A przedstawia sortowanie komórek aktywowane fluorescencją w przypadku negatywnej selekcji komórek (grupa niepożądana), a diagram B przedstawia FACS pozytywnej selekcji komórek (grupa pożądana).
Barwniki fluorescencyjne w sortowaniu komórek
Barwniki fluorescencyjne mogą działać bardzo różnie. Ogólnie rzecz biorąc, barwnik fluorescencyjny będzie wzbudzany przez źródło światła (laser) o określonej długości fali i emituje światło o niższej energii i dłuższej długości fali. Najczęstsze barwniki działają poprzez wiązanie się z antygenami prezentowanymi na komórkach. Typowymi docelowymi antygenami są klastry różnicowania (CD). Są one specyficzne dla określonego typu komórek. Jeśli możesz zidentyfikować, który CD jest prezentowany na twoich komórkach będących przedmiotem zainteresowania, możesz zabarwić swoją próbkę specyficznym dla niej barwnikiem fluorescencyjnym i użyć sortowania komórek aktywowanego fluorescencją, aby oddzielić populację będącą przedmiotem zainteresowania. Istnieje jednak wiele innych mechanizmów działania barwników fluorescencyjnych.
Niektóre barwniki są zdolne do dyfuzji przez błony. Korzystając z tej właściwości barwnika, użytkownicy mogą scharakteryzować aktywność wewnątrzkomórkową, jak również ekspresję powierzchniową białek. Na przykład w martwych komórkach jodek propidyny (PI) może przenikać do jądra, gdzie wiąże się z DNA. Sygnał fluorescencyjny PI można wykorzystać do ilościowego określenia zawartości DNA do analizy cyklu komórkowego lub do identyfikacji martwych komórek w próbce.
Niektóre barwniki fluorescencyjne można wykorzystać do scharakteryzowania kinetycznej aktywności wewnątrzkomórkowej zamiast utrwalania komórek w formaldehydzie i utraty żywotnych komórek. W poniższej tabeli przedstawiono barwniki, których można użyć do pomiaru kilku parametrów cytotoksyczności spowodowanej stresem oksydacyjnym.
| Barwnik | Parametr | Mechanizm akcji | Wzbudzenie/emisja |
| DCFH-DA | Reaktywne formy tlenu (ROZ) |
Deacetylowany do 2'7' dichlorofluorescyna, która reaguje z ROS w rodnikowych warunkach do 2'7 dichlorofluoresceiny (DCF) |
488 nm/525 nm |
| Rh123 | Potencjał błonowy mitochondriów (MMP) |
Sekwestrowany przez aktywne mitochondria | 488 nm/525 nm |
| Indo-1 rano | Poziomy wapnia | Emituje na dwóch różnych długościach fal w zależności od obecności jonów wapnia | 350 nm/[400 nm/485 nm] |
| Liczba Pi | Żywy/Martwy | Przenika tylko martwe komórki i wiąże się z DNA | 488 nm/675 nm |
Ta konfiguracja eksperymentalna to tylko jeden przykład możliwości cytometrii przepływowej. W systemach FACS te scharakteryzowane komórki można następnie sortować i oczyszczać do dalszych eksperymentów.
Sortowanie komórek immunomagnetycznych
MACS
Sortowanie komórek immunomagnetycznych jest również znane jako separacja komórek immunomagnetycznych, wzbogacanie komórek immunomagnetycznych lub sortowanie komórek aktywowane magnetycznie i jest powszechnie znane pod akronimem MACS, który jest znakiem towarowym firmy Miltenyi GmbH . Immunomagnetyczne sortowanie komórek opiera się na rozdzielaniu kulek przechodzących przez pole magnetyczne. Różne firmy oferują różne rozwiązania w zakresie wzbogacania lub wyczerpywania populacji komórek. Immunomagnetyczne sortowanie komórek zapewnia metodę wzbogacania heterogennej mieszaniny komórek w oparciu o ekspresję białek na powierzchni komórki (antygenów). Technologia ta opiera się na przyłączaniu małych, obojętnych cząstek supramagnetycznych do mAb swoistych dla antygenów w docelowej populacji komórek. Komórki znakowane tymi koniugatami przeciwciało-kulki są następnie rozdzielane na kolumnie zawierającej matrycę ferromagnetyczną. Przyłożenie pola magnetycznego do matrycy powoduje, że kulki przyklejają się do matrycy wewnątrz kolumny, a komórki przenoszące kulki są powstrzymywane przed przejściem. Komórki nieznakowane mogą przechodzić przez matrycę i są zbierane w przepływie. Aby wymyć uwięzione komórki z kolumny, wystarczy usunąć pole magnetyczne. Immunomagnetyczne sortowanie komórek umożliwia zatem różne strategie pozytywnego wzbogacenia lub zubożenia komórek. Perełki immunomagnetyczne są małe i zwykle nie zakłócają dalszych testów, jednak w przypadku niektórych zastosowań może być konieczne ich usunięcie. Dzięki tej metodzie separacji zwiększenie liczby komórek nie wydłuża znacząco czasu przetwarzania, a sterylność próbki jest gwarantowana, jeśli sortowanie komórek odbywa się w komorze bezpieczeństwa biologicznego. Z drugiej strony technika ta pozwala na rozdzielenie komórek na podstawie tylko jednego markera i nie jest w stanie rozróżnić różnych poziomów ekspresji białka (analiza ilościowa). Sortowanie komórek immunomagnetycznych okazało się korzystne w szczególności w przypadku hodowli NPC (neuralnych komórek progenitorowych), ponieważ jest łatwiejsze w zarządzaniu i powoduje minimalne uszkodzenia żywych komórek.
Hodowle NPC są szczególnie trudne do pracy, ponieważ żywe komórki mózgowe są wrażliwe i mają tendencję do wzajemnego zanieczyszczania. Aby uzyskać wyraźniejsze wyniki, laboratoria potrzebują czystszych materiałów, co oznacza bardziej czyste linie NPC. Badanie przeprowadzone w 2019 roku (przy wsparciu finansowym New York Stem Cell Foundation i Association for Frontotemporal Degeneration) wykazało, że immunomagnetyczne sortowanie komórek jest tanim, prostym sposobem na uzyskanie takiej czystości przy minimalnym uszkodzeniu linii komórkowych, a tym samym utrzymanie lepszej jakości komórek, zbierając bardziej jednorodne NPC i zwiększając ich szanse na znalezienie skutecznych metod leczenia zaburzeń neurologicznych. Wykorzystali zarówno metody immunomagnetyczne, jak i aktywowane fluorescencyjnie, aby odfiltrować CD271 - (markery przydatne dla mezenchymalnych komórek macierzystych ) i CD133 + (markery dla macierzystych komórek rakowych), aby porównać żywotność każdej metody.
Immunomagnetyczne sortowanie komórek zostało również wykorzystane do wspomagania rozrodu (sztuczna inseminacja) i leczenia przeszczepów siatkówki. W przypadku rozrodu wspomaganego plemniki apoptotyczne (komórki martwe lub uszkodzone) są oddzielane, dzięki czemu można zebrać więcej nieapoptotycznych (niefragmentowanych) plemników i wykorzystać je do zwiększenia szans na płodność osobnika. Wykazano, że ten rodzaj leczenia jest bardziej skuteczny, gdy jest wykonywany wielokrotnie, zwiększając ilość komórek nieapoptotycznych obecnych podczas inseminacji.
Badanie przeprowadzone w 2018 roku we Francji (przy wsparciu wielu osób i agencji, w tym: Institut de la Vision w Paryżu i Retina France Association) wykorzystało szczury i metodę sortowania komórek immunomagnetycznych, aby wykazać, że fotoreceptory (komórki w siatkówce, które reagują na światło) można przeszczepić w celu wyleczenia ślepoty. W tym procesie mikrokulki zostały przyłączone do CD73 , aby pomóc w oddzieleniu PR (fotoreceptorów) od organoidów siatkówki. Ekspresja antygenu CD73+ w komórkach RCVRN+ (białkach wiążących wapń w oku) wykazała naukowcom, że ta kombinacja CD73+ i RCVRN+ może być wykorzystana do naprawy z postmitotycznymi prekursorami PR. Chociaż badania nie mogły zweryfikować sukcesu u ludzi, mają podstawy do dalszych badań opartych na sukcesie parowania nieuszkodzonych fotoreceptorów z antygenem CD73 i transplantacji u szczurów. Ten sukces w rozdzielaniu i parowaniu komórek poprzez przeszczepy daje nadzieję na potencjalne wyleczenie chorób siatkówki, w tym całkowitej ślepoty. Jak dotąd zgłoszono tylko częściową naprawę wzroku.
Urządzenia mikroprzepływowe
Ze względu na różne ograniczenia urządzeń do sortowania komórek aktywowanych fluorescencyjnie i immunomagnetycznych, pojawiła się szeroka gama mikroprzepływowych urządzeń do sortowania komórek. Kilka z nich jest już dostępnych na rynku lub jest w fazie komercyjnego rozwoju. Badania nad projektami sorterów mikroprzepływowych komórek często wykorzystują miękkiej litografii wykorzystujące materiały takie jak polidimetylosiloksan (PDMS).
Kluczową zaletą sorterów mikroprzepływowych jest możliwość przeprowadzania sortowania komórek aktywowanego fluorescencją w zamkniętym sterylnym wkładzie jednorazowego użytku. Taki zamknięty wkład zapobiegałby narażeniu operatora na zagrożenia biologiczne w postaci kropelek emitowanych przez systemy FACS. Inne korzyści obejmują zmniejszony wpływ na żywotność komórek dzięki zmniejszonemu naprężeniu hydrodynamicznemu w komórkach; Niektóre opublikowane urządzenia wykazują potencjał do sortowania wielokierunkowego, obniżonego kosztu wkładu dzięki tanim metodom produkcji, mniejszemu zużyciu energii i mniejszym rozmiarom, przy czym niektóre urządzenia są wielkości karty kredytowej. Niektóre osiągnęły wysoką wydajność i szybkość do około 50 000 komórek/s.
Sortowniki mikroprzepływowe komórek można podzielić na dwie kategorie: aktywne i pasywne. Aktywne urządzenia odchylają poszczególne komórki dzięki pomiarom cytometrycznym komórek, dokonywanym w czasie rzeczywistym. Urządzenia pasywne wykorzystują fizyczne różnice między komórkami w sposobie interakcji z przepływem płynu lub powierzchniami.
Aktywny
Aktywne mikroprzepływowe sortery komórek polegają na odchylaniu poszczególnych komórek po ich pomiarze za pomocą metod cytometrycznych, w tym znakowania fluorescencyjnego, rozpraszania światła i analizy obrazu. Poszczególne komórki są odchylane przez siłę działającą bezpośrednio na komórkę lub siłę działającą na płyn otaczający komórki, tak że wpływają do oddzielnych naczyń wyjściowych.
Metody odchylania komórek wykorzystują kilka rodzajów siłowników makroskopowych, optycznych lub MEMS (systemy mikroelektromechaniczne) do odchylania objętości cząstek lub cieczy w mikrokanale. Godne uwagi niedawne przykłady opierają się na powierzchniowych fal akustycznych , siłownikach makroskopowych (takich jak siłowniki piezoelektryczne) sprzężonych z mikrokanałami, dielektroforezie kropelek, siłownikach pęcherzyków pary termicznej, przejściowych mikrowirach generowanych przez siłowniki pęcherzyków pary termicznej, manipulacjach optycznych i mikromechanicznych zawory. Najszybsze z nich wykazały szybkość sortowania przekraczającą 1000/s, a potencjalną maksymalną przepustowość w niektórych przypadkach zbliżoną do FACS. Aktywne sortowanie komórek mikroprzepływowych wymaga podobnego oprzyrządowania cytometrycznego, jak opisane powyżej sortowanie komórek aktywowane fluorescencją.
Aktywne sortowniki komórek mikroprzepływowych mają potencjał skalowania przepustowości poprzez równoległość na chipie. Najszybsze opublikowane aktywne urządzenie do sortowania mikroprzepływowego wykazało przepustowość 160 000 / s
Bierny
Pasywne sortowanie komórek wykorzystuje zachowanie płynu w mikrokanałach do zmiany i oddzielania komórek na podstawie wielkości i morfologii. Płyn w roztworze koloidalnym podlega profilowi prędkości w wyniku interakcji płynu ze ściankami kanału; komórki w roztworze podlegają różnym siłom oporu i bezwładności, które są zależne od rozmiaru komórki i odpowiednio równoważą się w różnych miejscach wzdłuż profilu prędkości. W zakrzywionych kanałach mikroprzepływowych wiry powstają pod wpływem siły Deana, która lokalizuje cząstki o różnych rozmiarach w różnych miejscach przekroju poprzecznego ze względu na liczbę Reynoldsa i promień krzywizny.
Na przykład w prostym kanale większe komórki w roztworze koloidalnym znajdują się bliżej środka mikrokanału niż mniejsze komórki ze względu na większe siły oporu ze ściany, które odpychają komórkę od ściany, oraz siłę gradientu ścinania z prędkości profil, który równoważy tę siłę oporu ściany, aby ustawić komórkę w równowadze.
Inne metody rozdzielania komórek oparte na przeciwciałach
Zanim sortowanie komórek oparte na fluorescencji i immunomagnetyczne zyskało popularność, zastosowano kilka metod rozdzielania i wzbogacania komórek przy użyciu przeciwciał. Obejmowały one separację komórek za pośrednictwem przeciwciał i dopełniacza, polistyrenowe urządzenia do badania powinowactwa immunologicznego oraz system CellPro CEPRATE® SC, który wykorzystywał unieruchomione przeciwciała w porowatej kolumnie. Ten ostatni był pierwszym zatwierdzonym przez FDA urządzeniem medycznym do separacji hematopoetycznych komórek macierzystych .
Nowszą techniką separacji komórek wykorzystującą przeciwciała jest sortowanie komórek aktywowane wyporem (BACS) to technika separacji, w której mikropęcherzyki wiążą się z komórkami poprzez przeciwciała wiążące się z powierzchnią komórek. Docelowe komórki są następnie usuwane z próbki biologicznej poprzez flotację.
Sortowanie pojedynczych komórek
Sortowanie pojedynczych komórek zapewnia metodę sortowania heterogenicznej mieszaniny komórek w oparciu o właściwości wewnątrzkomórkowe i zewnątrzkomórkowe. Metody jednokomórkowe umożliwiają zrozumienie właściwości komórkowych, które mogą być niejasne lub nieoczywiste. Istnieje kilka metod sortowania pojedynczych komórek:
Macierz mikrotratw zapewnia szybką, opłacalną metodę izolowania komórek, analizowania komórek w czasie i generowania populacji klonów z unikalną możliwością monitorowania wszystkich właściwości wewnątrz- i zewnątrzkomórkowych. Ten system jest idealny zarówno dla komórek adherentnych, jak i nieadherentnych.
Zbadano metodę pojedynczej komórki do obserwacji odpowiedzi na bodziec zewnętrzny (w tym przypadku odpowiedź komórkową na ligand) przy użyciu urządzenia mikroprzepływowego z zaworami mikrokanałowymi do uwięzienia pojedynczej komórki w komorze. Do aktywacji zastosowano system 23-zastawkowy, aw obrazowaniu bodziec-reakcja zastosowano barwnik fluorescencyjny.
Metody grupowania pojedynczych komórek to seria metod statystycznych zaprojektowanych przez analityków danych w oparciu o właściwości wewnątrzkomórkowe. Proces obejmuje gromadzenie danych o sekwencji RNA pojedynczej komórki; wstępne przetwarzanie danych do tworzenia klastrów; grupowanie; i oceny klastrowania. Naukowcy stosują metody uczenia maszynowego (głównie analizę skupień) na danych RNA-Seq pojedynczej komórki, aby podzielić komórki na różne kategorie. Wszystkie metody są modyfikowane, aby rozwiązać problemy w danych RNA-Seq, takie jak porzucenie genów o niskiej ekspresji i niejednoznaczne markery komórkowe w obecności błędów technicznych. Najnowocześniejsze metody obejmują SC3., CIDR., Seurat, a bardziej szczegółowe informacje można znaleźć na stronie Wiki: Single Cell RNA-Seq Clustering.
Linki zewnętrzne
|
Zasoby biblioteczne dotyczące sortowania komórek |