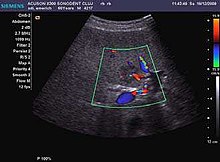
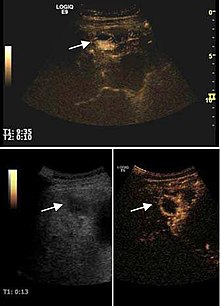
Ultrasonografia guzów wątroby
| Ultrasonografia guzów wątroby | |
|---|---|
| Zamiar | wykrywanie i charakteryzacja guzów wątroby |
Ultrasonografia guzów wątroby obejmuje dwa etapy: wykrywanie i charakteryzację.
Wykrywanie guza opiera się na działaniu metody i powinno obejmować informacje morfometryczne (wymiary w trzech osiach, objętość) oraz informacje topograficzne (liczba, położenie określające segment wątroby i płat/płaty). Specyfikacja tych danych jest ważna dla oceny stopnia zaawansowania guzów wątroby i rokowania.
Charakterystyka guza jest złożonym procesem opartym na sumie kryteriów prowadzących do określenia charakteru guza. Często inne procedury diagnostyczne, zwłaszcza interwencyjne, nie są już potrzebne. Charakterystyka guza ultrasonograficzną będzie oparta na następujących elementach: konsystencja (stały, płynny, mieszany), echogeniczność , wygląd struktury (homogeniczny lub niejednorodny), odgraniczenie od sąsiedniego miąższu wątroby (torebkowe, nieprecyzyjne), elastyczność, efekt wzmocnienia akustycznego tylnego , związek z sąsiednimi narządami lub strukturami (przemieszczenie, inwazja), unaczynienie (obecność i cechy na Ultrasonografia dopplerowska i ultrasonografia ze wzmocnieniem kontrastowym (CEUS). [ potrzebne źródło ]
Dodaje się również podłoże, na którym rozwija się stan nowotworu (jeśli wątroba jest prawidłowa lub jeśli istnieją dowody na rozlaną chorobę wątroby) oraz kontekst rozwoju (onkologia, sepsa). Szczególną uwagę należy zwrócić na analizę łożyska krążeniowego. Badanie mikrokrążenia pozwala na rozróżnienie guzów łagodnych i złośliwych. Charakterystycznymi elementami krążenia złośliwego są gęstość naczyń, obecność naczyń o nieregularnych drogach i rozmiarach, niektóre z nich wzajemnie się komunikują, inne są zablokowane na końcu z wyglądem „palca rękawiczkowego”, obecność przecieków tętniczo-tętniczych i tętniczo-żylnych, brak lub niewydolność zwieracza przedwłośniczkowego tętnic zbudowanego z mięśni gładkich. [ potrzebne źródło ] Rozpoznanie i charakterystyka guzów wątroby wymaga odrębnego podejścia do każdej grupy schorzeń, przy użyciu dostępnych procedur omówionych powyżej dla każdego z nich. Korelacja z wywiadem lekarskim, stanem klinicznym i funkcjonalnym (biochemicznym i hematologicznym) pacjenta to ważne elementy, które również należy wziąć pod uwagę. [ potrzebne źródło ]
Łagodne nowotwory wątroby
Łagodne guzy wątroby na ogół rozwijają się na prawidłowej lub stłuszczonej wątrobie, są pojedyncze lub mnogie (zazwyczaj grudkowate), mają wyraźne granice, ze zwiększoną echogenicznością (naczyniaki, łagodny ogniskowy rozrost guzkowy) lub nieobecne, z efektem wzmocnienia akustycznego tylnego (torbiele), mają wyraźne granice (torbiel bąblowcowa), brak unaczynienia lub wykazują charakterystyczny układ krążenia, wypierają prawidłowe struktury wątroby, a nawet sąsiednie narządy (w przypadku dużych rozmiarów), są dość elastyczne i nie naciekają naczyń wątroby. Stan ogólny pacjentki jest dobry, gdyż guzy często przebiegają bezobjawowo, wykrywane przypadkowo.
Torbiele wątroby
Mogą być pojedyncze lub mnogie, o różnej wielkości, na ogół poniżej 20 mm (wrodzone). Rzadko rozmiary mogą sięgać kilku centymetrów, co prowadzi do zastąpienia całego płata wątroby (nabytego, pasożytniczego). Mogą być związane z torbielami nerek; w tym przypadku choroba ma dziedziczną, autosomalną dominującą transmisję (choroba von Hippel Lindau). [ potrzebne źródło ]
Obraz USG jest dobrze odgraniczoną zmianą o bardzo cienkich, prawie niewidocznych ścianach, bez sygnału krążenia w badaniu dopplerowskim lub CEUS. Treść jest transsoniczna, co sugeruje skład płynu. Obecność błon, obfitych osadów lub cyst w środku sugeruje pasożytniczą, bąblowcową naturę. W tylnej części zmiany widoczne jest zjawisko wzmocnienia akustycznego, co wzmacnia podejrzenie płynnej masy. Zwykle wypierają normalne naczynia wątroby, ale nie dochodzi do inwazji naczyń ani dróg żółciowych. [ potrzebne źródło ]
Torbiel wątroby [ potrzebne źródło ]
Torbiel wątroby bąblowcowa. Kryteria diagnostyczne to obecność błon i osadu w środku. [ potrzebne źródło ]
naczyniak krwionośny


Jest najczęstszym nowotworem wątroby z częstością 0,4 – 7,4%. Na ogół przebiega bezobjawowo, ale może również wiązać się z dolegliwościami bólowymi lub cytopenią i/lub niedokrwistością, gdy jest bardzo masywny. Jest unikalny lub paucilocular. Może to być związane z innymi typami łagodnych guzów wątroby. Charakterystyczny obraz USG 2D to bardzo dobrze odgraniczona zmiana o wielkości 2–3 cm lub mniejszej, wykazująca podwyższoną echogeniczność, a w przypadku umiejscowienia w kontakcie z przeponą można zaobserwować zjawisko „lustrzanego odbicia”. Podczas dotykania wątroby głowicą naczyniak krwionośny jest ściśliwy, wysyłając pogłos do tyłu. Eksploracja dopplerowska nie ujawnia sygnału krążenia z powodu bardzo małej prędkości przepływu. Badanie CEUS ma rzeczywistą wartość diagnostyczną ze względu na typowe zachowanie progresywnego wzmacniania CA guza od obwodu w kierunku centrum. Wzmocnienie jest powolne, trwa kilka minut, w zależności od wielkości naczyniaka krwionośnego i obecności (lub braku) zakrzepicy wewnętrznej. W fazie późnej (sinusoidalnej), jeśli jest całkowicie „wypełniony” CA, naczyniak krwionośny wydaje się izoechogeniczny dla wątroby. Odchylenia od wyżej opisanego zachowania mogą wystąpić w naczyniakach tętniczych lub zawierających przecieki tętniczo-żylne. W takich przypadkach różnicowanie z guzem złośliwym jest trudne i wymaga innych procedur obrazowania, obserwacji i pomiarów guza w krótkich odstępach czasu.
Ogniskowy rozrost guzkowy

Jest to guz rozwinięty wtórnie do nieprawidłowości krążenia z licznymi naczyniami tętniczymi, mający charakterystyczne położenie w centrum guza, w obrębie włóknistej blizny. Z tego poziomu rozwija się promienista sieć naczyń o orientacji obwodowej. Łożysko krążeniowe guza bogate jest w elementy mikrokrążenia i żyły wrotnej. Częstość występowania jest większa u młodszych kobiet, a przyjmowanie doustnych środków antykoncepcyjnych przyspiesza rozwój guza. Obraz ultrasonograficzny 2D to dość dobrze zdefiniowana masa, o różnych rozmiarach, zwykle pojedyncza, stała konsystencja o niejednorodnej strukturze. Rzadko można wyróżnić centralną bliznę. Badanie spektralne Dopplera wykrywa centralne naczynia tętnicze, a badanie CFM ujawnia ich promieniowe położenie. W badaniu CEUS stwierdza się centralne wypełnienie loży krążenia guzem centralnym w fazie tętniczej i całkowite wzmocnienie w fazie żyły wrotnej. Podczas tej fazy centrum zmiany staje się hipoechogeniczne, wzmacniając bliznę po guzie. W fazie późnej guz pozostaje izoechogeniczny w stosunku do wątroby, co wzmacnia rozpoznanie zmiany łagodnej. [ potrzebne źródło ]
gruczolak
Jest to łagodny nowotwór zbudowany z prawidłowych lub atypowych hepatocytów. Częstość występowania wynosi 0,03%. Jej rozwój jest indukowany przyjmowaniem hormonów anabolicznych i doustnych środków antykoncepcyjnych. Guz jest bezobjawowy, ale w przypadku krwawienia wewnętrznego może mu towarzyszyć ból w prawym górnym kwadrancie. Ultrasonografia 2D pokazuje dobrze zdefiniowaną, niekapsułkowaną, stałą masę. W przypadku krwotoku do guza może mieć niejednorodną budowę. Badanie dopplerowskie nie wykazuje sygnału krążenia. Eksploracja CEUS jest dość niejednoznaczna i nie zawsze może postawić diagnozę różnicową z rakiem wątrobowokomórkowym. Tak więc podczas fazy tętniczej występuje wzmocnienie dośrodkowe i niejednorodne. Podczas fazy żyły wrotnej następuje umiarkowane wypłukiwanie. W fazie późnej wygląd jest izoechogeniczny lub hipoechogeniczny z powodu braku komórek Kupffera. [ potrzebne źródło ]
Nowotwory złośliwe wątroby
Nowotwory złośliwe wątroby rozwijają się na marskości wątroby (rak wątrobowokomórkowy, HCC) lub prawidłowej wątrobie (przerzuty). Są pojedyncze lub mnogie (zwłaszcza przerzuty), mają zmienną, na ogół nieprecyzyjną definicję, mogą mieć bardzo wyraźny sygnał krążeniowy (rak wątrobowokomórkowy i niektóre typy przerzutów), mają niejednorodną budowę (wynik wewnątrzguzowych zaburzeń krążenia, następstwo krwotoku lub martwica) i są twarde w dotyku, a nawet sztywne. Stan ogólny chorego koreluje z chorobą podstawową (dekompensacja naczyniowa i miąższowa w przebiegu marskości wątroby, utrata masy ciała, brak łaknienia i niedokrwistość z nowotworami). [ potrzebny cytat ]
Rak wątrobowokomórkowy (HCC)
Jest to najczęstszy nowotwór złośliwy wątroby. Rozwija się wtórnie do marskości wątroby, dlatego badanie ultrasonograficzne co 6 miesięcy w połączeniu z oznaczeniem alfa-fetoproteiny (AFP) jest skuteczną metodą wczesnego wykrywania i monitorowania leczenia tego typu guza. Klinicznie HCC pokrywa się z zaawansowaną marskością wątroby (długa ewolucja, powtarzająca się dekompensacja naczyń i miąższu, czasami krwawienie z powodu wycieku z żylaków) oprócz przyspieszonej utraty masy ciała w niedawnej przeszłości i braku apetytu. [ potrzebne źródło ]

Wygląd HCC w badaniu ultrasonograficznym 2D przypomina guz lity, o nieprecyzyjnych rysach, o niejednorodnej budowie, jedno- lub wielokomorowy (postać mózgowa). Opisano również typ „naciekowy”, który jest trudny do odróżnienia od rekonstrukcji guzkowej wątroby w marskości wątroby. Zazwyczaj HCC atakuje naczynia wątrobowe, głównie żyły wrotne, ale także żyły wątrobowe. Badanie dopplerowskie wykrywa dużą prędkość przepływu tętniczego i niski wskaźnik impedancji (skorelowany z opisanymi zmianami w angiogenezie guza). Rozmieszczenie przestrzenne naczyń jest nieregularne, nieuporządkowane. W badaniu CEUS widoczne jest hiperwzmocnienie zmiany w fazie tętniczej. Podczas fazy żyły wrotnej dochodzi do swoistego „wypłukania” ultrasonograficznego środka kontrastowego (UCA), aw późnej fazie guz wydaje się hipoechogeniczny. Słabo zróżnicowane guzy mogą mieć silniejsze wypłukiwanie prowadzące do izoechogenicznego wyglądu miąższu wątroby podczas fazy żyły wrotnej. Wygląd ten stwierdzono w ok. 30% przypadków. Opisane zmiany mają wartość diagnostyczną w przypadku guzków wątroby większych niż 2 cm. [ potrzebne źródło ]
Ultradźwięki są przydatne w wykrywaniu HCC, stabilizacji i ocenie skuteczności terapeutycznej. W zakresie stopnia zaawansowania związanego ze skutecznością terapii stosuje się klasyfikację barcelońską, która wyróżnia pięć stadiów HCC. Terapia lecznicza jest wskazana we wczesnych stadiach, które obejmują bardzo wczesne stadium (pojedynczy guzek <2 cm), uleczalne przez resekcję chirurgiczną (przeżycie 50-70% pięć lat po resekcji chirurgicznej) i wczesne stadium (pojedynczy guzek o średnicy 2–5 cm lub do 3 guzków <3 cm), które można leczyć za pomocą ablacji prądem o częstotliwości radiowej (RFA) i przeszczepu wątroby. W stadium pośrednim (poliguzkowy, bez naciekania wrotnego) i zaawansowanym (N1, M1, z naciekiem wrotnym) stosuje się leczenie paliatywne (TACE i leczenie systemowe sorafenibem), aw stadium końcowym stosuje się jedynie leczenie objawowe. [ potrzebne źródło ]
rak dróg żółciowych
Rozwija się na wątrobie bez marskości. Obraz USG 2D jest nietypowy – lita masa o niejednorodnej budowie, słabo odgraniczona, często o peryferyjnym położeniu i słabym sygnale krążenia dopplerowskiego. Badanie CEUS ujawnia umiarkowane wzmocnienie obwodu guza w fazie tętniczej, po którym następuje wypłukanie w fazie żyły wrotnej i hipoechogeniczny wygląd w fazie późnej. [ potrzebne źródło ]
Przerzuty do wątroby
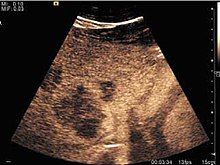

Badanie USG jest wymagane w celu wykrycia przerzutów do wątroby u pacjentów z wywiadem onkologicznym. Ponadto metoda może przypadkowo wykryć przerzuty u pacjentów bezobjawowych. Wczesna identyfikacja (małe rozmiary, niewielka liczba) jest ważna dla ustalenia optymalnego przebiegu leczenia, które może być złożone (chemioterapia, ablacja prądem o częstotliwości radiowej, resekcja chirurgiczna), ale mile widziane. Ponadto ważne jest również rozróżnienie zmian synchronicznych, które mają inny charakter, wiedząc, że do 25–50% zmian w wątrobie mniejszych niż 2 cm wykrytych u pacjentów z rakiem może być łagodnych. Czułość USG w wykrywaniu przerzutów różni się w zależności od doświadczenia lekarza i używanego sprzętu i waha się w granicach 40–80%. Czułość jest uwarunkowana wielkością i impedancją akustyczną guzków. Dla średnicy zmiany poniżej 10 mm dokładność USG jest znacznie zmniejszona, sięgając ok. 20%. Innymi elementami wpływającymi na niższą wydajność USG są: nadmierna otyłość, stłuszczenie wątroby, hipomobilność przepony oraz pewne wzorce hiperechogenicznych lub izoechogenicznych przerzutów, które można przeoczyć lub imitować stany łagodne. Konwencjonalny obraz USG przerzutów jest nietypowy i składa się z ograniczonych zmian, z wyraźnym, nieprecyzyjnym lub „halo” zarysem, z jednorodnym lub niejednorodnym wzorem echa. Mogą być pojedyncze (często przerzuty nowotworu jelita grubego do wątroby) lub mnogie. Echogeniczność jest zmienna. Zwiększone mogą uciskać drogi żółciowe (które mogą być rozszerzone) i naczynia wątrobowe. Zajęcie wątroby może być segmentowe, płatowe lub uogólnione. W tej sytuacji dochodzi do wyraźnej hepatomegalii. Ogólnie przerzuty mają nietypowy wzór naczyniowy dopplerowski, z nielicznymi wyjątkami (przerzuty rakowiaków). Przerzuty gruczolakoraka torbielowatego z powodu zawartości półpłynnej mogą mieć wygląd transoniczny. Zwiększając się, mogą powodować centralną martwicę. Badanie CEUS to prawdziwy przełom w wykrywaniu i charakterystyce przerzutów do wątroby. [ potrzebne źródło ]
Zwiększona wydajność opiera się na identyfikacji specyficznych wzorców naczyniowych podczas fazy tętniczej i obserwowaniu przerzutów w przeciwieństwie do normalnego miąższu wątroby podczas fazy sinusoidalnej. Zwiększona dokładność CEUS wynika z odmiennego zachowania miąższu prawidłowej wątroby (przechwytuje CA w komórkach Kuppfera) w stosunku do miąższu guza (nie zawiera komórek Kuppfera, dlatego CEUS wygląda hipoechogenicznie). Do tego dochodzi specyfika krążenia wewnątrz guza reprezentowana przez zmniejszone łożysko tętnicze w porównaniu z otaczającą normalną wątrobą oraz brak naczyń wrotnych. Jeśli chodzi o unaczynienie, przerzuty mogą być niedonaczyniowe (w gruczolakoraku żołądka, okrężnicy, trzustki lub jajnika) z hipoechogenicznym wzorem w fazie tętniczej i podobne w fazie żyły wrotnej i późnej, odpowiednio hiperunaczynione (guzy neuroendokrynne, czerniak złośliwy, mięsaki, nerki, sutka lub guzy tarczycy) z hiperechogenicznym wyglądem podczas fazy tętniczej, z wymywaniem podczas fazy żyły wrotnej i hipoechogenicznym wzorem 30 sekund po wstrzyknięciu. [ potrzebne źródło ]
Wykorzystując badanie CEUS do wykrywania przerzutów uzyskuje się czułość 80–95%, podobną do CT i MRI z kontrastem. Śródoperacyjne zastosowanie procedury zwiększa jej skuteczność, nawet jeśli nie ma decydującego wpływu na zmianę postępowania terapeutycznego. Ograniczenia metody wiążą się z penetracją USG (wyraźne stłuszczenie wątroby, głęboka zmiana, nadmierna otyłość) oraz doświadczeniem lekarza. Do tego dochodzi ryzyko pomylenia przerzutów hipernaczyniowych, raka wątrobowokomórkowego i naczyniaka krwionośnego oraz pomylenia przerzutów niedonaczyniowych z małymi torbielami wątroby. Rutynowe wykonywanie badania CEUS w celu wykrycia przerzutów do wątroby jest zalecane, gdy konwencjonalne badanie USG nie jest rozstrzygające, gdy konieczne jest precyzyjne określenie niektórych urazów (liczba, lokalizacja) w połączeniu z TK/MRI z kontrastem oraz w celu oceny skuteczności leczenia przy zastosowaniu środka antyangiogennego leczenie przerzutów hipernaczyniowych. Metoda nie może zastąpić badań CT/MRI, które mają ugruntowane wskazania w onkologii.
Guzy rzekome i guzy zapalne wątroby
Poza wymienionymi jednostkami mogą wystąpić nacieki zapalne lub nawet pseudomasy. Ich rozpoznanie jest dość trudne, a stosowane kryteria różnicowania często niewystarczające, co wymaga diagnostyki morfologicznej, zastosowania innych metod diagnostyki obrazowej lub okresowej ponownej oceny pacjenta. Obejmuje to zmiany powstałe w wyniku odbudowy miąższu wątroby, jak to ma miejsce w przypadku marskości wątroby, nagromadzenia stłuszczenia lub w przypadku ostrych lub przewlekłych chorób zapalnych. [ potrzebne źródło ]
Ogniskowe stłuszczenie
Polega na miejscowym gromadzeniu się bogatych w tłuszcz komórek wątroby. W niektórych przypadkach ta akumulacja może naśladować guza wątroby. Czasami można zaobserwować zjawisko odwrotne, czyli „wyspę” prawidłowego miąższu w „świecącej” wątrobie. W obu przypadkach badanie ultrasonograficzne identyfikuje dobrze odgraniczony, niezamknięty obszar o echostrukturze i unaczynieniu zbliżonym do prawidłowego miąższu wątroby. Zmiana może przybierać różne formy, najczęściej owalna i zlokalizowana w IV segmencie przed wnęką wątroby. Występuje u pacjentów z dyslipidemią lub spożywających alkohol w prawidłowym stanie fizycznym i biologicznym. Potwierdzenie łagodnego rozpoznania uzyskuje się za pomocą badania CEUS, które we wszystkich trzech fazach badania stwierdza prawidłowe łożysko krążenia, podobne do sąsiedniego miąższu wątroby. [ potrzebne źródło ]
Ropień wątroby

Ropień wątroby ma heteromorficzny obraz ultrasonograficzny, przy czym najbardziej typowym jest guz o nieregularnych kształtach, z frędzlami, z zawartością płynną lub półpłynną, z powietrzem w środku lub bez. Badanie dopplerowskie wykazuje brak naczyń w obrębie zmiany. Eksploracja CEUS wykazuje hiperenhancement podczas fazy tętniczej blisko zmiany, co sugeruje przekrwienie miąższu wątroby. W fazie żylnej i sinusoidalnej obraz jest hipoechogeniczny, a płyn centralny wzmocniony kontrastem. Badanie CEUS jest przydatne, ponieważ potwierdza kliniczne podejrzenie ropnia. Ponadto pozwala na dokładny pomiar wielkości zbioru oraz wskazanie jego topografii wewnątrz wątroby (płat, segment). [ potrzebne źródło ]
Stan przednowotworowy. Monitorowanie marskości wątroby
Wątroba z marskością charakteryzuje się występowaniem guzków o różnej wielkości i stopniu ewolucji, dzięki czemu w pewnym momencie progresji choroby mogą współistnieć guzki regeneracyjne, guzki dysplastyczne, a nawet wczesny rak wątrobowokomórkowy. Istnieją badania wykazujące, że od 59 do 94% nowo rozpoznanych guzków wątroby u pacjentów z marskością wątroby ma charakter złośliwy, a do 50% zmian hiperechogenicznych, z ultrasonograficznym obrazem naczyniaka, ostatecznie okazuje się być rakiem wątrobowokomórkowym. Dlatego obecna praktyka wielu ośrodków uważa, że każda nowa zmiana ujawniona u pacjenta z marskością wątroby powinna być traktowana jako złośliwa, dopóki nie zostanie udowodnione inaczej. Istnieją trzy kategorie guzków marskości wątroby: regeneracyjne, dysplastyczne (uważane za stany przednowotworowe) i nowotworowe (HCC). [ potrzebne źródło ]
Guzki regeneracyjne (RN)

Zmiany te są dobrze odgraniczone, o izoechogenicznym lub hipoechogenicznym wyglądzie i rozmiarach mniejszych niż 1 cm. Jest ich dużo i mają mniej więcej równomierne rozmieszczenie, obejmujące wszystkie segmenty wątroby. Mogą się gromadzić, powodując duże pseudoguzy. W badaniu dopplerowskim te guzki nie mają sygnału krążeniowego. Eksploracja CEUS jest wskazana, gdy guzek różni się od ogólnego wzorca zrestrukturyzowanej wątroby inną echogenicznością lub inną wielkością niż większość guzków. Podczas fazy tętniczej sygnał jest słaby lub nieobecny. Podczas fazy żyły wrotnej i fazy późnej obraz jest trwale izoechogeniczny. [ potrzebne źródło ]
Generalnie RN nie różni się od otaczającego miąższu. Badanie CEUS jest przydatne do wykluczenia aktywnej zmiany w momencie eksploracji, ale nie ma bezwzględnej wartości prognostycznej; dlatego pacjent powinien być okresowo badany w krótkich odstępach czasu. Wymagana jest korelacja ze stanem klinicznym i pomiarami AFP. [ potrzebne źródło ]
Guzki dysplastyczne (DN)

Zmiany te mają różne wzory (hipo lub hiperechogeniczne) o średnicy co najmniej 1 cm. Są to hepatocyty ze zmianami dysplastycznymi, ale bez wyraźnych histologicznych kryteriów złośliwości. Dzieli się je na guzki dysplastyczne o niskim stopniu złośliwości, gdzie atypia komórkowa jest łagodna, oraz guzki dysplastyczne o wysokim stopniu złośliwości z umiarkowaną lub ciężką atypią komórkową, ale bez ustalonych cech złośliwości. Czasami dobrze zróżnicowane ogniska HCC można zidentyfikować w guzkach dysplastycznych wysokiego stopnia (wygląd określany jako „guzek w guzku”). Większość autorów akceptuje proces kancerogenezy jako postępującą transformację DN z niskiego do wysokiego stopnia i do HCC. Unaczynienie guzka zmienia się progresywnie, skorelowane ze stopniem złośliwości, i charakteryzuje się spadkiem aż do braku wejścia żyły wrotnej i wzrostem tętniczego wejścia do guza. Naczynia neoformacyjne występują wraz ze wzrostem stopnia dysplazji. Neowaskularyzacja tętnic nasila się w sposób chaotyczny i wybuchowy, podczas gdy unaczynienie normalne, tętnicze i wrotne nadal się zmniejsza. Guzki dysplastyczne wysokiego stopnia są unaczynione zarówno w fazie tętniczej, jak i wrotnej, podczas gdy wczesne guzki HCC mogą mieć podobny układ tętniczy z otaczającym miąższem lub zaostrzone i hipowaskularyzację wrotną. W średnio- lub niskozróżnicowanym HCC (klasyczny HCC) odżywianie guza odbywa się tylko przez naczynia neoformacyjne (obfite), przy czym prawidłowe unaczynienie tętnicze i wrotne całkowicie zanika. Takie zachowanie unaczynienia guza jest typowe dla HCC i jest kluczem do diagnostyki obrazowej. [ potrzebne źródło ]
Ultrasonografia w trybie B nie jest w stanie odróżnić guzków regeneracyjnych od zmian granicznych, takich jak guzki dysplastyczne, a nawet wczesny HCC. Badanie dopplerowskie ma również niską czułość w różnicowaniu guzków dysplastycznych od wczesnego HCC. Sygnał dopplerowski może być nieobecny zarówno w guzkach regeneracyjnych, jak i dysplastycznych. Niektórzy autorzy wskazują na obecność żylnego przepływu typu Dopplera, który odzwierciedla odżywienie żyły wrotnej guzka jako cechę charakterystyczną guzków dysplastycznych i wczesnego HCC (Minami i Kudo, 2010). Inni autorzy zauważyli obecność przepływu tętniczego z niewielkimi wahaniami częstotliwości i prawidłowym wskaźnikiem rezystywności. W badaniu CEUS zarówno RN, jak i DN mogą mieć dość zmienny wzór wzmocnienia. Ogólnie rzecz biorąc, oba guzki wzmacniają się identycznie z otaczającym miąższem wątroby po wstrzyknięciu UCA. Guzki dysplastyczne są hipounaczynione w fazie tętniczej. W przypadku guzka dysplastycznego wysokiego stopnia czasami można wykryć hiperunaczynienie, ale bez skojarzenia „wymywania” podczas fazy wrotnej i późnej CEUS. W takich przypadkach biopsja może wyjaśnić diagnozę. [ potrzebne źródło ]
Wczesny rak wątrobowokomórkowy (wczesny HCC)
Sugestywnym pojawieniem się wczesnego HCC w badaniu ultrasonograficznym 2D jest hipoechogeniczny guzek o wyraźnym wzorze, rozwinięty na marskości wątroby. Hipoechogeniczny wygląd jest charakterystyczny dla średnio/słabo zróżnicowanego HCC, z niewielkimi lub nieobecnymi zmianami tłuszczowymi. W rzadkich przypadkach HCC może wydawać się izoechogeniczny, składać się z typu guza o wyższym stopniu zróżnicowania, a zatem o wolniejszym rozwoju. Innym powszechnym aspektem jest pojawienie się „jasnej pętli” lub „guzka w guzku”, hipoechogenicznych guzków w hiperechogenicznym guzie. [ potrzebne źródło ]
Charakterystyka spektralna Dopplera wczesnego HCC pokrywa się z charakterystyką guzka dysplastycznego, ponieważ są one reprezentowane przez obecność typu sygnału żyły wrotnej lub typu tętniczego z prawidłowym RI (dobrze zróżnicowany HCC) lub zwiększonym RI (średnio lub słabo zróżnicowany HCC). Eksploracja CFM identyfikuje chaotyczny wzór naczyń. [ potrzebne źródło ]
W badaniu CEUS wczesny HCC ma wygląd izo- lub hipernaczyniowy podczas fazy tętniczej, po którym następuje wypłukanie podczas fazy żyły wrotnej i fazy późnej. Istnieją badania wskazujące, że proces wypłukiwania jest bezpośrednio skorelowany z wielkością i cechami nowotworowego łożyska krążenia. Tak więc wysoce zróżnicowany HCC ilustruje zjawisko późnego lub nawet bardzo późnego „wymywania”, podczas gdy słabo zróżnicowany HCC ma przyspieszone wypłukiwanie pod koniec fazy tętniczej. W celu właściwej charakterystyki guzków wątroby konieczna jest zatem analiza wszystkich tych trzech faz badania CEUS. Wypłukanie guza pod koniec fazy tętniczej umożliwia rozpoznanie HCC z przewidywalnością 89,5%. Niektórzy autorzy uważają, że wczesne wyraźne wzmocnienie kontrastowe guzka o średnicy 1–2 cm, powstałego na marskiej wątrobie, jest wystarczające do rozpoznania HCC. Wyniki te dowodzą, że dla prawidłowej charakterystyki zmian konieczne jest wydłużenie czasu badania do 5 minut lub nawet dłużej. [ potrzebne źródło ]
Wartość ultrasonograficzna w „przesiewowym” HCC
Wyjściowe USG 2D odgrywa ważną rolę w programach nadzoru nad pacjentami zagrożonymi rozwojem HCC. Badanie ma akceptowalną czułość, która wzrasta wraz z wielkością guza. Czułość waha się od 42% dla zmian <1 cm do 95% dla guzów większych niż 1 cm, a swoistość może sięgać 90%. Optymalny przedział czasowy dla przesiewowego badania ultrasonograficznego populacji „zagrożonej” wynosi 6 miesięcy, co wynika z badań klinicznych, w których badano czas podwojenia wielkości guza (Bruix, 2005; Maruyama i in., 2008). W przypadku nowo powstałego guzka zostaną wzięte pod uwagę kryteria wymiarowe. I tak, w przypadku guzka o średnicy mniejszej niż 10 mm pacjent będzie poddawany ponownej ocenie ultrasonograficznej co 3 miesiące, gdyż tendencja wzrostowa jest wskazaniem do uzupełnienia badań innymi procedurami diagnostycznymi; przy wielkości 10 – 20 mm konieczne są dwa zgodne badania obrazowe, uzupełnione w razie potrzeby biopsją pod kontrolą USG; przy wielkości powyżej 20 mm do pozytywnej diagnostyki wystarczy jedna technika obrazowania dynamicznego o charakterystycznym wyglądzie. W niepewnych przypadkach należy wykonać uzupełniające dynamiczne techniki obrazowania lub biopsję. Gdy badanie dopplerowskie nie wystarczy, zostanie wykonane badanie CEUS. Należy zawsze pamiętać o ryzyku uzyskania wyników fałszywie dodatnich w kierunku HCC w przypadku raka dróg żółciowych, dlatego należy rozważyć uzupełniające procedury diagnostyczne. [ potrzebne źródło ]
O skuteczności programów przesiewowych świadczy wzrost wykrywalności HCC <2 cm (z <5% w latach 90. w Europie do >30% obecnie w Japonii) przy możliwościach leczenia. Głównym problemem przesiewowych badań ultrasonograficznych jest to, że aby były one opłacalne, powinny być stosowane w populacji ogólnej, a nie w szpitalach trzeciego stopnia. Rodzi to znaczenie zależnej od operatora i sprzętu części badania ultrasonograficznego. Skuteczność takiego programu jest związana z czynnościowym miąższem wątroby pacjenta z marskością wątroby. Dlatego niektórzy autorzy twierdzą, że badania przesiewowe należy wykluczyć u pacjentów z etiologią uniemożliwiającą leczenie lub u pacjentów z zaawansowaną chorobą wątroby (klasa C wg Childa-Pugha). [ potrzebne źródło ]
Po leczeniu leczniczym (resekcja chirurgiczna, miejscowe terapie ablacyjne) zaleca się kontynuację przesiewowych badań ultrasonograficznych najpierw po 1 miesiącu, a następnie co 3 miesiące po zakończeniu terapii w celu oceny skuteczności terapii i wykrycia innych guzków. [ potrzebne źródło ]
Terapie przeciwnowotworowe
Eksploracja ultrasonograficzna może być skuteczną metodą oceny odpowiedzi guzów wątroby na leczenie. Na przestrzeni lat rozważano różne kryteria oceny skuteczności terapii leczniczych lub paliatywnych. Obecnie udowodniono, że stopień martwicy guza nie jest skorelowany z jego średnicą, dlatego prosty pomiar średnicy guza (kryterium RECIST) nie wystarcza do oceny terapii. [ potrzebne źródło ]
Obecnie lokalna odpowiedź na leczenie koncentruje się na martwicy guza rozpoznanej za pomocą dynamicznych technik obrazowania z kontrastem i rozpoznanej na podstawie obecności niewzmocnionych obszarów wewnątrz guza. Miejscową odpowiedź na leczenie definiuje się jako: [ potrzebne źródło ] A. całkowita odpowiedź, zdefiniowana jako całkowite zniknięcie wszystkich znanych zmian chorobowych (brak obszarów wzmocnionych nowotworem, co odzwierciedla całkowitą martwicę nowotworu) i brak innych nowych zmian chorobowych określonych na podstawie dwóch obserwacji w odstępie nie krótszym niż 4 tygodnie; B. częściowa odpowiedź, zdefiniowana jako ponad 50% redukcja całkowitego wzmocnienia guza we wszystkich mierzalnych zmianach, określona na podstawie dwóch obserwacji w odstępie nie krótszym niż 4 tygodnie c. stabilna choroba (nie jest opisana przez a, b lub d) d. choroba postępująca, zdefiniowana jako 25% wzrost wielkości jednej lub więcej mierzalnych zmian lub pojawienie się nowych zmian.
Techniki oceny skuteczności terapii
Skuteczność ultrasonografii 2D jest niska w ocenie skutków leczenia HCC lub leczenia przerzutów, ponieważ nie jest w stanie odróżnić żywotnej tkanki guza od martwicy guza po terapii. [ potrzebne źródło ]
Jest jednak w stanie wykryć pojawienie się nowych zmian i ocenić występowanie ewentualnych powikłań progresji choroby (wodobrzusze czy zakrzepica żyły wrotnej). Ultrasonografia z kolorowym Dopplerem może być czasami przydatna, ponieważ jest w stanie wykazać obecność wewnątrzguzowego układu naczyniowego jako oznakę niepełnej terapii lub wznowy wewnątrz guza. Brak sygnału dopplerowskiego nie wyklucza obecności żywej tkanki nowotworowej. Eksploracja CEUS, dzięki swojej zdolności do poprawy mikrokrążenia w obrębie zmiany chorobowej, okazała się użyteczna w monitorowaniu skuteczności terapeutycznej. Jego wskazania są określone dla leczenia ablacyjnego HCC (przed, w trakcie i po terapii), podczas gdy monitorowanie terapii ogólnoustrojowych HCC i przerzutów nie jest obecnie zatwierdzonymi wskazaniami, ale ma udowodnioną skuteczność w szeroko zakrojonych badaniach klinicznych (Claudon i in., 2008 ). Badanie CEUS nie może całkowicie zastąpić innych obecnie stosowanych metod diagnostyki obrazowej ze względu na znane ograniczenia metody ultrasonograficznej (zależne od operatora/sprzętu, ograniczenia badania ultrasonograficznego). Oprócz wzdęć, u chorych na raka dochodzi do stłuszczenia po terapii, które uniemożliwia głęboką widoczność. Spiralna tomografia komputerowa pozostaje metodą z wyboru w monitorowaniu terapii przeciwnowotworowych, ponieważ zapewnia przegląd rozległości guza i nie jest ograniczona przez wzdęcia lub stłuszczenie. [ potrzebne źródło ]
Badanie MRI gadolinu jest procedurą stosowaną coraz częściej, a jej zaletami są brak napromieniania oraz wysoka czułość w wykrywaniu unaczynienia guza, zwłaszcza w przypadku guzów mniejszych. Pozostaje jednak procedurą kosztowną i mało dostępną, choć charakteryzuje się dużą swoistością. Obecnie CEUS i MRI są uważane za metody uzupełniające tomografię komputerową. [ potrzebne źródło ]
Terapie ablacyjne z monitoringiem ultrasonograficznym (alkoholizacja – PEI, ablacja prądem o częstotliwości radiowej – RFA)
Terapie ablacyjne są uważane za leczenie lecznicze HCC wraz z resekcją chirurgiczną i przeszczepem wątroby i są wskazane we wczesnych stadiach nowotworu u pacjentów z dobrą czynnością wątroby. Z powodzeniem stosowane są również w leczeniu przerzutów do wątroby, gdzie resekcja chirurgiczna jest przeciwwskazana. Są chemiczne (wstrzyknięcie etanolu do guza) lub termiczne (ablacja radiowa, laserowa lub mikrofalowa). Stosuje się je w celu uzyskania pełnej odpowiedzi terapeutycznej, bez wpływu na czynność wątroby. Całkowitą odpowiedź lokalnie potwierdza całkowita martwica guza z marginesem bezpieczeństwa wokół guza. [ potrzebne źródło ]
Ultrasonografia 2D, ultrasonografia dopplerowska, a zwłaszcza CEUS mogą odgrywać ważną rolę w przedterapeutycznej ocenie stopnia zaawansowania choroby, zwłaszcza gdy przekrojowe badania obrazowe (CT, MRI) dają niepewne wyniki lub są przeciwwskazane. Podczas zabiegu interwencyjnego ultradźwięki umożliwiają wprowadzenie igły do guza. CEUS pozwala na prowadzenie w obszarach żywej tkanki i unika obszarów martwiczych wewnątrz guza. CEUS umożliwia również ocenę efektu terapeutycznego bezpośrednio po zabiegu (z możliwością ponownej interwencji w przypadku częściowej odpowiedzi). Aby dokładnie ocenić skuteczność leczenia, konieczne jest porównanie średnicy guza przed rozpoczęciem terapii z obszarem ablacji. Objętość uszkodzonej tkanki musi być większa niż początkowa objętość guza. Wygląd CEUS jest taki, jak centralny obszar niewzmocniony, wykazujący obwodową jednorodną, hiperwzmocnioną obwódkę z powodu stanu zapalnego po zabiegu. Po 24 godzinach od zabiegu obwodowa obwódka zapalna ulega ścieńczeniu, a obszar martwicy wydaje się większy niż w poprzednim badaniu. W związku z tym ewentualny resztkowy guz może wydawać się bardziej widoczny. Guz resztkowy ma słabo zaznaczone krawędzie, nieregularny kształt, a średnica guza pozostaje niezmieniona. Resztkowa tkanka guza jest widoczna na obrzeżach guza jako ekscentryczny obszar zachowujący się jak pierwotny guz w badaniu CEUS, z hiperwzmocnieniem tętnicy i wrotem oraz późnym wypłukaniem. Badanie ultrasonograficzne 24 godziny po zabiegu, w tym CEUS, może wykazać poza charakterem zmiany ewentualne powikłania pozabiegowe (np. aktywne krwawienie). [ potrzebne źródło ]
W pierwszych dniach po RFA zarówno CEUS, jak i spiralna tomografia komputerowa mają niską czułość w ocenie skuteczności terapeutycznej. Uważa się, że czułość CT 24 godziny po terapii jest nawet niższa niż w przypadku CEUS. Trudności w badaniu CEUS wynikają z przekrwienia pozaogniskowego, obecności powietrza wewnątrz guza, ograniczeń ultrasonograficznych (zbyt głęboka zmiana lub obecność stłuszczenia wątroby) lub braku współpracy pacjenta (bezpośrednio po zakończeniu leczenia). Z tego powodu kontrolę kontrastową (CT lub CEUS) należy wykonać miesiąc po ablacji w celu potwierdzenia wyniku terapii. [ potrzebne źródło ]
Wznowę miejscową definiuje się jako nawrót hiperwzmocnionego obszaru na obwodzie guza w fazie tętniczej, z portalem i późnym wypłukaniem. Czasami, szczególnie w przypadku HCC leczonego metodą alkoholizacji (PEI), wewnątrz zmiany mogą być widoczne hiperwzmocnione przegrody lub naczynia. [ potrzebne źródło ]
W przypadku skutecznego leczenia co 3 miesiące wykonuje się monitorowanie USG za pomocą CEUS. Chociaż CE-CT i/lub MRI są uważane za metodę z wyboru w monitorowaniu po leczeniu, CEUS może być stosowany w protokołach obserwacji, a jego dokładność diagnostyczna jest równoważna z CE-CT lub MRI. [ potrzebne źródło ]
Monitorowanie ultrasonograficzne terapii TACE (chemoembolizacja przeztętnicza)
Przeztętnicza chemoembolizacja (TACE) jest częścią paliatywnej terapii HCC stosowanej w pośrednich stadiach choroby. Polega na selektywnym cewnikowaniu angiograficznym tętnicy wątrobowej i wstrzyknięciu środków chemioterapeutycznych (najczęściej adriamycyny, ale inne molekuły są obecnie przedmiotem badań klinicznych), a następnie embolizacji tętnicy wątrobowej pianką żelową, alkoholem lub metalowymi pierścieniami. Podobnym zabiegiem jest embolizacja przeztętnicza, ale bez iniekcji chemioterapeutyków, stosowana w leczeniu hiperunaczynionych przerzutów do wątroby. Terapie te opierają się głównie na tętniczym układzie naczyniowym HCC i hipernaczyniowych przerzutach, podczas gdy pozostały miąższ wątroby ma podwójne ujęcie naczyniowe, głównie wrotne. Ich skuteczność jest wysoka tylko w przypadku zmian hiperwzmocnionych w fazie tętniczej. Rola USG jest ograniczona w pierwszych dniach po zabiegu i dotyczy jedynie jego powikłań, ze względu na zaleganie lipiodolu głównie wewnątrz guza, ale także rozsiane wewnątrzwątrobowo. W USG Lipiodol wydaje się silnie hiperechogeniczny wewnątrz guza, ze znacznym tłumieniem tylnym, co utrudnia badanie USG. Z drugiej strony CE-CT jest również ograniczona obecnością Lipiodolu (oleju jodowego), dlatego ocena skuteczności terapeutycznej jest obecnie dokonywana poprzez pośrednią ocenę wiązania lipiodolu z guzem za pomocą niewzmocnionej CT. Obecność Lipiodolu nie wpływa na CE-MRI, ale jest to metoda kosztowna i wciąż trudno dostępna. W kilku badaniach wykazano podobną, a nawet wyższą skuteczność CEUS w porównaniu z CE-CT i CE-MRI w ocenie wyników leczenia po TACE, podczas gdy inne badania wykazały ograniczenia CEUS, zwłaszcza w przypadku głębokich lub małych zmian. Biorąc pod uwagę ograniczenia CEUS, obecnie niektórzy autorzy uważają tomografię komputerową za standardową metodę oceny TACE i miejscowych terapii ablacyjnych, a CEUS i CE-MRI za metody uzupełniające. Monitorowanie wyników terapii TACE technikami obrazowania kontrastowego przeprowadza się jak w przypadku terapii ablacyjnych początkowo po miesiącu, a następnie co 3 miesiące po TACE. [ potrzebne źródło ]
Biorąc pod uwagę, że TACE jest wskazana tylko w przypadku hiperwzmocnionych zmian w fazie tętniczej, CEUS odgrywa bardzo ważną rolę w monitorowaniu guzków dysplastycznych w celu określenia momentu wystąpienia zmian w układzie naczyniowym tętnic, umożliwiając wczesną interwencję terapeutyczną w celu ograniczenia progresji nowotworu, w celu zwiększenia przeżywalności pacjentów, a tym samym stworzenia pomostu do przeszczepu wątroby. [ potrzebne źródło ]
Monitorowanie ultrasonograficzne terapii systemowych
Terapie systemowe to procedury oparte na powinowactwie pewnych cząsteczek do hamowania replikacji komórek nowotworowych lub namnażania naczyń nowotworowych (terapie antyangiogenne). [ potrzebne źródło ]
Są podawane dożylnie i są wskazane w zaawansowanych stadiach chorób nowotworowych wątroby, gdy nie ma innych skutecznych rozwiązań terapeutycznych. Wśród technik ultrasonograficznych CEUS jest tą, która przyniosła istotną korzyść nie tylko poprzez zwiększenie czułości i specyficzności ultrasonografii w wykrywaniu przerzutów do wątroby, ale także poprzez ocenę skuteczności leczenia systemowego HCC i przerzutów. Metoda ta została przyjęta przez onkologów od 2003 r., ponieważ nie wymaga napromieniowania i nie ma toksycznego działania na wątrobę lub nerki, a obecnie jest stosowana w ocenie leczenia nowotworów. Jest obecnie stosowany w dużych badaniach klinicznych, których celem jest określenie skuteczności różnych typów cząsteczek antyangiogennych poprzez ilościową ocenę perfuzji wewnątrz guza na podstawie analizy statystycznej przeprowadzonej przy użyciu specjalnego oprogramowania podczas przetwarzania końcowego w celu jak najwcześniejszej oceny skuteczności terapeutycznej. [ potrzebne źródło ]
![Liver cyst[citation needed]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Ultrasonography_of_a_liver_cyst.jpg/120px-Ultrasonography_of_a_liver_cyst.jpg)
![Hydatid liver cyst. Diagnostic criteria are the presence of membranes and sediment inside.[citation needed]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f8/Ultrasonography_of_a_hydatid_liver_cyst.jpg/120px-Ultrasonography_of_a_hydatid_liver_cyst.jpg)