Zespół Creutza-Taubego
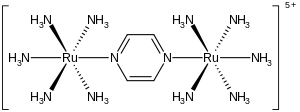
Jon Creutza-Taubego to kompleks metalu o wzorze {[ Ru ( NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ . Ten gatunek kationowy był intensywnie badany w celu zrozumienia intymnych szczegółów przenoszenia elektronów sfery wewnętrznej , to znaczy, w jaki sposób elektrony przemieszczają się z jednego kompleksu metali do drugiego. Jon został nazwany na cześć Carol Creutz, która jako pierwsza przygotowała kompleks, oraz jej promotora Henry'ego Taubego , który otrzymał Nagrodę Nobla w dziedzinie chemii za to i powiązane odkrycia dotyczące transferu elektronów.
Nieruchomości
Kompleks składa się z dwóch jednostek pentaminy rutenu połączonych z atomami azotu w mostkowym ligandzie pirazynowym , który uzupełnia oktaedryczną sferę koordynacyjną każdego metalu. Ważną cechą tego związku jest to, że oba metale mają widoczne ułamkowe stopnie utlenienia +2,5. Zwykle jony metali, podobnie jak większość jonów, mają całkowite stopnie utlenienia. Na przykład kompleksy aminy rutenu mają zwykle wartość +2 lub +3. Fakt, że stopnie utlenienia są półliczbami całkowitymi wskazuje, że dwa centra Ru(NH 3 ) 5 są równoważne pod względem liczby elektronów. Badania krystalograficzne i teoretyczne są zgodne z tym opisem, to znaczy, że dwa centra metali są równoważne. Charakterystyczny dla kompleksu o mieszanej wartościowości , jon ten silnie absorbuje światło w bliskiej podczerwieni części widma elektromagnetycznego . W przypadku jonu Creutza-Taubego maksimum absorpcji występuje przy 1570 nm . Ta absorpcja jest opisana jako pasmo przenoszenia ładunku interwałowego .
Synteza
Jon został pierwotnie wyizolowany jako uwodniona sól tosylanowa [Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 ) (O 3 SC 6 H 4 CH 3 ) 5 ·3H 2 O. Otrzymuje się go w dwóch etapach poprzez kompleks pirazynowy Ru(III)-Ru(III):
- 2 [Ru(NH 3 ) 5 Cl] 2+ + do 4 H 4 N 2 → {[Ru (NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 6+ + 2 Cl -
- 2 {[Ru ( NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 6+ + Zn → 2 {Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ + Zn 2+
Jon Creutza-Taubego ilustruje zalety kompleksów rutenu do badania reakcji redoks. Jony Ru(II) i Ru(III) mogą ulegać wzajemnej konwersji przy łagodnych potencjałach redoks . Oba te stopnie utlenienia są kinetycznie obojętne. Wiele analogów tego jonu zostało przygotowanych przy użyciu różnych ligandów mostkujących.