Czynnik pionierski
Czynniki pionierskie to czynniki transkrypcyjne , które mogą bezpośrednio wiązać skondensowaną chromatynę . Mogą mieć pozytywny i negatywny wpływ na transkrypcję i są ważne w rekrutacji innych czynników transkrypcyjnych i enzymów modyfikujących histony , a także kontrolują metylację DNA . Po raz pierwszy odkryto je w 2002 roku jako czynniki zdolne do wiązania się z miejscami docelowymi na nukleosomalnym DNA w zagęszczonej chromatynie i nadające zdolność do aktywności genów podczas hepatogenezy. Czynniki pionierskie biorą udział w inicjowaniu różnicowania komórek genów specyficznych dla komórki . Właściwość tę obserwuje się w domenie fałdowania histonów zawierającej czynniki transkrypcyjne (fork head box (FOX) i NF-Y ) oraz inne czynniki transkrypcyjne, które wykorzystują palec cynkowy do wiązania DNA (Groucho TLE, Gal4 i GATA).
Komórka eukariotyczna kondensuje swój genom w ciasno upakowaną chromatynę i nukleosomy . Zdolność ta oszczędza miejsce w jądrze tylko dla aktywnie transkrybowanych genów i ukrywa niepotrzebne lub szkodliwe geny przed transkrypcją. Dostęp do tych skondensowanych regionów odbywa się poprzez przebudowę chromatyny poprzez zrównoważenie modyfikacji histonów lub bezpośrednio z czynnikami pionierskimi, które mogą same rozluźnić chromatynę, lub jako flaga rekrutująca inne czynniki. Czynniki pionierskie nie są koniecznie wymagane do złożenia aparatu transkrypcyjnego i mogą ulec dysocjacji po zastąpieniu innymi czynnikami.
Aktywne przegrupowanie

Czynniki pionierskie mogą również aktywnie wpływać na transkrypcję poprzez bezpośrednie otwarcie skondensowanej chromatyny w procesie niezależnym od ATP. Jest to powszechna cecha czynników typu fork head box (które zawierają domenę wiążącą DNA skrzydlatej helisy, która naśladuje domenę wiążącą DNA łącznika histonowego H1) i NF-Y (którego podjednostki NF-YB i NF - YC zawierają histon -fold domeny podobne do domeny histonów rdzeniowych H2A/H2B).
Czynniki głowicy widelca
Podobieństwo do histonu H1 wyjaśnia, w jaki sposób czynniki głowy widełkowej są w stanie wiązać chromatynę poprzez interakcję z głównym rowkiem tylko jednej dostępnej strony DNA owiniętej wokół nukleosomu. Domeny głowy widełek mają również helisę, która nadaje specyficzność sekwencji w przeciwieństwie do histonu łącznika. Koniec C jest powiązany z większą mobilnością wokół nukleosomu niż histon łącznikowy, skutecznie wypierając go i przestawiając krajobrazy nukleosomów. Ta aktywna zmiana układu nukleosomów pozwala innym czynnikom transkrypcyjnym związać dostępny DNA. W różnicowaniu komórek tarczycy FoxE wiąże się ze zwartą chromatyną peroksydazy tarczycowej promotor i otwiera go na wiązanie NF1 .
NF-Y
NF-Y jest heterotrimerycznym kompleksem składającym się z podjednostek NF-YA , NF-YB i NF-YC . Kluczową cechą strukturalną kompleksu NF-Y/DNA jest interakcja z mniejszym rowkiem jego podjednostki NF-YA zawierającej domenę wiążącą DNA , która indukuje zagięcie DNA o ~80°. NF-YB i NF-YC oddziałują z DNA poprzez niespecyficzne kontakty domena-DNA o fałdzie histonowym. Unikalny sposób wiązania DNA NF-YA i podobne do nukleosomów właściwości nieswoistego wiązania DNA NF-YB/NF-YC nakładają wystarczające ograniczenia przestrzenne, aby wywołać wysunięcie się flankujących nukleosomów na zewnątrz, udostępniając pobliskie miejsca rozpoznawania innych czynników transkrypcyjnych.
Czynniki pasywne

Czynniki pionierskie mogą działać pasywnie, pełniąc dla komórki rolę zakładki do rekrutacji innych czynników transkrypcyjnych do określonych genów w skondensowanej chromatynie. Może to być ważne dla przygotowania komórki do szybkiej odpowiedzi, ponieważ wzmacniacz jest już związany przez pionierski czynnik transkrypcyjny, co daje mu przewagę w składaniu kompleksu poprzedzającego inicjację transkrypcji . Odpowiedzi hormonalne są często szybko indukowane w komórce przy użyciu tej metody pobudzania, np. za pomocą receptora estrogenowego . Inną formą torowania jest jednoczesne wiązanie wzmacniacza przez aktywację i tłumienie czynników pionierskich. Równowagę tę można przechylić w wyniku dysocjacji jednego z czynników. W różnicowaniu komórek wątroby aktywujący czynnik pionierski FOXA1 rekrutuje represor grg3, który zapobiega transkrypcji do czasu, aż represor zostanie obniżony w późniejszym procesie różnicowania.
W bezpośredniej roli pionierskie czynniki mogą wiązać wzmacniacz i rekrutować kompleks aktywacyjny, który będzie bezpośrednio modyfikował chromatynę. Zmiana w chromatynie zmienia powinowactwo, zmniejszając powinowactwo czynnika pionierskiego w taki sposób, że zostaje on zastąpiony czynnikiem transkrypcyjnym o wyższym powinowactwie. Jest to mechanizm włączania genu przez komórkę, który zaobserwowano w przypadku receptora glukokortykoidowego , które następnie modyfikują miejsce wiązania aktywowanego receptora estrogenowego, co nazwano mechanizmem „przynęty i zamiany”.
Efekty epigenetyczne
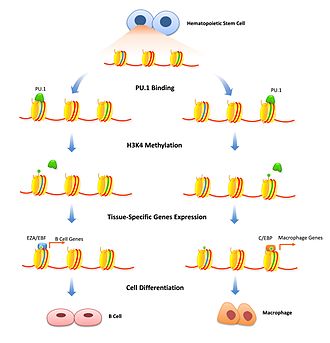
Czynniki pionierskie mogą wykazywać największy zakres wpływu na transkrypcję poprzez modulację czynników epigenetycznych poprzez rekrutację aktywujących lub tłumiących enzymy modyfikujące histony i kontrolowanie metylacji CpG poprzez ochronę określonych reszt cysteiny . Ma to wpływ na kontrolowanie czasu transkrypcji podczas procesów różnicowania komórek.
Modyfikacja histonów
Modyfikacja histonów to dobrze zbadany mechanizm przejściowej regulacji gęstości chromatyny. Czynniki pionierskie mogą odgrywać w tym rolę, wiążąc określone wzmacniacze i sygnalizując enzymy modyfikujące histony z tym konkretnym genem. Represyjne czynniki pionierskie mogą hamować transkrypcję poprzez rekrutację czynników modyfikujących histony, które dodatkowo zacieśniają chromatynę. Jest to ważne, aby ograniczyć ekspresję genów do określonych typów komórek i należy je usunąć dopiero wtedy, gdy rozpoczyna się różnicowanie komórek. FoxD3 powiązano jako represor zarówno komórek B, jak i komórek melanocytowych szlaki różnicowania, utrzymując represyjne modyfikacje histonów tam, gdzie są związane, które należy pokonać, aby rozpocząć różnicowanie. Czynniki pionierskie można również powiązać z rekrutacją modyfikacji histonów aktywujących transkrypcję. Enzymy modyfikujące H3K4 poprzez mono- i di-metylację są powiązane ze zwiększoną transkrypcją i wykazano, że wiążą czynniki pionierskie. W różnicowaniu komórek B PU.1 jest niezbędny do sygnalizowania specyficznych histonów w celu aktywacji modyfikacji H3K4me1, które różnicują hematopoetyczne komórki macierzyste w linię komórek B lub makrofagów. Wiązanie FoxA1 indukuje HSK4me2 podczas różnicowania neuronalnego pluripotencjalnych komórek macierzystych, a także utraty metylacji DNA.
Metylacja DNA
Czynniki pionierskie mogą również wpływać na transkrypcję i różnicowanie poprzez kontrolę metylacji DNA. Pionierskie czynniki wiążące się z wyspami CpG i resztami cytozyny blokują dostęp metylotransferaz. Wiele komórek eukariotycznych ma w swoich promotorach wyspy CpG, które można modyfikować przez metylację, co ma niekorzystny wpływ na ich zdolność do kontrolowania transkrypcji. Zjawisko to występuje również w promotorach bez wysp CpG, gdzie pojedyncze reszty cytozyny są chronione przed metylacją aż do dalszego różnicowania komórek. Przykładem jest FoxD3 zapobiegający metylacji reszty cytozyny w Alb1 wzmacniacz, działający jako nośnik miejsca dla FoxA1 później w wątrobie, jak również w wyspach genów CpG w przewlekłej białaczce limfatycznej . Aby zapewnić stabilną kontrolę stanu metylacji, reszty cytozyny są przykryte podczas mitozy , w przeciwieństwie do większości innych czynników transkrypcyjnych, aby zapobiec metylacji. Badania wykazały, że podczas mitozy wiązało się 15% wszystkich międzyfazowych miejsc wiązania FoxA1. Zabezpieczenie przed metylacją cytozyny można szybko usunąć, co pozwala na szybką indukcję w przypadku pojawienia się sygnału.
Inne czynniki pionierskie
Dobrze zbadaną pionierską rodziną czynników są czynniki transkrypcyjne związane z Groucho (Gro/TLE/Grg), które często mają negatywny wpływ na transkrypcję. Te domeny wiążące chromatynę mogą obejmować do 3-4 nukleosomów. Te duże domeny stanowią rusztowanie dla dalszych interakcji białek, a także modyfikują chromatynę pod kątem innych pionierskich czynników, takich jak FoxA1, który, jak wykazano, wiąże się z Grg3. Czynniki transkrypcyjne z palca cynkowego , takie jak rodzina GATA i receptor glukokortykoidowy. Wydaje się, że domeny palca cynkowego nie wiążą się dobrze z nukleosomami i mogą zostać przemieszczone przez czynniki FOX.
Rola w raku
Zdolność czynników pionierskich do reagowania na sygnały zewnątrzkomórkowe w celu różnicowania typu komórek badano jako potencjalny składnik nowotworów hormonozależnych. Wykazano, że hormony takie jak estrogen i IGFI zwiększają stężenie czynnika pionierskiego, prowadząc do zmiany w transkrypcji. Znane czynniki pionierskie, takie jak FoxA1, PBX1 , TLE, AP2 ɣ , współczynniki GATA 2 / 3 / 4 i PU.1 powiązano z rakiem hormonozależnym. FoxA1 jest niezbędny do hepatokarcynogenezy za pośrednictwem estrogenów i androgenów i jest genem definiującym raka piersi ER + , podobnie jak inny pionierski czynnik GATA3. W szczególności FOXA1 ulega ekspresji w 90% przerzutów raka piersi i 89% przerzutowych raków prostaty. W linii komórkowej raka piersi MCF-7
stwierdzono, że FoxA1 był związany z 50% miejsc wiązania receptora estrogenowego, niezależnie od obecności estrogenu. Wysoka ekspresja czynników pionierskich wiąże się ze złym rokowaniem, z wyjątkiem raka piersi, w przypadku którego FoxA1 wiąże się z silniejszym rokowaniem. Korelacja między czynnikami pionierskimi a rakiem doprowadziła do prospektywnego ukierunkowania terapeutycznego. W badaniach knockdown linii komórkowej raka piersi MCF-7 stwierdzono, że zmniejszanie się czynników pionierskich FoxA1 i AP2 ɣ zmniejsza sygnalizację ER. Inne białka głowy widelca, w tym FoxO3 , są powiązane z rakiem i FoxM, które tłumią szlaki przeżycia komórek Ras i PPI3K/AKT/IKK. Stosuje się leki takie jak paklitaksel , imatinib i doksorubicyna , które aktywują FoxO3a lub jego cele. Modyfikacja mająca na celu modulowanie powiązanych czynników za pomocą aktywności pionierskiej jest tematem zainteresowania na wczesnych etapach, ponieważ obalanie czynników pionierskich może mieć skutki toksyczne poprzez zmianę szlaków rodowych zdrowych komórek.