Efekt zniewalający
Efekt kaptodatywny to stabilizacja rodników poprzez synergistyczne działanie podstawnika odciągającego elektrony i podstawnika będącego donorem elektronów. Nazwa pochodzi od tego, że grupa odciągająca elektrony (EWG) jest czasami nazywana grupą „przechwytującą”, podczas gdy grupa dostarczająca elektrony (EDG) jest podstawnikiem „celownika”. Olefiny z tym wzorem podstawników są czasami opisywane jako zniewalające. Reakcje rodnikowe odgrywają integralną rolę w kilku reakcjach chemicznych i są również ważne w dziedzinie nauki o polimerach .
Gdy EDG i EWG znajdują się w pobliżu radykalnego centrum, stabilność radykalnego centrum wzrasta. Podstawniki mogą kinetycznie stabilizować centra rodnikowe, zapobiegając reakcji cząsteczek i innych centrów rodnikowych z centrum. Podstawniki termodynamicznie stabilizują centrum poprzez delokalizację jonu rodnikowego poprzez rezonans . Te mechanizmy stabilizacji prowadzą do zwiększonej szybkości reakcji wolnorodnikowych. Na rysunku po prawej rodnik jest zdelokalizowany między nitrylem wychwytującym ( -CN) a drugorzędową aminą celownika (-N(CH 3 ) 2 ), stabilizując w ten sposób centrum rodnika.
Efekt podstawnika na szybkość reakcji
Pewne podstawniki są lepsze w stabilizowaniu rodnikowych centrów niż inne. Wpływa na to zdolność podstawnika do delokalizacji jonu rodnikowego w strukturze stanu przejściowego . Delokalizacja jonu rodnikowego stabilizuje strukturę stanu przejściowego. W rezultacie energia aktywacji maleje, zwiększając szybkość całej reakcji. Zgodnie z efektem kaptodatywnym szybkość reakcji jest największa, gdy zarówno EDG, jak i EWG są w stanie zdelokalizować rodnikowy jon w strukturze stanu przejściowego.
Ito i współpracownicy zaobserwowali szybkość reakcji addycji rodnika arylotiylowego do dipodstawionych olefin. Olefiny zawierały nitrylową EWG i różne EDG i obserwowano wpływ różnych EDG na szybkość reakcji addycji. Badany proces to:
Szybkość reakcji addycji została przyspieszona przez następujące EDG w rosnącej kolejności: H < CH3 < OCH2CH3 . Gdy R = OCH 2 CH 3 , szybkość reakcji jest największa, ponieważ reakcja ma najmniejszą energię aktywacji (ΔG ‡ ). Grupy etoksylowe i cyjanowe są zdolne do delokalizacji jonu rodnikowego w stanie przejściowym, stabilizując w ten sposób centrum rodnikowe. Wzrost szybkości wynika z efektu niewoli. Gdy R = H, reakcja ma największą energię aktywacji, ponieważ centrum rodnikowe nie jest stabilizowane przez efekt kaptodacyjny. Atom wodoru nie jest w stanie zdelokalizować jonu rodnikowego. Zatem reakcja jest powolna w stosunku do przypadku R = OCH 2 CH 3 . Gdy R = CH 3 , szybkość reakcji jest większa w porównaniu z sytuacją, gdy R = H, ponieważ grupy metylowe mają większą zdolność oddawania elektronów. Jednak szybkość reakcji jest wolniejsza w stosunku do sytuacji, gdy R = OCH2CH3, ponieważ rodnikowy jon nie jest zdelokalizowany nad grupą metylową. Tak więc, captodative nie wpływa na szybkość reakcji, jeśli rodnikowy jon nie jest zdelokalizowany zarówno na podstawniki EWG, jak i EDG. Każdy z tych przypadków jest zilustrowany poniżej:
Używa w syntezie
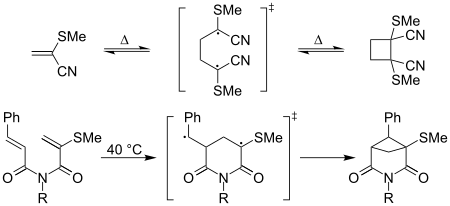
Termin „zniewalające etyleny” był używany w kontekście reakcji cykloaddycji obejmujących pośrednie rodniki wiążące - na przykład termiczna [2 + 2] bezpośrednia dimeryzacja 2-metylotioakrylonitrylu zachodzi łatwo w temperaturze pokojowej; tworzenie równoważnej pochodnej cyklobutanu akrylonitrylu jest „powolne”. Zgłaszano również, że wewnątrzcząsteczkowe cyklizacje [2 + 2] są wzmacniane przez efekty kaptodacyjne, jak pokazano poniżej:
Podobne efekty zostały omówione dla innych cykloaddycji, takich jak [3+2], [4+2] i [3+4] dla etylenów wiążących. Efekty odnotowano również w przypadkach, takich jak Dielsa-Aldera i Friedela-Craftsa, w przypadkach, w których olefiny nukleofilowe reagują nieefektywnie, co przypisuje się stanowi przejściowemu zbliżonemu do dwurodnikowego, a tym samym ustabilizowanemu. Badania te ujawniły bezpośrednią zależność od Δω, różnicę w elektrofilowości i polarny charakter reakcji. Zostały one użyte ze względu na ich wysoce reaktywny, stereoselektywny, regioselektywny charakter w tych reakcjach.
Olefiny kaptodatywne w reakcjach wykazują również efekty zakłócające z typowym kinetycznym efektem izotopowym , umożliwiając zachodzenie nietypowych reakcji z cząsteczkami znakowanymi izotopowo i wykazując, że wpłynęły na mechanizmy i stany przejściowe tych reakcji.
Aplikacja nauki o polimerach
Polimeryzacja wolnorodnikowa , w której rodniki są nośnikami łańcucha w propagacji procesu, stanowiła 40 miliardów z 110 miliardów funtów polimerów wyprodukowanych w Stanach Zjednoczonych w 2001 roku. Olefiny kaptodatywne mają szczególną zaletę, ponieważ reagują na działanie rozpuszczalnika bez efekt destabilizacji rodnika. Wykazano również, że ulegają spontanicznej przemianie rodnikowej, co pozwala im być użytecznymi w wyjaśnianiu mechanizmu polimeryzacji i lepiej rozumianymi poprzez badania NMR . Ponadto, kaptodatywne etany są inicjatorami o unikalnych właściwościach, dających wyższy rozkład masy cząsteczkowej i tworzących kopolimery blokowe poprzez znane mechanizmy rodnikowe. Polimery otrzymane z substratów podstawionych kaptodatywnie wykazują „pożądane” właściwości, takie jak aktywność optyczna, różnice w polarności, powinowactwo do rozpuszczalnika, stabilność termiczna i mechaniczna.
- Wiadomo, że polimery z podstawnikami polarnymi mają interesujące zastosowania, w tym w materiałach elektrycznych i optycznych .
- Te polimery są zazwyczaj przezroczyste.
- Tdi (początkowy rozkład) tych polimerów są stosunkowo niskie w porównaniu z ich analogami, ale mają stosunkowo wyższą Tdm ( maksymalna szybkość zmian masy temperatur) . Oznacza to, że chociaż zaczną topić się szybciej, pełna zmiana faz zajmie więcej czasu.
- Polimery z materiałami wyjściowymi o dużych stabilizacjach kaptodatywnych mogą szybko „rozpakować się” do wyjściowego monomeru po podgrzaniu.
-
dwufunkcyjne , z dwiema różnymi grupami funkcyjnymi w każdej jednostce monomeru, są zwykle tworzone z monomerów kaptodatywnych.
- Grupy celownicze zasadniczo zmieniają rozpuszczalność poprzez wiązania wodorowe w określonych polimerach dwufunkcyjnych (patrz rysunek powyżej). Jednak obecnie nie opracowano żadnej wyraźnej korelacji, ponieważ nie zbadano wszystkich kombinacji podstawników i rozpuszczalności.
- Polimer kaptodatywny jest wysoce funkcjonalny w chelatach z niektórymi metalami.