Izoterma Gibbsa
Izoterma adsorpcji Gibbsa dla układów wieloskładnikowych jest równaniem służącym do powiązania zmian stężenia składnika w kontakcie z powierzchnią ze zmianami napięcia powierzchniowego , co skutkuje odpowiednią zmianą energii powierzchniowej . W przypadku układu podwójnego równanie adsorpcji Gibbsa pod względem nadmiaru powierzchni jest następujące:
Gdzie
- to napięcie powierzchniowe ,
- i to nadmiarowe stężenie powierzchniowe składnika i,
- i jest potencjał chemiczny składnika i.
Adsorpcja
Różne wpływy na granicy faz mogą powodować zmiany w składzie warstwy przypowierzchniowej. Substancje mogą albo gromadzić się blisko powierzchni, albo odwrotnie, przemieszczać się w głąb. Ruch cząsteczek charakteryzuje zjawisko adsorpcji . Adsorpcja wpływa na zmiany napięcia powierzchniowego i stabilność koloidu . Warstwy adsorpcyjne na powierzchni ciekłego ośrodka dyspersyjnego mogą wpływać na interakcje cząstek rozproszonych w ośrodku iw konsekwencji warstwy te mogą odgrywać kluczową rolę w stabilności koloidu. Adsorpcja cząsteczek fazy ciekłej na granicy faz zachodzi, gdy ta faza ciekła styka się z innymi niemieszającymi się fazami, które mogą być gazowe, ciekłe lub stałe
Konceptualne wyjaśnienie równania
Napięcie powierzchniowe opisuje, jak trudno jest rozszerzyć obszar powierzchni (poprzez jej rozciągnięcie lub zniekształcenie). Jeśli napięcie powierzchniowe jest wysokie, do zwiększenia powierzchni wymagana jest duża energia swobodna, więc powierzchnia będzie miała tendencję do kurczenia się i utrzymywania razem jak arkusz gumy.
Istnieje wiele czynników wpływających na napięcie powierzchniowe, z których jednym jest to, że skład powierzchni może różnić się od składu masy. Na przykład, jeśli woda jest zmieszana z niewielką ilością środków powierzchniowo czynnych (na przykład mydła do rąk ), masa wody może składać się z 99% cząsteczek wody i 1% cząsteczek mydła, ale najwyższa powierzchnia wody może składać się 50% cząsteczek mydła. W tym przypadku mydło ma duży i dodatni „nadmiar powierzchni”. W innych przykładach nadmiar powierzchniowy może być ujemny: na przykład, jeśli woda jest zmieszana z solą nieorganiczną , taką jak chlorek sodu , powierzchnia wody jest średnio mniej słona i czystsza niż średnia objętościowa.
Rozważmy ponownie przykład wody z odrobiną mydła. Ponieważ powierzchnia wody musi mieć wyższe stężenie mydła niż masa, za każdym razem, gdy zwiększa się powierzchnia wody, konieczne jest usunięcie cząsteczek mydła z masy i dodanie ich do nowej powierzchni. Jeśli stężenie mydła zostanie nieco zwiększone, cząsteczki mydła są łatwiej dostępne (mają wyższy potencjał chemiczny ), więc łatwiej jest je wyciągnąć z masy w celu stworzenia nowej powierzchni. Ponieważ łatwiej jest stworzyć nową powierzchnię, napięcie powierzchniowe jest obniżone. Ogólna zasada brzmi:
- Gdy nadmiar powierzchni składnika jest dodatni, zwiększenie potencjału chemicznego tego składnika zmniejsza napięcie powierzchniowe.
Następnie rozważ przykład wody z solą. Powierzchnia wody jest mniej słona niż masowa, więc za każdym razem, gdy zwiększa się powierzchnia wody, konieczne jest usunięcie cząsteczek soli z nowej powierzchni i wypchnięcie ich do objętości. potencjał chemiczny soli ), trudniej będzie odepchnąć cząsteczki soli. Ponieważ tworzenie nowej powierzchni jest teraz trudniejsze, napięcie powierzchniowe jest wyższe. Ogólna zasada brzmi:
- Gdy nadmiar powierzchni składnika jest ujemny, zwiększenie potencjału chemicznego tego składnika zwiększa napięcie powierzchniowe.
Równanie izotermy Gibbsa podaje dokładny ilościowy związek dla tych trendów.
Położenie powierzchni i określenie nadmiaru powierzchni
Lokalizacja powierzchni
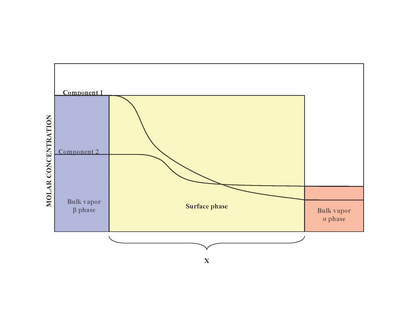
W obecności dwóch faz ( α i β ) powierzchnia (faza powierzchniowa) znajduje się pomiędzy fazą α i fazą β . Eksperymentalnie trudno jest określić dokładną strukturę niejednorodnej fazy powierzchniowej, która styka się z masową fazą ciekłą zawierającą więcej niż jedną substancję rozpuszczoną. Niejednorodność fazy powierzchniowej jest wynikiem zmienności stosunków molowych. Model zaproponowany przez Josiaha Willarda Gibbsa sugerował, że faza powierzchniowa jest wyidealizowanym modelem o zerowej grubości. W rzeczywistości, chociaż obszary masowe α i β są stałe, stężenia składników w obszarze międzyfazowym będą stopniowo zmieniać się od stężenia masowego α do stężenia masowego β na odległość x. Kontrastuje to z wyidealizowanym modelem Gibbsa, w którym odległość x przyjmuje wartość zero. Diagram po prawej stronie ilustruje różnice między modelami rzeczywistymi i wyidealizowanymi.
Definicja nadmiaru powierzchni
W wyidealizowanym modelu składniki chemiczne faz objętościowych α i β pozostają niezmienione, z wyjątkiem sytuacji, gdy zbliżają się do powierzchni dzielącej. Całkowita liczba moli dowolnego składnika (przykłady obejmują: wodę, glikol etylenowy itp.) pozostaje stała w fazach objętościowych, ale zmienia się w fazie powierzchniowej dla rzeczywistego modelu układu, jak pokazano poniżej.
Jednak w rzeczywistym systemie całkowita liczba moli składnika zmienia się w zależności od dowolnego rozmieszczenia powierzchni dzielącej. Ilościową miarą adsorpcji i -tego składnika jest wielkość nadmiaru powierzchniowego. Nadmiar powierzchniowy reprezentuje różnicę między całkowitą liczbą moli i -tego składnika w układzie a liczbą moli i-tego składnika w określonej fazie (albo α albo β ) i jest reprezentowany przez:
gdzie Γ i to nadmiar powierzchniowy i -tego składnika, n to mole, α i β to fazy, a A to pole powierzchni dzielącej.
Γ reprezentuje nadmiar substancji rozpuszczonej na jednostkę powierzchni w stosunku do tego, co byłoby obecne, gdyby stężenie masowe przeważało na całej powierzchni, może być dodatnie, ujemne lub zerowe. Ma jednostki mol/m 2 .
Względny nadmiar powierzchni
Względne nadmiary powierzchni są bardziej przydatne niż dowolne nadmiary powierzchni. Względny nadmiar powierzchni odnosi adsorpcję na granicy faz do rozpuszczalnika w fazie objętościowej. Zaletą stosowania względnych nadmiarów powierzchni jest to, że nie zależą one od położenia powierzchni dzielącej. Względny nadmiar powierzchni gatunku i i rozpuszczalnika 1 wynosi zatem:
Równanie izotermy adsorpcji Gibbsa
Wyprowadzenie równania adsorpcji Gibbsa
Dla układu dwufazowego składającego się z fazy α i β w równowadze z powierzchnią S dzielącą fazy, całkowitą energię swobodną Gibbsa układu można zapisać jako:
gdzie G jest energią swobodną Gibbsa.
Równanie izotermy adsorpcji Gibbsa można wyprowadzić z „uszczegółowienia termodynamiki twierdzenia Eulera o jednorodnych formach pierwszego rzędu”. Energię swobodną Gibbsa każdej fazy α , fazy β i fazy powierzchniowej można przedstawić za pomocą równania:
gdzie U to energia wewnętrzna, p to ciśnienie, V to objętość, T to temperatura, S to entropia, a μ i to potencjał chemiczny i -tego składnika.
Biorąc całkowitą pochodną postaci Eulera równania Gibbsa dla fazy α , fazy β i fazy powierzchniowej:
gdzie A jest polem powierzchni dzielącej, a γ jest napięciem powierzchniowym .
W przypadku procesów odwracalnych pierwsza zasada termodynamiki wymaga, aby:
gdzie q to energia cieplna, a w to praca.
Podstawiając powyższe równanie do całkowitej pochodnej równania energii Gibbsa i wykorzystując wynik γd A przyrównuje się do bezciśnieniowej pracy objętościowej przy uwzględnieniu energii powierzchniowej:
wykorzystując fundamentalne równanie energii Gibbsa układu wieloskładnikowego:
Równanie odnoszące się do fazy α , fazy β i fazy powierzchni wygląda następująco:
Rozważając fazy objętościowe ( faza α , faza β ), w równowadze przy stałej temperaturze i ciśnieniu, równanie Gibbsa-Duhema wymaga, aby:
Otrzymane równanie to równanie izotermy adsorpcji Gibbsa:
Izoterma adsorpcji Gibbsa to równanie, które można uznać za izotermę adsorpcji , łączące napięcie powierzchniowe roztworu ze stężeniem substancji rozpuszczonej.
Dla układu podwójnego zawierającego dwa składniki równanie adsorpcji Gibbsa pod względem nadmiaru powierzchni wynosi:
Zależność między napięciem powierzchniowym a nadmiernym stężeniem powierzchniowym
Potencjał chemiczny gatunku i w roztworze zależy od aktywności a za pomocą następującego równania:
gdzie μ i to potencjał chemiczny i -tego składnika, μ io aktywność to potencjał chemiczny i -tego składnika w stanie odniesienia, R to stała gazowa , T to temperatura, a a i to i - ty składnik.
Zróżnicowanie równania potencjału chemicznego daje:
gdzie f jest współczynnikiem aktywności składnika i , a C jest stężeniem gatunku i w fazie masowej.
Jeżeli roztwory w fazach α i β są rozcieńczone (bogate w jeden określony składnik i ), to współczynnik aktywności składnika i zbliża się do jedności, a izoterma Gibbsa przyjmuje postać:
Powyższe równanie zakłada, że interfejs jest dwuwymiarowy, co nie zawsze jest prawdą. Dalsze modele, takie jak Guggenheima, korygują tę wadę.
Efekty dysocjacji jonowej
Równanie Gibbsa dla adsorpcji elektrolitu
Rozważmy układ składający się z wody, która zawiera organiczny elektrolit RNaz i nieorganiczny elektrolit NaCl, które ulegają całkowitej dysocjacji, tak że:
Równanie adsorpcji Gibbsa pod względem względnego nadmiaru powierzchni wygląda następująco:
Zależność między napięciem powierzchniowym a nadmiernym stężeniem powierzchniowym wygląda następująco:
gdzie m jest współczynnikiem adsorpcji Gibbsa. Wartości m są obliczane przy użyciu modeli dwuwarstwowych (międzyfazowych) Helmholtza , Gouya i Sterna .
Substancje mogą mieć różny wpływ na napięcie powierzchniowe, jak pokazano: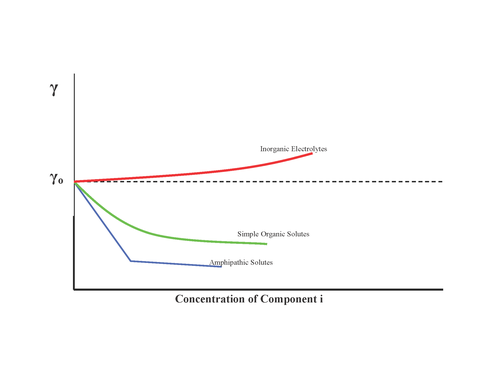
- Brak efektu, na przykład cukier
- Wzrost napięcia powierzchniowego, sole nieorganiczne
- Stopniowo zmniejszać napięcie powierzchniowe, alkohole
- Zmniejsz napięcie powierzchniowe, a po osiągnięciu minimum nie ma już efektu: środki powierzchniowo czynne
Dlatego izoterma Gibbsa przewiduje, że sole nieorganiczne mają ujemne stężenia powierzchniowe. Jednak pogląd ten został szeroko zakwestionowany w ostatnich latach ze względu na połączenie bardziej precyzyjnych eksperymentów wrażliwych międzyfazowo i modeli teoretycznych, z których oba przewidują wzrost skłonności powierzchniowej halogenków wraz ze wzrostem wielkości i polaryzowalności. Jako takie, napięcie powierzchniowe nie jest wiarygodną metodą określania względnej skłonności jonów do granicy faz powietrze-woda.
Aby udowodnić słuszność modelu, potrzebna jest metoda określania stężeń powierzchniowych: zwykle stosuje się dwie różne techniki: elipsometrię i śledzenie rozpadu 14 C obecnego w cząsteczkach środka powierzchniowo czynnego.
Izoterma Gibbsa dla jonowych środków powierzchniowo czynnych
Jonowe środki powierzchniowo czynne wymagają szczególnej uwagi, ponieważ są elektrolitami :
- do
gdzie odnosi się do stężenia powierzchniowego cząsteczek środka powierzchniowo czynnego przeciwjonu
- W obecności dodanych elektrolitów
metody eksperymentalne
Stopień adsorpcji na granicy faz cieczy można ocenić za pomocą danych o stężeniu napięcia powierzchniowego i równania adsorpcji Gibbsa. Metoda ostrza mikrotomu stężenia molowego interfejsu. Metoda polega na uzyskaniu powierzchni jednego metra kwadratowego granicy faz powietrze-ciecz roztworów binarnych za pomocą mikrotomu .
Inną metodą stosowaną do określenia stopnia adsorpcji na granicy faz powietrze-woda jest technika emulsyjna, którą można wykorzystać do oszacowania względnego nadmiaru powierzchni w stosunku do wody.
Dodatkowo nadmiar powierzchniowy Gibbsa składnika powierzchniowo czynnego dla roztworu wodnego można znaleźć metodą znacznika radioaktywnego . Składnik powierzchniowo czynny jest zwykle oznaczony węglem-14 lub siarką-35.
- ^ a b c d Shchukin, ED, Pertsov, AV, Amelina EA i Zelenev, AS Colloid and Surface Chemistry. 1. wyd. Mobius D. i Miller R. Cz. 12. Amsterdam: Elsevier Science BV 2001.
- ^ abc Raj . Hiemenz, Paul C. i Rajagopalan, Zasady chemii koloidów i powierzchni . wyd. 3. Nowy Jork: Marcel Dekker, Inc, 1997.
- ^ a b c d e f g Chattoraj, DK i Birdi, KS Adsorpcja i nadmiar powierzchni Gibbsa. Nowy Jork: Plenum Publishing Company, 1984.
- ^ Callen, Herbert B. Termodynamika i wprowadzenie do termostatów . wyd. 2 Kanada: John Wiley & Sons, Inc, 1985.
- ^ Petersen, Poul B.; Saykaly, Richard J. (2006). „O naturze jonów na powierzchni ciekłej wody”. Roczny przegląd chemii fizycznej . 57 (1): 333–364. doi : 10.1146/annurev.physchem.57.032905.104609 .