Model Monoda-Wymana-Changeux
W biochemii model Monoda-Wymana-Changeux ( model MWC , znany również jako model symetrii ) opisuje przejścia allosteryczne białek zbudowanych z identycznych podjednostek. Został zaproponowany przez Jean-Pierre'a Changeux w jego rozprawie doktorskiej i opisany przez Jacquesa Monoda , Jeffriesa Wymana i Jean-Pierre'a Changeux . Kontrastuje to z modelem sekwencyjnym .
Koncepcja dwóch odrębnych stanów symetrycznych jest głównym postulatem modelu MWC. Główną ideą jest to, że regulowane białka , takie jak wiele enzymów i receptorów , istnieją w różnych stanach wzajemnej konwersji przy braku jakiegokolwiek regulatora . Stosunek różnych konformacyjnych jest określony przez równowagę termiczną . Model ten jest zdefiniowany przez następujące zasady:
- Białko allosteryczne jest oligomerem protomerów, które są symetrycznie powiązane (w przypadku hemoglobiny założymy, dla uproszczenia algebraicznego, że wszystkie cztery podjednostki są funkcjonalnie identyczne).
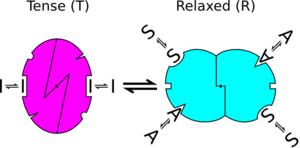
- Każdy protomer może istnieć w (co najmniej) dwóch stanach konformacyjnych, oznaczonych jako T i R; stany te są w równowadze niezależnie od tego, czy ligand jest związany z oligomerem, czy nie.
- Ligand może wiązać się z protomerem w dowolnej konformacji. Tylko zmiana konformacyjna zmienia powinowactwo protomeru do ligandu. Regulatorzy jedynie przesuwają równowagę w kierunku jednego lub drugiego stanu. Na przykład agonista stabilizuje aktywną postać receptora farmakologicznego . Fenomenologicznie wygląda to tak, jakby agonista prowokował przejście konformacyjne. Jedną z kluczowych cech modelu jest dysocjacja między funkcją wiązania (udział białka związanego z regulatorem) a funkcją stanu (ułamek białka w stanie aktywowanym), por. poniżej. W modelach, o których mówi się o „dopasowaniu indukowanym”, funkcje te są identyczne.
W modelu historycznym każda jednostka allosteryczna nazywana jest protomerem (ogólnie zakłada się, że jest to podjednostka), może istnieć w dwóch różnych stanach konformacyjnych - oznaczonych jako „R” (dla stanu rozluźnionego) lub „T” (dla stanu napiętego). W dowolnej cząsteczce wszystkie protomery muszą być w tym samym stanie. Oznacza to, że wszystkie podjednostki muszą być w stanie R lub T. Białka z podjednostkami w różnych stanach nie są dozwolone w tym modelu. Stan R ma większe powinowactwo do ligandu niż stan T. Z tego powodu, chociaż ligand może wiązać się z podjednostką, gdy jest w dowolnym stanie, wiązanie ligandu zwiększy równowagę na korzyść stanu R.
Można wyprowadzić dwa równania, które wyrażają ułamkowe zajęcie miejsca wiązania ligandu (Y) i ułamek białek w stanie R (R):
gdzie stałą allosteryczną, brak liganda, i T dla , znormalizowane stężenie ligandu. Nie jest od razu oczywiste, że wyrażenie na jest formą równania Adaira , ale , jak widać mnożąc wyrażenia w nawiasach i porównując współczynniki potęg odpowiednimi Adaira
Model ten wyjaśnia sigmoidalne właściwości wiązania (tj. dodatnią kooperatywność ), ponieważ zmiana stężenia ligandu w niewielkim zakresie doprowadzi do dużego wzrostu proporcji cząsteczek w stanie R, a tym samym doprowadzi do wysokiego asocjacji ligandu z białko. Nie może wyjaśnić negatywnej współpracy.
Model MWC okazał się bardzo popularny w enzymologii i farmakologii , chociaż w pewnej liczbie przypadków okazał się nieodpowiedni. Najlepszym przykładem udanego zastosowania modelu jest regulacja hemoglobiny . Rozszerzenia modelu zostały zaproponowane przez różnych autorów dla sieci białek. Edelstein argumentował, że model MWC lepiej odzwierciedla dane dotyczące hemoglobiny niż model sekwencyjny. On i Changeux zastosowali model do transdukcji sygnału. Changeux omówił status modelu po 50 latach.


![{\displaystyle L=[T]_{0}/[R]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cbdf99ea76d9218c4968cba84fdd370e6ccb320)

![{\displaystyle \alpha =[X]/K_{R}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfd3d31314605c0a461cd25d07413918b75dee9a)


