Biochemia
| Część serii o |
| biochemii |
|---|

|
Biochemia lub chemia biologiczna to nauka o procesach chemicznych zachodzących w organizmach żywych i związanych z nimi . Subdyscyplina zarówno chemii , jak i biologii , biochemia może być podzielona na trzy dziedziny: biologię strukturalną , enzymologię i metabolizm . W ciągu ostatnich dziesięcioleci XX wieku biochemia odniosła sukces w wyjaśnianiu procesów życiowych za pomocą tych trzech dyscyplin. Prawie wszystkie obszary nauk przyrodniczych są odkrywane i rozwijane dzięki metodologii i badaniom biochemicznym. Biochemia koncentruje się na zrozumieniu podstaw chemicznych, które pozwalają cząsteczkom biologicznym wywołać procesy zachodzące w żywych komórkach i między komórkami, co z kolei wiąże się w dużym stopniu ze zrozumieniem tkanek i narządów , a także struktury i funkcji organizmu. Biochemia jest ściśle związana z biologią molekularną , która zajmuje się badaniem molekularnych mechanizmów zjawisk biologicznych.
Znaczna część biochemii dotyczy struktur, wiązań, funkcji i interakcji biologicznych makrocząsteczek , takich jak białka , kwasy nukleinowe , węglowodany i lipidy . Zapewniają strukturę komórek i pełnią wiele funkcji związanych z życiem. Chemia komórki zależy również od reakcji małych cząsteczek i jonów . Mogą to być związki nieorganiczne (na przykład woda i jony metali ) lub organiczne (na przykład aminokwasy używane do syntezy białek ). Mechanizmy wykorzystywane przez komórki do pozyskiwania energii ze środowiska poprzez reakcje chemiczne są znane jako metabolizm . Odkrycia biochemii znajdują zastosowanie przede wszystkim w medycynie , żywieniu i rolnictwie . W medycynie biochemicy badają przyczyny i sposoby leczenia chorób . Żywienie zajmuje się nauką o tym, jak zachować zdrowie i dobre samopoczucie, a także o skutkach niedoborów żywieniowych . W rolnictwie biochemicy badają glebę i nawozy . Celem jest również poprawa uprawy, przechowywania plonów i zwalczania szkodników . Biochemia jest niezwykle ważna, ponieważ pomaga ludziom uczyć się skomplikowanych zagadnień, takich jak priony .
Historia
W swojej najbardziej wszechstronnej definicji biochemia może być postrzegana jako badanie składników i składu żywych istot oraz tego, jak łączą się, aby stać się życiem. W tym sensie historia biochemii może więc sięgać aż do starożytnych Greków . Jednak biochemia jako specyficzna dyscyplina naukowa rozpoczęła się gdzieś w XIX wieku lub nieco wcześniej, w zależności od tego, na jakim aspekcie biochemii się koncentruje. Niektórzy twierdzili, że początkiem biochemii mogło być odkrycie pierwszego enzymu , diastazy (obecnie zwanej amylazą ), w 1833 roku przez Anselme Payena , podczas gdy inni uważali, że Eduard Buchner jako pierwszy zademonstrował złożony proces biochemiczny fermentacja alkoholowa w bezkomórkowych ekstraktów w 1897 roku za narodziny biochemii. Niektórzy mogą również wskazać jego początek na wpływową pracę Justusa von Liebiga z 1842 r ., Chemia zwierząt, czyli chemia organiczna w zastosowaniach do fizjologii i patologii , która przedstawiła chemiczną teorię metabolizmu, a nawet wcześniejsze, XVIII-wieczne badania nad fermentacją i oddychanie – Antoine Lavoisier . Wielu innych pionierów w tej dziedzinie, którzy pomogli odkryć warstwy złożoności biochemii, zostało ogłoszonych założycielami współczesnej biochemii. Emil Fischer , który badał chemię białek, oraz F. Gowland Hopkins , który badał enzymy i dynamiczną naturę biochemii, reprezentują dwa przykłady wczesnych biochemików.
Sam termin „biochemia” wywodzi się z połączenia biologii i chemii . W 1877 roku Felix Hoppe-Seyler użył terminu ( po niemiecku biochemia ) jako synonimu chemii fizjologicznej we wstępie do pierwszego numeru Zeitschrift für Physiologische Chemie (Journal of Physiological Chemistry), w którym opowiadał się za utworzeniem instytutów poświęconych ten kierunek studiów. Jednak często cytuje się, że niemiecki chemik Carl Neuberg ukuł to słowo w 1903 roku, podczas gdy niektórzy przypisywali je Franzowi Hofmeisterowi .
Kiedyś powszechnie wierzono, że życie i jego materiały mają jakąś zasadniczą właściwość lub substancję (często określaną jako „zasada życia ”), różniącą się od tych, które można znaleźć w materii nieożywionej, i uważano, że tylko żywe istoty mogą wytwarzać cząsteczki życie. W 1828 roku Friedrich Wöhler opublikował artykuł na temat swojej nieoczekiwanej syntezy mocznika z cyjanianu potasu i siarczanu amonu; niektórzy uważali to za bezpośrednie obalenie witalizmu i ustanowienie chemii organicznej . Jednak synteza Wöhlera wywołała kontrowersje, ponieważ niektórzy odrzucają śmierć witalizmu z jego rąk. Od tego czasu biochemia rozwinęła się, zwłaszcza od połowy XX wieku, wraz z rozwojem nowych technik, takich jak chromatografia , dyfrakcja rentgenowska , interferometria z podwójną polaryzacją , spektroskopia NMR , znakowanie radioizotopowe , mikroskopia elektronowa i symulacje dynamiki molekularnej . Techniki te pozwoliły na odkrycie i szczegółową analizę wielu molekuł i szlaków metabolicznych komórki , takich jak glikoliza i cykl Krebsa (cykl kwasu cytrynowego) oraz doprowadziły do zrozumienia biochemii na poziomie molekularnym.
Innym znaczącym wydarzeniem historycznym w biochemii jest odkrycie genu i jego roli w przekazywaniu informacji w komórce. W latach pięćdziesiątych James D. Watson , Francis Crick , Rosalind Franklin i Maurice Wilkins odegrali kluczową rolę w rozwiązaniu struktury DNA i zasugerowaniu jej związku z genetycznym transferem informacji. W 1958 roku George Beadle i Edward Tatum otrzymali Nagrodę Nobla za pracę nad grzybami, która wykazała, że jeden gen wytwarza jeden enzym . W 1988 roku Colin Pitchfork był pierwszą osobą skazaną za morderstwo z dowodami DNA , co doprowadziło do rozwoju kryminalistyki . Niedawno Andrew Z. Fire i Craig C. Mello otrzymali w 2006 roku Nagrodę Nobla za odkrycie roli interferencji RNA (RNAi) w wyciszaniu ekspresji genów .
Materiały wyjściowe: pierwiastki chemiczne życia
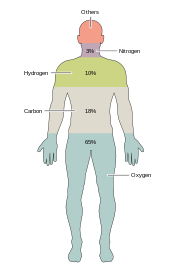
Około dwudziestu pierwiastków chemicznych jest niezbędnych dla różnych rodzajów życia biologicznego . Większość rzadkich pierwiastków na Ziemi nie jest potrzebna życiu (z wyjątkiem selenu i jodu ), a kilka pospolitych pierwiastków ( aluminium i tytan ) nie jest używanych. Większość organizmów ma wspólne zapotrzebowanie na pierwiastki, ale istnieje kilka różnic między roślinami i zwierzętami . Na przykład glony oceaniczne używają bromu , ale rośliny lądowe i zwierzęta wydają się go nie potrzebować. Wszystkie zwierzęta wymagają sodu , ale nie jest on niezbędnym elementem dla roślin. Rośliny potrzebują boru i krzemu , ale zwierzęta nie mogą (lub mogą potrzebować bardzo małych ilości).
Zaledwie sześć pierwiastków — węgiel , wodór , azot , tlen , wapń i fosfor — stanowi prawie 99% masy żywych komórek, w tym komórek ludzkiego ciała ( pełna lista znajduje się w składzie ludzkiego ciała ). Oprócz sześciu głównych elementów, które składają się na większość ludzkiego ciała, ludzie potrzebują mniejszych ilości, prawdopodobnie 18 więcej.
Biomolekuły
Cztery główne klasy cząsteczek w biochemii (często nazywane biomolekułami ) to węglowodany , lipidy , białka i kwasy nukleinowe . Wiele cząsteczek biologicznych to polimery : w tej terminologii monomery to stosunkowo małe makrocząsteczki, które są połączone ze sobą, tworząc duże makrocząsteczki zwane polimerami. Kiedy monomery łączą się ze sobą w celu syntezy polimeru biologicznego , przechodzą proces zwany syntezą odwodnienia . Różne makrocząsteczki mogą łączyć się w większe kompleksy, często potrzebne do aktywności biologicznej .
Węglowodany
Dwie główne funkcje węglowodanów to magazynowanie energii i zapewnianie struktury. Jeden z powszechnych cukrów , znany jako glukoza, jest węglowodanem, ale nie wszystkie węglowodany są cukrami. Na Ziemi jest więcej węglowodanów niż jakikolwiek inny znany rodzaj biomolekuły; służą do przechowywania energii i informacji genetycznej , a także odgrywają ważną rolę w interakcjach i komunikacji między komórkami .
Najprostszym rodzajem węglowodanów jest monosacharyd , który oprócz w innych właściwości zawiera węgiel, wodór i tlen, przeważnie stosunku 1:2:1 (wzór uogólniony CnH2nOn , gdzie n wynosi co najmniej 3). Glukoza (C 6 H 12 O 6 ) jest jednym z najważniejszych węglowodanów; inne obejmują fruktozę (C 6 H 12 O 6 ), cukier powszechnie kojarzony ze słodkim smakiem owoców , oraz dezoksyrybozę ( C 5 H 10 O 4 ), składnik DNA . Monosacharyd może przełączać się między formą acykliczną (otwarty łańcuch) a formą cykliczną . Formę otwartego łańcucha można przekształcić w pierścień atomów węgla połączonych mostkiem przez tlenu utworzony z grupy karbonylowej na jednym końcu i grupy hydroksylowej na drugim. Cykliczna cząsteczka ma hemiacetalową lub hemiketalową , w zależności od tego, czy forma liniowa była aldozą czy ketozą .
W tych formach cyklicznych pierścień ma zwykle 5 lub 6 atomów. Formy te nazywane są furanozami i piranozami - przez analogię z furanem i piranem , najprostszymi związkami z tym samym pierścieniem węgiel-tlen (chociaż brakuje im podwójnych wiązań węgiel-węgiel tych dwóch cząsteczek). Na przykład glukoza aldoheksoza może tworzyć wiązanie hemiacetalowe między grupą hydroksylową na węglu 1 a tlenem na węglu 4, dając cząsteczkę z 5-członowym pierścieniem, zwaną glukofuranozą . Ta sama reakcja może zachodzić między atomami węgla 1 i 5, tworząc cząsteczkę z 6-członowym pierścieniem, zwaną glukopiranozą . Formy cykliczne z 7-atomowym pierścieniem zwane heptozami są rzadkie.
Dwa monosacharydy można połączyć wiązaniem glikozydowym lub estrowym w disacharyd poprzez reakcję odwodnienia , podczas której uwalniana jest cząsteczka wody. Odwrotna reakcja, w której wiązanie glikozydowe disacharydu jest rozbijane na dwa monosacharydy, nazywana jest hydrolizą . Najbardziej znanym disacharydem jest sacharoza lub zwykły cukier , który składa się z połączonej cząsteczki glukozy i cząsteczki fruktozy . Innym ważnym disacharydem jest laktoza występująca w mleku, składająca się z cząsteczki glukozy i cząsteczki galaktozy . Laktoza może być hydrolizowana przez laktazę , a niedobór tego enzymu powoduje nietolerancję laktozy .
Kiedy łączy się kilka (około trzech do sześciu) monosacharydów, nazywa się to oligosacharydem ( oligo - co oznacza „kilka”). Cząsteczki te są zwykle używane jako markery i sygnały , a także mają kilka innych zastosowań. Wiele połączonych monosacharydów tworzy polisacharyd . Mogą być połączone w jeden długi liniowy łańcuch lub mogą być rozgałęzione . Dwa najpowszechniejsze polisacharydy to celuloza i glikogen , oba składające się z powtarzających się monomerów glukozy . Celuloza jest ważnym składnikiem strukturalnym ścian komórkowych roślin, a glikogen jest wykorzystywany jako forma magazynowania energii u zwierząt.
Cukier można scharakteryzować poprzez posiadanie redukujących lub nieredukujących końcówek. Redukujący koniec węglowodanu to atom węgla, który może znajdować się w równowadze z aldehydem o otwartym łańcuchu ( aldoza ) lub formą ketonową ( ketoza ). Jeśli łączenie monomerów odbywa się przy takim atomie węgla, to wolna grupa hydroksylowa piranozy lub furanozy jest wymieniana na łańcuch boczny OH innego cukru, dając pełny acetal . Zapobiega to otwarciu łańcucha do formy aldehydowej lub ketonowej i sprawia, że zmodyfikowana reszta nie jest redukująca. Laktoza zawiera redukujący koniec na swoim ugrupowaniu glukozy, podczas gdy ugrupowanie galaktozy tworzy pełny acetal z grupą C4-OH glukozy. Sacharoza nie ma końca redukującego z powodu pełnego tworzenia acetalu między węglem aldehydowym glukozy (C1) a węglem ketonowym fruktozy (C2).
lipidy
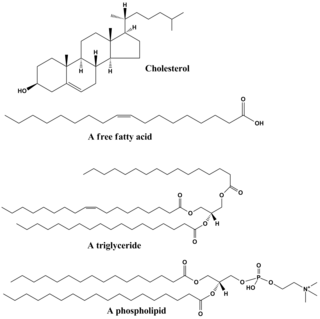
Lipidy obejmują różnorodne cząsteczki i do pewnego stopnia są zbiorem stosunkowo nierozpuszczalnych w wodzie lub niepolarnych związków pochodzenia biologicznego, w tym wosków , kwasów tłuszczowych , fosfolipidów pochodzących z kwasów tłuszczowych , sfingolipidów , glikolipidów i terpenoidów (np. ). Niektóre lipidy są liniowymi, alifatycznymi cząsteczkami o otwartym łańcuchu , podczas gdy inne mają strukturę pierścieniową. Niektóre są aromatyczne (z cykliczną [pierścieniową] i płaską [płaską] strukturą), podczas gdy inne nie. Niektóre są elastyczne, inne sztywne.
Lipidy są zwykle zbudowane z jednej cząsteczki glicerolu połączonej z innymi cząsteczkami. W trójglicerydach , głównej grupie lipidów objętościowych, znajduje się jedna cząsteczka glicerolu i trzy kwasy tłuszczowe . Kwasy tłuszczowe są w tym przypadku uważane za monomer i mogą być nasycone (brak wiązań podwójnych w łańcuchu węglowym) lub nienasycone (jedno lub więcej wiązań podwójnych w łańcuchu węglowym).
Większość lipidów ma charakter polarny , oprócz tego, że jest w dużej mierze niepolarna. Ogólnie rzecz biorąc, większość ich struktury jest niepolarna lub hydrofobowa („boi się wody”), co oznacza, że nie oddziałuje dobrze z polarnymi rozpuszczalnikami, takimi jak woda. Inna część ich struktury jest polarna lub hydrofilowa („lubiąca wodę”) i będzie miała tendencję do łączenia się z polarnymi rozpuszczalnikami, takimi jak woda. To czyni je amfifilowymi (posiadającymi zarówno część hydrofobową, jak i hydrofilową). W przypadku cholesterolu grupą polarną jest zwykły –OH (hydroksyl lub alkohol). W przypadku fosfolipidów grupy polarne są znacznie większe i bardziej polarne, jak opisano poniżej.
Lipidy są nieodłącznym elementem naszej codziennej diety. Większość olejów i produktów mlecznych , których używamy do gotowania i jedzenia, takich jak masło , ser , ghee itp., składa się z tłuszczów . Oleje roślinne są bogate w różne wielonienasycone kwasy tłuszczowe (PUFA). Pokarmy zawierające lipidy ulegają trawieniu w organizmie i rozkładają się na kwasy tłuszczowe i glicerol, które są końcowymi produktami degradacji tłuszczów i lipidów. Lipidy, zwłaszcza fosfolipidy , są również stosowane w różnych produktach farmaceutycznych , albo jako środki zwiększające rozpuszczalność (np. w infuzjach pozajelitowych), albo też jako składniki nośników leków (np. w liposomach lub transferosomach ).
Białka
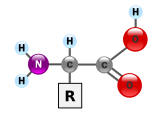
Białka to bardzo duże cząsteczki — makrobiopolimery — zbudowane z monomerów zwanych aminokwasami . Aminokwas składa się z atomu węgla alfa przyłączonego do aminowej , –NH 2 , grupy kwasu karboksylowego , –COOH (chociaż w warunkach fizjologicznych występują one jako –NH 3 + i –COO − ), prostego atomu wodoru i łańcuch boczny powszechnie oznaczany jako „–R”. Łańcuch boczny „R” jest inny dla każdego aminokwasu, którego jest 20 standardowych . To właśnie ta grupa „R” sprawiła, że każdy aminokwas był inny, a właściwości łańcuchów bocznych znacznie wpływają na ogólną trójwymiarową konformację białka. Niektóre aminokwasy pełnią funkcje samodzielnie lub w zmodyfikowanej formie; na przykład glutaminian działa jako ważny neuroprzekaźnik . Aminokwasy można łączyć za pomocą wiązania peptydowego . W tej odwodnienia cząsteczka wody jest usuwana, a wiązanie peptydowe łączy azot grupy aminowej jednego aminokwasu z węglem grupy kwasu karboksylowego drugiego. Powstała cząsteczka nazywana jest dipeptydem , a krótkie odcinki aminokwasów (zwykle mniej niż trzydzieści) nazywane są peptydami lub polipeptydami. Dłuższe odcinki zasługują na tytułowe białka . Na przykład ważna albumina białka surowicy krwi zawiera 585 reszt aminokwasowych.

Białka mogą pełnić role strukturalne i/lub funkcjonalne. Na przykład ruchy białek aktyny i miozyny są ostatecznie odpowiedzialne za skurcz mięśni szkieletowych. Jedną z właściwości wielu białek jest to, że specyficznie wiążą się z określoną cząsteczką lub klasą cząsteczek – mogą być niezwykle selektywne w tym, co wiążą. Przeciwciała są przykładem białek, które przyłączają się do jednego określonego typu cząsteczki. Przeciwciała składają się z łańcuchów ciężkich i lekkich. Dwa łańcuchy ciężkie byłyby połączone z dwoma łańcuchami lekkimi poprzez wiązania dwusiarczkowe między ich aminokwasami. Przeciwciała są specyficzne poprzez zmienność opartą na różnicach w domenie N-końcowej.
Test immunoenzymatyczny (ELISA), który wykorzystuje przeciwciała, jest jednym z najbardziej czułych testów stosowanych przez współczesną medycynę do wykrywania różnych biomolekuł. Prawdopodobnie najważniejszymi białkami są jednak enzymy . Praktycznie każda reakcja w żywej komórce wymaga enzymu obniżającego energię aktywacji reakcji. Cząsteczki te rozpoznają specyficzne cząsteczki reagentów zwane substratami ; następnie katalizują reakcję między nimi. Obniżając energię aktywacji , enzym przyspiesza tę reakcję o 10 11 lub więcej; reakcja, która normalnie zajęłaby ponad 3000 lat, aby zakończyć się spontanicznie, może zająć mniej niż sekundę z enzymem. Sam enzym nie jest zużywany w procesie i może katalizować tę samą reakcję z nowym zestawem substratów. Za pomocą różnych modyfikatorów można regulować aktywność enzymu, co umożliwia kontrolę biochemii komórki jako całości.
Struktura białek jest tradycyjnie opisana w hierarchii czterech poziomów. Pierwszorzędowa struktura białka składa się z liniowej sekwencji aminokwasów; na przykład „alanina-glicyna-tryptofan-seryna-glutaminian-asparagina-glicyna-lizyna-…”. Struktura drugorzędowa dotyczy morfologii lokalnej (morfologia jest badaniem struktury). Niektóre kombinacje aminokwasów będą miały tendencję do zwijania się w spiralę zwaną α-helisą lub w arkusz zwany arkuszem β ; niektóre α-helisy można zobaczyć na powyższym schemacie hemoglobiny. Struktura trzeciorzędowa to cały trójwymiarowy kształt białka. Ten kształt jest określony przez sekwencję aminokwasów. W rzeczywistości jedna zmiana może zmienić całą strukturę. Łańcuch alfa hemoglobiny zawiera 146 reszt aminokwasowych; zastąpienie glutaminianu w pozycji 6 resztą waliny zmienia zachowanie hemoglobiny tak bardzo, że powoduje anemię sierpowatokrwinkową . Wreszcie struktura czwartorzędowa dotyczy struktury białka z wieloma podjednostkami peptydowymi, takimi jak hemoglobina z czterema podjednostkami. Nie wszystkie białka mają więcej niż jedną podjednostkę.
Połknięte białka są zwykle rozkładane na pojedyncze aminokwasy lub dipeptydy w jelicie cienkim , a następnie wchłaniane. Następnie można je łączyć, tworząc nowe białka. Produkty pośrednie glikolizy, cyklu kwasu cytrynowego i szlaku pentozofosforanowego można wykorzystać do wytworzenia wszystkich dwudziestu aminokwasów, a większość bakterii i roślin posiada wszystkie niezbędne enzymy do ich syntezy. Jednak ludzie i inne ssaki mogą syntetyzować tylko połowę z nich. Nie mogą syntetyzować izoleucyny , leucyny , lizyny , metioniny , fenyloalaniny , treoniny , tryptofanu i waliny . Ponieważ muszą być spożywane, są to niezbędne aminokwasy . Ssaki posiadają enzymy do syntezy alaniny , asparaginy , asparaginianu , cysteiny , glutaminianu , glutaminy , glicyny , proliny , seryny i tyrozyny , aminokwasów nieistotnych. Chociaż mogą syntetyzować argininę i histydynę , nie są w stanie wyprodukować ich w ilościach wystarczających dla młodych, rosnących zwierząt, dlatego często są one uważane za niezbędne aminokwasy.
Jeśli grupa aminowa zostanie usunięta z aminokwasu, pozostawia szkielet węglowy zwany α- ketokwasem . Enzymy zwane transaminazami mogą z łatwością przenosić grupę aminową z jednego aminokwasu (czyniąc go α-ketokwasem) na inny α-ketokwas (czyniąc go aminokwasem). Jest to ważne w biosyntezie aminokwasów, ponieważ w przypadku wielu szlaków produkty pośrednie z innych szlaków biochemicznych są przekształcane w szkielet α-ketokwasowy, a następnie dodawana jest grupa aminowa, często poprzez transaminację . Aminokwasy można następnie połączyć ze sobą, tworząc białko.
Podobny proces jest stosowany do rozkładania białek. Najpierw jest hydrolizowany do aminokwasów składowych. Wolny amoniak (NH3), występujący we krwi jako jon amonowy (NH4+), jest toksyczny dla organizmów żywych. Dlatego musi istnieć odpowiednia metoda jego wydalania. Różne taktyki ewoluowały u różnych zwierząt, w zależności od potrzeb zwierząt. jednokomórkowe uwalniają amoniak do środowiska. Podobnie kościste ryby mogą uwalniać amoniak do wody, gdzie jest on szybko rozcieńczany. Ogólnie rzecz biorąc, ssaki przekształcają amoniak w mocznik w cyklu mocznikowym .
Aby ustalić, czy dwa białka są ze sobą spokrewnione, czyli innymi słowy, czy są one homologiczne, czy nie, naukowcy stosują metody porównywania sekwencji. Metody takie jak dopasowywanie sekwencji i dopasowywanie strukturalne są potężnymi narzędziami, które pomagają naukowcom zidentyfikować homologie między pokrewnymi cząsteczkami. Znaczenie znalezienia homologii między białkami wykracza poza tworzenie ewolucyjnego wzorca rodzin białek . Odkrywając, jak podobne są dwie sekwencje białek, zdobywamy wiedzę na temat ich struktury, a tym samym ich funkcji.
Kwasy nukleinowe

Kwasy nukleinowe , zwane tak ze względu na ich rozpowszechnienie w jądrach komórkowych , to ogólna nazwa rodziny biopolimerów. Są to złożone biochemiczne makrocząsteczki o dużej masie cząsteczkowej, które mogą przenosić informacje genetyczne we wszystkich żywych komórkach i wirusach. Monomery nazywane są nukleotydami i każdy składa się z trzech składników: azotowej zasady heterocyklicznej ( puryny lub pirymidyny ), cukru pentozowego i grupy fosforanowej .
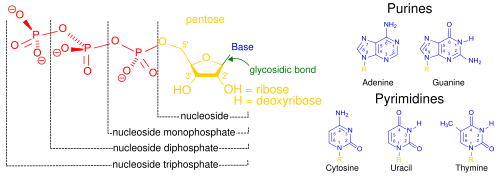
Najbardziej powszechnymi kwasami nukleinowymi są kwas dezoksyrybonukleinowy (DNA) i kwas rybonukleinowy (RNA). Grupa fosforanowa i cukier każdego nukleotydu wiążą się ze sobą, tworząc szkielet kwasu nukleinowego, podczas gdy sekwencja zasad azotowych przechowuje informacje. Najbardziej powszechnymi zasadami azotowymi są adenina , cytozyna , guanina , tymina i uracyl . Zasady azotowe każdej nici kwasu nukleinowego utworzą wiązania wodorowe z pewnymi innymi zasadami azotowymi w komplementarnej nici kwasu nukleinowego (podobnie jak suwak). Adenina wiąże się z tyminą i uracylem, tymina tylko z adeniną, a cytozyna i guanina mogą wiązać się tylko ze sobą. Adenina i tymina oraz adenina i uracyl zawierają dwa wiązania wodorowe, podczas gdy wiązania wodorowe utworzone między cytozyną i guaniną są trzy.
Oprócz materiału genetycznego komórki, kwasy nukleinowe często pełnią rolę wtórnych przekaźników , a także tworzą podstawową cząsteczkę trifosforanu adenozyny (ATP), cząsteczki głównego nośnika energii występującej we wszystkich żywych organizmach. Również możliwe zasady azotowe w dwóch kwasach nukleinowych są różne: adenina, cytozyna i guanina występują zarówno w RNA, jak i DNA, podczas gdy tymina występuje tylko w DNA, a uracyl występuje w RNA.
Metabolizm
Węglowodany jako źródło energii
Glukoza jest źródłem energii w większości form życia. Na przykład polisacharydy są rozkładane na monomery przez enzymy ( fosforylaza glikogenu usuwa reszty glukozy z glikogenu, polisacharydu). Disacharydy, takie jak laktoza lub sacharoza, są rozszczepiane na dwuskładnikowe monosacharydy.
Glikoliza (beztlenowa)
|
|
Glukoza jest metabolizowana głównie przez bardzo ważny dziesięcioetapowy szlak zwany glikolizą , którego wynikiem netto jest rozbicie jednej cząsteczki glukozy na dwie cząsteczki pirogronianu . Powoduje to również powstanie dwóch molekuł netto ATP , waluty energetycznej komórek, wraz z dwoma redukującymi równoważnikami konwersji NAD + (dinukleotyd nikotynoamidoadeninowy: forma utleniona) do NADH (dinukleotyd nikotynoamidoadeninowy: forma zredukowana). To nie wymaga tlenu; jeśli tlen nie jest dostępny (lub komórka nie może używać tlenu), NAD jest przywracany przez przekształcenie pirogronianu w mleczan (kwas mlekowy) (np. u ludzi) lub w etanol z dwutlenkiem węgla (np. w drożdżach ). Inne monosacharydy, takie jak galaktoza i fruktoza, można przekształcić w półprodukty szlaku glikolitycznego.
Aerobik
W komórkach tlenowych z wystarczającą ilością tlenu, jak w większości komórek ludzkich, pirogronian jest dalej metabolizowany. Jest nieodwracalnie przekształcany w acetylo-CoA , wydzielając jeden atom węgla jako produkt odpadowy, dwutlenek węgla , generując kolejny redukujący równoważnik jako NADH . Dwie cząsteczki acetylo-CoA (z jednej cząsteczki glukozy) wchodzą następnie w cykl kwasu cytrynowego , wytwarzając dwie cząsteczki ATP, sześć kolejnych cząsteczek NADH i dwa zredukowane (ubi)chinony (poprzez FADH 2 jako kofaktor związany z enzymem) i uwalniając pozostałe atomy węgla jako dwutlenek węgla. Wytworzone cząsteczki NADH i chinolu są następnie wprowadzane do kompleksów enzymatycznych łańcucha oddechowego, systemu transportu elektronów przenoszącego ostatecznie elektrony do tlenu i zachowującego uwolnioną energię w postaci gradientu protonów na membranie ( wewnętrznej błonie mitochondrialnej u eukariontów). W ten sposób tlen jest redukowany do wody i pierwotne akceptory elektronów NAD + i chinon są regenerowane. Dlatego ludzie wdychają tlen i wydychają dwutlenek węgla. Energia uwolniona podczas przenoszenia elektronów ze stanów wysokoenergetycznych w NADH i chinolu jest najpierw zachowywana jako gradient protonów i przekształcana w ATP przez syntazę ATP. To generuje dodatkowe 28 cząsteczek ATP (24 z 8 NADH + 4 z 2 chinoli), w sumie 32 cząsteczki ATP konserwowane na zdegradowaną glukozę (dwie z glikolizy + dwie z cyklu cytrynianowego). Oczywiste jest, że użycie tlenu do całkowitego utlenienia glukozy dostarcza organizmowi znacznie więcej energii niż jakakolwiek niezależna od tlenu funkcja metaboliczna i uważa się, że to jest powód, dla którego złożone życie pojawiło się dopiero po nagromadzeniu dużych ilości tlenu w atmosferze ziemskiej.
glukoneogeneza
U kręgowców energicznie kurczące się mięśnie szkieletowe (na przykład podczas podnoszenia ciężarów lub sprintu) nie otrzymują wystarczającej ilości tlenu, aby zaspokoić zapotrzebowanie na energię, dlatego przechodzą na metabolizm beztlenowy , przekształcając glukozę w mleczan. Połączenie glukozy pochodzenia niewęglowodanowego, takiego jak tłuszcz i białko. Dzieje się tak tylko wtedy, gdy glikogenu w wątrobie są zużyte. Szlak jest kluczowym odwróceniem glikolizy z pirogronianu do glukozy i może wykorzystywać wiele źródeł, takich jak aminokwasy, glicerol i cykl Krebsa . Katabolizm białek i tłuszczów na dużą skalę zwykle występuje, gdy osoby cierpią z powodu głodu lub pewnych zaburzeń endokrynologicznych. Wątroba regeneruje glukozę w procesie zwanym glukoneogenezą . Ten proces nie jest całkowitym przeciwieństwem glikolizy i faktycznie wymaga trzykrotnie większej ilości energii uzyskanej z glikolizy (zużywa się sześć cząsteczek ATP, w porównaniu do dwóch uzyskanych w glikolizie). Analogicznie do powyższych reakcji, wytworzona glukoza może następnie ulegać glikolizie w tkankach potrzebujących energii, być magazynowana jako glikogen (lub skrobia w roślinach) lub być przekształcana w inne monosacharydy lub łączona w di- lub oligosacharydy. Połączone szlaki glikolizy podczas ćwiczeń, przejście mleczanu przez krwiobieg do wątroby, późniejsza glukoneogeneza i uwolnienie glukozy do krwioobiegu nazywane są cyklem Cori .
Stosunek do innych nauk biologicznych „w skali molekularnej”.
Naukowcy zajmujący się biochemią wykorzystują specyficzne techniki pochodzące z biochemii, ale coraz częściej łączą je z technikami i pomysłami opracowanymi w dziedzinie genetyki , biologii molekularnej i biofizyki . Nie ma określonej granicy między tymi dyscyplinami. Biochemia bada chemię wymaganą do biologicznej aktywności cząsteczek, biologia molekularna bada ich aktywność biologiczną, genetyka bada ich dziedziczność, która jest przenoszona przez ich genom . Jest to pokazane na poniższym schemacie, który przedstawia jeden z możliwych widoków relacji między polami:
- Biochemia to nauka o substancjach chemicznych i procesach życiowych zachodzących w żywych organizmach . Biochemicy koncentrują się głównie na roli, funkcji i strukturze biomolekuł . Badanie chemii stojącej za procesami biologicznymi i synteza biologicznie aktywnych cząsteczek to zastosowania biochemii. Biochemia bada życie na poziomie atomowym i molekularnym.
- Genetyka to nauka o wpływie różnic genetycznych na organizmy. Można to często wywnioskować na podstawie braku normalnego składnika (np. jednego genu ). Badanie „ mutantów ” – organizmów pozbawionych jednego lub więcej składników funkcjonalnych w odniesieniu do tak zwanego „ typu dzikiego ” lub normalnego fenotypu . Interakcje genetyczne ( epistaza ) mogą często utrudniać proste interpretacje takich badań „ nokautowych ”.
- Biologia molekularna to badanie molekularnych podstaw zjawisk biologicznych, koncentrujące się na syntezie molekularnej, modyfikacjach, mechanizmach i interakcjach. Centralny dogmat biologii molekularnej , zgodnie z którym materiał genetyczny jest przepisywany na RNA, a następnie tłumaczony na białko , mimo że jest nadmiernie uproszczony, nadal stanowi dobry punkt wyjścia do zrozumienia tej dziedziny. Koncepcja ta została zrewidowana w świetle pojawiających się nowych ról RNA .
- Biologia chemiczna dąży do opracowania nowych narzędzi opartych na małych cząsteczkach , które pozwolą na minimalne zakłócenie systemów biologicznych, dostarczając jednocześnie szczegółowych informacji o ich funkcji. Ponadto biologia chemiczna wykorzystuje systemy biologiczne do tworzenia nienaturalnych hybryd między biomolekułami i urządzeniami syntetycznymi (na przykład opróżnionymi kapsydami wirusowymi , które mogą dostarczać terapię genową lub cząsteczki leków ).
Zobacz też
Listy
Zobacz też
- Astrobiologia
- Biochemia (czasopismo)
- Chemia biologiczna (czasopismo)
- Biofizyka
- Ekologia chemiczna
- Biomodelowanie obliczeniowe
- Dedykowana biologiczna substancja chemiczna
- numer WE
- Hipotetyczne typy biochemii
- Międzynarodowa Unia Biochemii i Biologii Molekularnej
- Metabolom
- Metabolomika
- Biologia molekularna
- Medycyna molekularna
- Biochemia roślin
- Proteoliza
- Mała cząsteczka
- Biologia strukturalna
- Cykl TCA
Notatki
A. ^ Fruktoza nie jest jedynym cukrem występującym w owocach. Glukoza i sacharoza występują również w różnych ilościach w różnych owocach, a czasami przewyższają obecną fruktozę. Na przykład 32% jadalnej części daktyli to glukoza, w porównaniu z 24% fruktozy i 8% sacharozy. Jednak brzoskwinie zawierają więcej sacharozy (6,66%) niż fruktozy (0,93%) lub glukozy (1,47%).
Cytowana literatura
- Amsler, Mark (1986). Języki kreatywności: modele, rozwiązywanie problemów, dyskurs . Wydawnictwo Uniwersytetu Delaware. ISBN 978-0-87413-280-9 .
- Astbury, WT (1961). „Biologia molekularna czy biologia ultrastrukturalna?” . Natura . 190 (4781): 1124. Bibcode : 1961Natur.190.1124A . doi : 10.1038/1901124a0 . PMID 13684868 . S2CID 4172248 .
- Ben-Menachem, Ari (2009). Historyczna encyklopedia nauk przyrodniczych i matematycznych . Historyczna encyklopedia nauk przyrodniczych i matematycznych autorstwa Ari Ben-Menahema. Berlin: Springer . Skoczek. P. 2982. Bibcode : 2009henm.book.....B . ISBN 978-3-540-68831-0 .
- Burton, Feldman (2001). Nagroda Nobla: historia geniuszu, kontrowersji i prestiżu . Wydawnictwo Arcade. ISBN 978-1-55970-592-9 .
- Butler, John M. (2009). Podstawy kryminalistycznego typowania DNA . Prasa akademicka. ISBN 978-0-08-096176-7 .
- Sen, Chandan K.; Roy, Sashwati (2007). „MiRNA: Licencja na zabicie posłańca” . Biologia DNA i komórki . 26 (4): 193–194. doi : 10.1089/dna.2006.0567 . PMID 17465885 . S2CID 10665411 .
- Clarence, Peter Berg (1980). University of Iowa i biochemia od ich początków . ISBN 978-0-87414-014-9 .
- Edwards, Karen J.; Brązowy, David G.; Spink, Neil; Skelly, Jane V.; Neidle, Stephen (1992). „Struktura molekularna dodekameru B-DNA d (CGCAAATTTGCG) 2 badanie skręcenia śruby napędowej i struktury wody z mniejszymi rowkami przy rozdzielczości 2,2 A”. Dziennik biologii molekularnej . 226 (4): 1161–1173. doi : 10.1016/0022-2836(92)91059-x . PMID 1518049 .
- Eldra P. Solomon; Linda R. Berg; Diana W. Martin (2007). Biologia, wydanie 8., wydanie międzynarodowe dla studentów . Thomsona Brooksa/Cole'a. ISBN 978-0-495-31714-2 . Zarchiwizowane od oryginału w dniu 2016-03-04.
- Fariselli, P.; Rossi, I.; Capriotti, E.; Casadio, R. (2006). „WWH zdalnego wykrywania homologów: stan techniki” . Odprawy z bioinformatyki . 8 (2): 78–87. doi : 10.1093/bib/bbl032 . PMID 17003074 .
- Fiske, Jan (1890). Zarysy filozofii kosmicznej opartej na doktrynach ewolucji, z krytyką filozofii pozytywnej, tom 1 . Boston i Nowy Jork: Houghton, Mifflin . Źródło 16 lutego 2015 r .
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). Ilustrowane recenzje Lippincotta: Farmakologia (wyd. 4). Lippincott Williams & Wilkins. ISBN 978-0-7817-7155-9 .
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). Niezbędne geny . Wydawcy Jones & Bartlett. ISBN 978-1-4496-1265-8 .
- Fromm, Herbert J.; Hargrove, Mark (2012). Podstawy biochemii . Skoczek. ISBN 978-3-642-19623-2 .
- Hamblin, Jakub Darwin (2005). Nauka na początku XX wieku: encyklopedia . ABC-CLIO. ISBN 978-1-85109-665-7 .
- Helvoort, Ton van (2000). Arne Hessenbruch (red.). Przewodnik czytelnika po historii nauki . Wydawnictwo Fitzroy Dearborn. ISBN 978-1-884964-29-9 .
- Holmes, Frederic Lawrence (1987). Lavoisier i chemia życia: badanie twórczości naukowej . Wydawnictwo Uniwersytetu Wisconsin. ISBN 978-0-299-09984-8 .
- Horton, Derek, wyd. (2013). Postępy w chemii i biochemii węglowodanów, tom 70 . Prasa akademicka. ISBN 978-0-12-408112-3 .
- Hunter, Graeme K. (2000). Siły witalne: odkrycie molekularnych podstaw życia . Prasa akademicka. ISBN 978-0-12-361811-5 .
- Karp, Gerald (2009). Biologia komórkowa i molekularna: koncepcje i eksperymenty . John Wiley & Synowie. ISBN 978-0-470-48337-4 .
- Kauffman, George B.; Chooljian, Steven H. (2001). „Friedrich Wöhler (1800–1882) w dwusetną rocznicę jego urodzin”. Pedagog Chemiczny . 6 (2): 121–133. doi : 10.1007/s00897010444a . S2CID 93425404 .
- Kleinkauf, Horst; Döhren, Hans von; Jaenicke Lothar (1988). Korzenie współczesnej biochemii: zawijas Fritza Lippmanna i jego konsekwencje . Walter de Gruyter & Co. 116. ISBN 978-3-11-085245-5 .
- Knowles, JR (1980). „Reakcje przeniesienia fosforylu katalizowane enzymami”. Roczny przegląd biochemii . 49 : 877–919. doi : 10.1146/annurev.bi.49.070180.004305 . PMID 6250450 . S2CID 7452392 .
- Metzlera, Davida Everetta; Metzler, Carol M. (2001). Biochemia: reakcje chemiczne żywych komórek . Tom. 1. Prasa akademicka. ISBN 978-0-12-492540-3 .
- Miller G.; Spoolman Scott (2012). Nauki o środowisku — różnorodność biologiczna jest kluczowym elementem kapitału naturalnego Ziemi . Nauka Cengage'a . ISBN 978-1-133-70787-5 . Źródło 2016-01-04 .
- Nielsen, Forrest H. (1999). „Ultraśladowe minerały”. W Maurice E. Shils; i in. (red.). Nowoczesne żywienie w zdrowiu i chorobie . Baltimore: Williams & Wilkins. s. 283–303. hdl : 10113/46493 .
- Peet, Alisa (2012). Znaki, Allan; Lieberman Michael A. (red.). Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) (wyd. 4). ISBN 978-1-60831-572-7 .
- Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (2005). Kobiety w chemii: ich zmieniające się role od czasów alchemicznych do połowy XX wieku . Fundacja Dziedzictwa Chemicznego. ISBN 978-0-941901-27-7 .
- Rojas-Ruiz, Fernando A.; Vargas-Méndez, Leonor Y.; Kouzniecow, Władimir W. (2011). „Wyzwania i perspektywy biologii chemicznej, udanej multidyscyplinarnej dziedziny nauk przyrodniczych” . Cząsteczki . 16 (3): 2672–2687. doi : 10,3390/molekuły16032672 . PMC 6259834 . PMID 21441869 .
- Saenger, Wolfram (1984). Zasady struktury kwasu nukleinowego . Nowy Jork: Springer-Verlag. ISBN 978-0-387-90762-8 .
- Slabaugh, Michael R.; Seager, Spencer L. (2013). Organic and Biochemistry for Today (wyd. 6). Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0 .
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). Fizjologia zwierząt: od genów do organizmów . Nauka Cengage'a. ISBN 978-0-8400-6865-1 .
- Stryer L, Berg JM, Tymoczko JL (2007). Biochemia (wyd. 6). San Francisco: WH Freeman. ISBN 978-0-7167-8724-2 .
- Tropp, Burton E. (2012). Biologia molekularna (wyd. 4). Nauka Jonesa i Bartletta. ISBN 978-1-4496-0091-4 .
- UNICEF (2010). Fakty na całe życie (PDF) (wyd. 4). Nowy Jork: Fundusz Narodów Zjednoczonych na rzecz Dzieci. ISBN 978-92-806-4466-1 . Zarchiwizowane (PDF) od oryginału w dniu 09.10.2022.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). „Kiedy jeden jest lepszy niż dwa: RNA o podwójnych funkcjach” (PDF) . Biochimie . 93 (4): 633–644. doi : 10.1016/j.biochi.2010.11.004 . PMID 21111023 . S2CID 22165949 . Zarchiwizowane (PDF) od oryginału w dniu 09.10.2022.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Podstawy glikobiologii . Prasa laboratoryjna Cold Spring Harbor. ISBN 978-0-87969-560-6 .
- Voet, D; Voet, JG (2005). Biochemia (wyd. 3). Hoboken, NJ: John Wiley & Sons Inc. ISBN 978-0-471-19350-0 . Zarchiwizowane od oryginału w dniu 11 września 2007 r.
- Whiting, GC (1970). „cukry” . W AC Hulme (red.). Biochemia owoców i ich produktów . Tom. 1. Londyn i Nowy Jork: Academic Press. ISBN 978-0-12-361201-4 .
- Ziesak, Anne-Katrin; Wkuć Hansa-Roberta (1999). Wydawcy Walter de Gruyter, 1749–1999 . Walter de Gruyter & Co. ISBN 978-3-11-016741-2 .
- Ashcroft, Steve. „Profesor Sir Philip Randle; Badacz metabolizmu: [wydanie 1]” . niezależny . ProQuest 311080685 .
Dalsza lektura
- Fruton, Joseph S. Białka, enzymy, geny: wzajemne oddziaływanie chemii i biologii . Yale University Press: New Haven, 1999. ISBN 0-300-07608-8
- Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis i Alexander Johnson, Biologia molekularna komórki
- Wydanie 4, Routledge, marzec 2002, twarda oprawa, 1616 str. ISBN 0-8153-3218-1
- Wydanie 3, Garland, 1994, ISBN 0-8153-1620-8
- Wydanie drugie, Garland, 1989, ISBN 0-8240-3695-6
- Koler, Robert. Od chemii medycznej do biochemii: tworzenie dyscypliny biomedycznej . Cambridge University Press, 1982.
- Maggio, Lauren A.; Willinsky, John M.; Steinberg, Ryan M.; Mietchen, Daniel; Wass, Józef L.; Dong Ting (2017). „Wikipedia jako brama do badań biomedycznych: względna dystrybucja i wykorzystanie cytatów w angielskiej Wikipedii” . PLOS JEDEN . 12 (12): e0190046. Bibcode : 2017PLoSO..1290046M . doi : 10.1371/journal.pone.0190046 . PMC 5739466 . PMID 29267345 .
Linki zewnętrzne
|
Zasoby biblioteczne dotyczące biochemii |
- „Towarzystwo Biochemiczne” .
- Wirtualna biblioteka biochemii, biologii molekularnej i biologii komórki
- Biochemia, wyd. 5. Pełny tekst Berga, Tymoczki i Stryera, dzięki uprzejmości NCBI .
- SystemsX.ch – Szwajcarska inicjatywa w dziedzinie biologii systemów
- Pełny tekst Biochemii autorstwa Kevina i Indiry, wprowadzającego podręcznika biochemii.