Inżynieria genetyczna
 |
| Część serii poświęconej |
| inżynierii genetycznej |
|---|
| Organizmy zmodyfikowane genetycznie |
| Historia i przepisy |
| Proces |
| Aplikacje |
| Kontrowersje |
Inżynieria genetyczna , zwana także modyfikacją genetyczną lub manipulacją genetyczną , to modyfikacja i manipulacja genami organizmu za pomocą technologii . Jest to zestaw technologii wykorzystywanych do zmiany składu genetycznego komórek, w tym przenoszenia genów w granicach gatunku i poza nim w celu wytworzenia ulepszonych lub nowych organizmów . Nowe DNA uzyskuje się albo poprzez izolację i kopiowanie materiału genetycznego będącego przedmiotem zainteresowania przy użyciu metod rekombinacji DNA , albo poprzez sztuczną syntezę DNA. Konstrukt do wstawiania tego DNA do organizmu gospodarza. Pierwsza cząsteczka rekombinowanego DNA została stworzona przez Paula Berga w 1972 roku przez połączenie DNA wirusa małpiego SV40 z wirusem lambda . Oprócz wstawiania genów , proces ten może służyć do usuwania lub „ wybijania ” genów. Nowe DNA można wstawić losowo lub skierować do określonej części genomu .
Organizm powstały w wyniku inżynierii genetycznej jest uważany za organizm zmodyfikowany genetycznie (GM), a powstała w ten sposób jednostka jest organizmem zmodyfikowanym genetycznie (GMO). Pierwszym GMO była bakteria wytworzona przez Herberta Boyera i Stanleya Cohena w 1973 r. Rudolf Jaenisch stworzył pierwsze GM zwierzę, wprowadzając obce DNA do myszy w 1974 r. Pierwsza firma skupiająca się na inżynierii genetycznej, Genentech , została założona w 1976 r. rozpoczął produkcję ludzkich białek. Genetycznie zmodyfikowana insulina ludzka została wyprodukowana w 1978 r., A bakterie wytwarzające insulinę zostały wprowadzone na rynek w 1982 r. Żywność modyfikowana genetycznie jest sprzedawana od 1994 r., Wraz z wypuszczeniem na rynek pomidora Flavr Savr . Flavr Savr został zaprojektowany tak, aby miał dłuższy okres przydatności do spożycia, ale większość obecnych upraw GM jest modyfikowana w celu zwiększenia odporności na owady i herbicydy. GloFish , pierwszy GMO zaprojektowany jako zwierzę domowe, został sprzedany w Stanach Zjednoczonych w grudniu 2003 roku. W 2016 roku sprzedano łososia modyfikowanego hormonem wzrostu.
Inżynieria genetyczna znalazła zastosowanie w wielu dziedzinach, w tym w badaniach naukowych, medycynie, biotechnologii przemysłowej i rolnictwie. W badaniach GMO są wykorzystywane do badania funkcji i ekspresji genów poprzez utratę funkcji, wzmocnienie funkcji, śledzenie i eksperymenty z ekspresją. Poprzez wyeliminowanie genów odpowiedzialnych za określone schorzenia możliwe jest stworzenie zwierzęcych organizmów modelowych chorób człowieka. Oprócz produkcji hormonów, szczepionek i innych leków, inżynieria genetyczna może potencjalnie leczyć choroby genetyczne poprzez terapię genową . Te same techniki, które są wykorzystywane do produkcji leków, mogą mieć również zastosowania przemysłowe, takie jak wytwarzanie enzymów do detergentów do prania, serów i innych produktów.
Rozwój skomercjalizowanych upraw genetycznie modyfikowanych przyniósł korzyści ekonomiczne rolnikom w wielu różnych krajach, ale był również źródłem większości kontrowersji wokół tej technologii. Jest to obecne od jego wczesnego użycia; pierwsze próby terenowe zostały zniszczone przez działaczy anty-GM. Chociaż istnieje naukowy konsensus , że obecnie dostępna żywność pochodząca z upraw GM nie stanowi większego zagrożenia dla zdrowia ludzkiego niż żywność konwencjonalna, krytycy uważają, że bezpieczeństwo żywności GM jest głównym problemem. Jako potencjalne problemy wymieniono również przepływ genów , wpływ na organizmy inne niż docelowe, kontrolę dostaw żywności i prawa własności intelektualnej . Obawy te doprowadziły do opracowania ram regulacyjnych, które rozpoczęto w 1975 r. Doprowadziło to do międzynarodowego traktatu, Protokołu kartageńskiego o bezpieczeństwie biologicznym , który został przyjęty w 2000 r. Poszczególne kraje opracowały własne systemy regulacyjne dotyczące GMO, z najbardziej wyraźne różnice występujące między Stanami Zjednoczonymi a Europą.
Inżynieria genetyczna : Proces wprowadzania nowej informacji genetycznej do istniejących komórek w celu zmodyfikowania określonego organizmu w celu zmiany jego cech.
Uwaga : Zaadaptowano z ref.
Przegląd
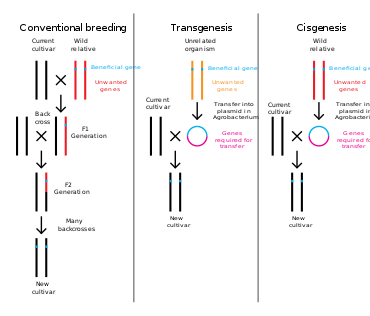
Inżynieria genetyczna to proces, który zmienia strukturę genetyczną organizmu poprzez usunięcie lub wprowadzenie DNA lub modyfikację istniejącego materiału genetycznego in situ. W przeciwieństwie do tradycyjnej zwierząt i roślin , która polega na wielokrotnym krzyżowaniu, a następnie selekcji organizmu o pożądanym fenotypie , inżynieria genetyczna pobiera gen bezpośrednio z jednego organizmu i dostarcza go drugiemu. Jest to znacznie szybsze, można go użyć do wstawienia dowolnych genów z dowolnego organizmu (nawet z różnych domen ) i zapobiega dodaniu innych niepożądanych genów.
Inżynieria genetyczna może potencjalnie naprawić poważne zaburzenia genetyczne u ludzi poprzez zastąpienie wadliwego genu funkcjonującym. Jest to ważne narzędzie w badaniach, które pozwala na badanie funkcji określonych genów. Leki, szczepionki i inne produkty zostały zebrane z organizmów zaprojektowanych do ich produkcji. Opracowano uprawy , które zwiększają bezpieczeństwo żywnościowe poprzez zwiększanie plonów, wartości odżywczych i tolerancji na stres środowiskowy.
DNA można wprowadzić bezpośrednio do organizmu gospodarza lub do komórki, która jest następnie poddawana fuzji lub hybrydyzacji z gospodarzem. Opiera się to na rekombinacji kwasów nukleinowych w celu utworzenia nowych kombinacji dziedzicznego materiału genetycznego, a następnie włączenia tego materiału albo pośrednio przez system wektorów , albo bezpośrednio poprzez mikroiniekcję , makroiniekcję lub mikrokapsułkowanie .
Inżynieria genetyczna zwykle nie obejmuje tradycyjnej hodowli, zapłodnienia in vitro , indukcji poliploidalności , mutagenezy i technik fuzji komórek, które nie wykorzystują w tym procesie rekombinowanych kwasów nukleinowych ani organizmów zmodyfikowanych genetycznie. Jednak niektóre szerokie definicje inżynierii genetycznej obejmują hodowlę selektywną . Klonowanie i badania nad komórkami macierzystymi , chociaż nie są uważane za inżynierię genetyczną, są ze sobą ściśle powiązane i można w nich stosować inżynierię genetyczną. Biologia syntetyczna to wschodząca dyscyplina, która idzie o krok dalej w inżynierii genetycznej, wprowadzając sztucznie zsyntetyzowany materiał do organizmu.
Rośliny, zwierzęta lub mikroorganizmy, które zostały zmienione za pomocą inżynierii genetycznej, nazywane są organizmami zmodyfikowanymi genetycznie lub GMO. Jeśli do żywiciela zostanie dodany materiał genetyczny innego gatunku, powstały organizm nazywany jest transgenicznym . Jeśli używany jest materiał genetyczny z tego samego gatunku lub gatunku, który może naturalnie rozmnażać się z żywicielem, powstały organizm nazywany jest cisgenicznym . Jeśli inżynieria genetyczna jest stosowana do usuwania materiału genetycznego z organizmu docelowego, powstały organizm jest określany jako znokautowany . W Europie modyfikacja genetyczna jest synonimem inżynierii genetycznej, podczas gdy w Stanach Zjednoczonych Ameryki i Kanadzie modyfikacja genetyczna może być również stosowana w odniesieniu do bardziej konwencjonalnych metod hodowlanych.
Historia
Ludzie zmieniali genomy gatunków przez tysiące lat poprzez selektywną hodowlę lub dobór sztuczny, w przeciwieństwie do doboru naturalnego . Niedawno hodowla mutacyjna wykorzystywała ekspozycję na chemikalia lub promieniowanie w celu wytworzenia dużej częstotliwości przypadkowych mutacji do celów hodowli selektywnej. Inżynieria genetyczna jako bezpośrednia manipulacja DNA przez ludzi poza hodowlą i mutacjami istnieje dopiero od lat 70. XX wieku. Termin „inżynieria genetyczna” został po raz pierwszy ukuty przez Jacka Williamsona w jego powieści science fiction Dragon's Island , opublikowanej w 1951 roku – rok przed potwierdzeniem roli DNA w dziedziczeniu przez Alfreda Hersheya i Martha Chase oraz dwa lata przed wykazaniem przez Jamesa Watsona i Francisa Cricka że cząsteczka DNA ma strukturę podwójnej helisy - chociaż ogólna koncepcja bezpośredniej manipulacji genetycznej została zbadana w podstawowej formie w opowiadaniu science fiction Proteus Island z 1936 roku autorstwa Stanleya G. Weinbauma .
W 1972 roku Paul Berg stworzył pierwsze rekombinowane cząsteczki DNA, łącząc DNA małpiego wirusa SV40 z wirusem lambda . W 1973 roku Herbert Boyer i Stanley Cohen stworzyli pierwszy organizm transgeniczny , wprowadzając geny oporności na antybiotyki do plazmidu bakterii Escherichia coli . Rok później Rudolf Jaenisch stworzył transgeniczną mysz , wprowadzając obce DNA do jej zarodka, czyniąc ją pierwszym na świecie zwierzęciem transgenicznym . w 1975 r. Jednym z głównych zaleceń z tego spotkania było ustanowienie rządowego nadzoru nad badaniami nad rekombinowanym DNA, dopóki technologia nie zostanie uznana za bezpieczną.
Robert Swanson założyli Genentech, pierwszą firmę zajmującą się inżynierią genetyczną, a rok później firma wyprodukowała ludzkie białko ( somatostatynę ) w E. coli . Genentech ogłosił produkcję genetycznie zmodyfikowanej insuliny ludzkiej w 1978 roku. W 1980 roku Sąd Najwyższy Stanów Zjednoczonych w sprawie Diamond przeciwko Chakrabarty orzekł, że genetycznie zmienione życie może zostać opatentowane. Insulina wytwarzana przez bakterie została dopuszczona do obrotu przez Food and Drug Administration (FDA) w 1982 roku.
W 1983 roku firma biotechnologiczna Advanced Genetic Sciences (AGS) wystąpiła o zezwolenie rządu Stanów Zjednoczonych na przeprowadzenie testów polowych ze szczepem Pseudomonas syringae pozbawionym lodu w celu ochrony upraw przed mrozem, ale organizacje ekologiczne i protestujący opóźnili testy polowe o cztery lata z powodu wyzwania prawne. W 1987 r. szczep P. syringae pozbawiony lodu stał się pierwszym genetycznie zmodyfikowanym organizmem (GMO), który został uwolniony do środowiska, kiedy opryskano nim pole truskawek i pole ziemniaków w Kalifornii. Oba pola testowe zostały zaatakowane przez grupy aktywistów w noc poprzedzającą testy: „Pierwsze na świecie miejsce próbne przyciągnęło pierwszego na świecie śmieciarza”.
Pierwsze próby polowe genetycznie zmodyfikowanych roślin miały miejsce we Francji i Stanach Zjednoczonych w 1986 r. Rośliny tytoniu zostały zmodyfikowane tak, aby były odporne na herbicydy . Chińska Republika Ludowa była pierwszym krajem, który skomercjalizował rośliny transgeniczne, wprowadzając tytoń odporny na wirusy w 1992 r. W 1994 r. Calgene uzyskał zgodę na komercyjne wypuszczenie pierwszej genetycznie zmodyfikowanej żywności , Flavr Savr , pomidora opracowanego tak, aby miał dłuższy okres przydatności do spożycia . W 1994 roku Unia Europejska zatwierdziła zmodyfikowany tytoń jako odporny na herbicyd bromoksynil , co czyni go pierwszą genetycznie zmodyfikowaną uprawą skomercjalizowaną w Europie. W 1995 roku ziemniak Bt został zatwierdzony jako bezpieczny przez Agencję Ochrony Środowiska , po zatwierdzeniu przez FDA, co czyni go pierwszą uprawą produkującą pestycydy, która została zatwierdzona w USA. W 2009 r. 11 roślin transgenicznych uprawiano komercyjnie w 25 krajach, z których największe pod względem obszaru uprawy to Stany Zjednoczone, Brazylia, Argentyna, Indie, Kanada, Chiny, Paragwaj i Republika Południowej Afryki.
W 2010 roku naukowcy z Instytutu J. Craiga Ventera stworzyli pierwszy syntetyczny genom i wprowadzili go do pustej komórki bakteryjnej. Powstała bakteria, nazwana laboratorium Mycoplasma , mogła replikować i wytwarzać białka. Cztery lata później posunięto się o krok dalej, gdy opracowano bakterię, która replikowała plazmid zawierający unikalną parę zasad , tworząc pierwszy organizm zmodyfikowany tak, aby używał rozszerzonego alfabetu genetycznego. W 2012 roku Jennifer Doudna i Emmanuelle Charpentier wspólnie opracowały system CRISPR/Cas9 , technikę, której można użyć do łatwej i specyficznej zmiany genomu prawie każdego organizmu.
Proces
Tworzenie GMO to proces wieloetapowy. Inżynierowie genetyczni muszą najpierw wybrać, jaki gen chcą wprowadzić do organizmu. Jest to spowodowane tym, jaki jest cel dla powstałego organizmu i opiera się na wcześniejszych badaniach. Można przeprowadzić badania genetyczne w celu określenia potencjalnych genów, a następnie zastosować dalsze testy w celu zidentyfikowania najlepszych kandydatów. Rozwój mikromacierzy , transkryptomiki i sekwencjonowania genomu znacznie ułatwił znalezienie odpowiednich genów. Szczęście również odgrywa swoją rolę; gen Roundup Ready został odkryty po tym, jak naukowcy zauważyli bakterię prosperującą w obecności herbicydu.
Izolacja i klonowanie genów
Następnym krokiem jest wyizolowanie genu kandydującego. Komórka zawierająca gen jest otwierana i DNA jest oczyszczane. Gen jest rozdzielany przy użyciu enzymów restrykcyjnych w celu pocięcia DNA na fragmenty lub reakcji łańcuchowej polimerazy (PCR) w celu amplifikacji segmentu genu. Segmenty te można następnie wyekstrahować za pomocą elektroforezy żelowej . Jeśli wybrany gen lub genom organizmu dawcy został dobrze zbadany, może już być dostępny w bibliotece genetycznej . Jeśli sekwencja DNA , ale nie ma dostępnych kopii genu, można go również sztucznie zsyntetyzować . Po wyizolowaniu gen jest ligowany z plazmidem , który jest następnie wstawiany do bakterii. Plazmid jest replikowany podczas podziału bakterii, zapewniając dostępność nieograniczonej liczby kopii genu. Plazmid RK2 wyróżnia się zdolnością do replikacji w szerokiej gamie organizmów jednokomórkowych , co czyni go odpowiednim narzędziem inżynierii genetycznej.
Zanim gen zostanie wprowadzony do docelowego organizmu, musi zostać połączony z innymi elementami genetycznymi. Obejmują one promotora i terminatora , które inicjują i kończą transkrypcję . Dodawany jest selekcyjny markerowy , który w większości przypadków nadaje oporność na antybiotyki , dzięki czemu naukowcy mogą łatwo określić, które komórki zostały pomyślnie stransformowane. Gen można również zmodyfikować na tym etapie w celu uzyskania lepszej ekspresji lub skuteczności. Te manipulacje są przeprowadzane przy użyciu rekombinacji DNA , takich jak trawienie restrykcyjne , ligacje i klonowanie molekularne.
Wstawianie DNA do genomu gospodarza

Istnieje wiele technik stosowanych do wprowadzania materiału genetycznego do genomu gospodarza. Niektóre bakterie mogą naturalnie pobierać obcy DNA . Zdolność tę można wywołać u innych bakterii poprzez stres (np. termiczny lub elektryczny), który zwiększa przepuszczalność błony komórkowej dla DNA; pobrany DNA może albo integrować się z genomem, albo istnieć jako pozachromosomalny DNA . DNA jest zazwyczaj wprowadzane do komórek zwierzęcych za pomocą mikroiniekcji , gdzie może być wstrzykiwane przez otoczkę jądrową komórki bezpośrednio do jądra lub za pomocą wektorów wirusowych .
Genomy roślin można modyfikować metodami fizycznymi lub przy użyciu Agrobacterium do dostarczania sekwencji umieszczonych w wektorach binarnych T-DNA . W roślinach DNA jest często wstawiane za pomocą transformacji za pośrednictwem Agrobacterium , wykorzystując sekwencję T-DNA Agrobacterium , która umożliwia naturalną insercję materiału genetycznego do komórek roślinnych. Inne metody obejmują biolistykę , w której cząsteczki złota lub wolframu są powlekane DNA, a następnie wstrzykiwane do młodych komórek roślinnych, oraz elektroporację , która polega na zastosowaniu wstrząsu elektrycznego w celu uczynienia błony komórkowej przepuszczalną dla plazmidowego DNA.
Ponieważ tylko pojedyncza komórka jest transformowana materiałem genetycznym, organizm musi zostać zregenerowany z tej pojedynczej komórki. U roślin osiąga się to poprzez zastosowanie hodowli tkankowej . U zwierząt konieczne jest upewnienie się, że wprowadzone DNA jest obecne w zarodkowych komórkach macierzystych . Bakterie składają się z pojedynczej komórki i rozmnażają się klonalnie, więc regeneracja nie jest konieczna. Markery selekcyjne są używane do łatwego odróżnienia komórek transformowanych od nietransformowanych. Markery te są zwykle obecne w organizmie transgenicznym, chociaż opracowano szereg strategii, które mogą usuwać marker selekcyjny z dojrzałej rośliny transgenicznej.

Dalsze testy przy użyciu PCR, hybrydyzacji Southern i sekwencjonowania DNA są przeprowadzane w celu potwierdzenia, że organizm zawiera nowy gen. Testy te mogą również potwierdzić położenie chromosomalne i liczbę kopii wstawionego genu. Obecność genu nie gwarantuje jego ekspresji na odpowiednim poziomie w tkance docelowej, dlatego stosuje się również metody poszukiwania i pomiaru produktów genu (RNA i białka). Obejmują one hybrydyzację typu Northern , ilościowy RT-PCR , Western blot , immunofluorescencję , test ELISA i analizę fenotypową.
Nowy materiał genetyczny można wstawić losowo do genomu gospodarza lub skierować w określone miejsce. Technika kierowania genów wykorzystuje rekombinację homologiczną w celu dokonania pożądanych zmian w określonym genie endogennym . Ma to tendencję do występowania ze stosunkowo niską częstotliwością u roślin i zwierząt i na ogół wymaga użycia markerów selekcyjnych . Częstotliwość kierowania genów można znacznie zwiększyć poprzez edycję genomu . Edycja genomu wykorzystuje sztucznie skonstruowane nukleazy , które tworzą specyficzne dwuniciowe pęknięcia w pożądanych miejscach w genomie i wykorzystują endogenne mechanizmy komórki do naprawy wywołanej przerwy przez naturalne procesy rekombinacji homologicznej i łączenia niehomologicznych końców . Istnieją cztery rodziny modyfikowanych nukleaz: meganukleazy , nukleazy palca cynkowego , nukleazy efektorowe podobne do aktywatorów transkrypcji (TALEN) i system Cas9-guideRNA (zaadaptowany z CRISPR ). TALEN i CRISPR to dwa najczęściej używane i każdy z nich ma swoje zalety. TALEN mają większą specyficzność docelową, podczas gdy CRISPR jest łatwiejszy do zaprojektowania i bardziej wydajny. Oprócz wzmacniania celowania w geny, zmodyfikowane nukleazy mogą być stosowane do wprowadzania mutacji w genach endogennych, które generują nokaut genu .
Aplikacje
Inżynieria genetyczna ma zastosowanie w medycynie, badaniach, przemyśle i rolnictwie i może być stosowana na wielu roślinach, zwierzętach i mikroorganizmach. Bakterie , pierwsze genetycznie modyfikowane organizmy, mogą mieć wstawiony plazmidowy DNA zawierający nowe geny kodujące leki lub enzymy przetwarzające żywność i inne substraty . Rośliny zostały zmodyfikowane pod kątem ochrony przed owadami, odporności na herbicydy, odporności na wirusy, lepszego odżywiania, tolerancji na presję środowiskową i produkcji jadalnych szczepionek . Większość skomercjalizowanych GMO to rośliny uprawne odporne na owady lub herbicydy. Genetycznie zmodyfikowane zwierzęta były wykorzystywane do badań, zwierząt modelowych oraz do produkcji produktów rolniczych lub farmaceutycznych. Genetycznie zmodyfikowane zwierzęta obejmują zwierzęta z wyłączonymi genami , zwiększoną podatnością na choroby , hormonami zapewniającymi dodatkowy wzrost i zdolność do ekspresji białek w ich mleku.
Medycyna
Inżynieria genetyczna ma wiele zastosowań w medycynie, które obejmują wytwarzanie leków, tworzenie modeli zwierząt naśladujących ludzkie warunki i terapię genową . Jednym z najwcześniejszych zastosowań inżynierii genetycznej była masowa produkcja ludzkiej insuliny w bakteriach. Ta aplikacja została teraz zastosowana do ludzkich hormonów wzrostu , hormonów folikulotropowych (do leczenia niepłodności), ludzkiej albuminy , przeciwciał monoklonalnych , czynników antyhemofilnych , szczepionek i wielu innych leków. Mysie hybrydomy , komórki połączone razem w celu wytworzenia przeciwciał monoklonalnych , zostały zaadaptowane za pomocą inżynierii genetycznej do stworzenia ludzkich przeciwciał monoklonalnych. Opracowywane są genetycznie modyfikowane wirusy , które nadal mogą nadawać odporność, ale brakuje im sekwencji zakaźnych .
Inżynieria genetyczna jest również wykorzystywana do tworzenia zwierzęcych modeli chorób człowieka. Myszy zmodyfikowane genetycznie są najczęstszym genetycznie zmodyfikowanym modelem zwierzęcym. Zostały one wykorzystane do badania i modelowania raka ( oncomous ), otyłości, chorób serca, cukrzycy, artretyzmu, uzależnień, lęków, starzenia się i choroby Parkinsona. Potencjalne lekarstwa można przetestować na tych mysich modelach.
Terapia genowa to inżynieria genetyczna ludzi , generalnie polegająca na zastępowaniu wadliwych genów skutecznymi. Badania kliniczne z wykorzystaniem somatycznej terapii genowej przeprowadzono z kilkoma chorobami, w tym SCID sprzężonym z chromosomem X , przewlekłą białaczką limfocytową (CLL) i chorobą Parkinsona . W 2012 r. Alipogene tiparvovec stał się pierwszą terapią genową, która została zatwierdzona do użytku klinicznego. W 2015 roku wirus został użyty do wstawienia zdrowego genu do komórek skóry chłopca cierpiącego na rzadką chorobę skóry, epidermolysis bullosa , w celu wzrostu, a następnie przeszczepienia zdrowej skóry na 80 procent ciała chłopca, które zostało dotknięte wirusem. choroba.
linii zarodkowej spowodowałaby, że każda zmiana byłaby dziedziczna, co wzbudziło obawy społeczności naukowej. W 2015 roku CRISPR został użyty do edycji DNA nieżywotnych embrionów ludzkich , co skłoniło naukowców z największych światowych akademii do wezwania do wprowadzenia moratorium na dziedziczne modyfikacje ludzkiego genomu. Istnieją również obawy, że technologia ta może być wykorzystywana nie tylko do leczenia, ale także do ulepszania, modyfikowania lub zmiany wyglądu, zdolności adaptacyjnych, inteligencji, charakteru lub zachowania istot ludzkich. Rozróżnienie między wyleczeniem a wzmocnieniem może być również trudne do ustalenia. W listopadzie 2018 roku He Jiankui ogłosił, że dokonał edycji genomów dwóch ludzkich embrionów, aby spróbować wyłączyć gen CCR5 , który koduje receptor, którego HIV używa do wnikania do komórek. Praca została powszechnie potępiona jako nieetyczna, niebezpieczna i przedwczesna. Obecnie modyfikacja linii płciowej jest zakazana w 40 krajach. Naukowcy, którzy przeprowadzają tego typu badania, często pozwalają zarodkom rosnąć przez kilka dni, nie pozwalając im rozwinąć się w dziecko.
Naukowcy modyfikują genom świń, aby wywołać wzrost narządów ludzkich, w celu zwiększenia skuteczności przeszczepów narządów od świni do człowieka . Naukowcy tworzą „napędy genowe”, zmieniając genomy komarów, aby uodpornić je na malarię, a następnie starają się rozprzestrzenić zmodyfikowane genetycznie komary w całej populacji komarów w nadziei na wyeliminowanie choroby.
Badania
Inżynieria genetyczna jest ważnym narzędziem dla przyrodników , a tworzenie organizmów transgenicznych jest jednym z najważniejszych narzędzi do analizy funkcji genów. Geny i inne informacje genetyczne z szerokiej gamy organizmów można wprowadzać do bakterii w celu ich przechowywania i modyfikacji, tworząc w ten sposób genetycznie zmodyfikowane bakterie . Bakterie są tanie, łatwe w uprawie, klonalne , szybko się namnażają, stosunkowo łatwo ulegają transformacji i mogą być przechowywane w temperaturze -80°C prawie w nieskończoność. Po wyizolowaniu genu można go przechowywać wewnątrz bakterii, zapewniając nieograniczone zasoby do badań.
Organizmy są genetycznie modyfikowane w celu odkrycia funkcji określonych genów. Może to mieć wpływ na fenotyp organizmu, miejsce ekspresji genu lub inne geny, z którymi wchodzi w interakcje. Eksperymenty te na ogół obejmują utratę funkcji, wzmocnienie funkcji, śledzenie i ekspresję.
- Eksperymenty z utratą funkcji , takie jak eksperyment z nokautem genu , w którym organizm jest modyfikowany tak, aby nie miał aktywności jednego lub więcej genów. W prostym nokaucie kopia pożądanego genu została zmieniona, aby uczynić ją niefunkcjonalną. Embrionalne komórki macierzyste zawierają zmieniony gen, który zastępuje istniejącą już funkcjonalną kopię. Te komórki macierzyste są wstrzykiwane do blastocyst , które są wszczepiane zastępczym matkom. Pozwala to eksperymentatorowi przeanalizować defekty spowodowane tą mutacją , a tym samym określić rolę poszczególnych genów. Stosowany jest szczególnie często w biologii rozwoju . Kiedy odbywa się to poprzez utworzenie biblioteki genów z mutacjami punktowymi w każdej pozycji w obszarze zainteresowania, a nawet w każdej pozycji w całym genie, nazywa się to „mutagenezą skanującą”. Najprostszą metodą i pierwszą stosowaną jest „skanowanie alaninowe”, w którym każda pozycja jest zmutowana do niereaktywnego aminokwasu alaniny .
- Zysk eksperymentów funkcyjnych , logiczny odpowiednik nokautów. Czasami przeprowadza się je w połączeniu z eksperymentami z nokautem, aby dokładniej ustalić funkcję pożądanego genu. Proces jest bardzo podobny do inżynierii nokautowej, z wyjątkiem tego, że konstrukt ma na celu zwiększenie funkcji genu, zwykle poprzez dostarczenie dodatkowych kopii genu lub częstsze indukowanie syntezy białka. Wzmocnienie funkcji służy do stwierdzenia, czy białko jest wystarczające dla danej funkcji, ale nie zawsze oznacza, że jest wymagane, zwłaszcza w przypadku redundancji genetycznej lub funkcjonalnej.
- Eksperymenty śledzące , które mają na celu uzyskanie informacji o lokalizacji i interakcji pożądanego białka. Jednym ze sposobów na to jest zastąpienie genu typu dzikiego genem „fuzyjnym”, który polega na zestawieniu genu typu dzikiego z elementem raportującym, takim jak białko zielonej fluorescencji (GFP), które umożliwi łatwą wizualizację produktów modyfikacji genetycznej. Chociaż jest to użyteczna technika, manipulacja może zniszczyć funkcję genu, tworząc efekty wtórne i prawdopodobnie podważając wyniki eksperymentu. Obecnie opracowywane są bardziej wyrafinowane techniki, które mogą śledzić produkty białkowe bez łagodzenia ich funkcji, takie jak dodawanie małych sekwencji, które będą służyć jako motywy wiążące przeciwciała monoklonalne.
- Badania ekspresji mają na celu odkrycie, gdzie i kiedy produkowane są określone białka. W tych eksperymentach sekwencja DNA przed DNA kodującym białko, znana jako promotor genu, jest ponownie wprowadzana do organizmu z regionem kodującym białko zastąpionym genem reporterowym, takim jak GFP lub enzymem, który katalizuje produkcję barwnika . W ten sposób można zaobserwować czas i miejsce, w którym produkowane jest określone białko. Badania nad ekspresją można pójść o krok dalej, zmieniając promotor w celu ustalenia, które fragmenty są kluczowe dla prawidłowej ekspresji genu i są faktycznie wiązane przez białka czynnika transkrypcyjnego; ten proces jest znany jako walenie promotora .
Przemysłowy
Organizmy mogą transformować swoje komórki za pomocą genu kodującego użyteczne białko, takie jak enzym, tak aby nadekspresjonowały pożądane białko. Masowe ilości białka można następnie wytwarzać przez hodowanie transformowanego organizmu w sprzęcie bioreaktora z wykorzystaniem fermentacji przemysłowej , a następnie oczyszczanie białka. Niektóre geny nie działają dobrze w bakteriach, więc można również użyć drożdży, komórek owadzich lub komórek ssaków. Techniki te są wykorzystywane do produkcji leków, takich jak insulina , ludzki hormon wzrostu i szczepionek , suplementów, takich jak tryptofan , pomoc w produkcji żywności ( chymozyna w produkcji serów) i paliw. Inne zastosowania z genetycznie zmodyfikowanymi bakteriami mogą obejmować wykonywanie zadań poza ich naturalnym cyklem, takich jak wytwarzanie biopaliw , usuwanie wycieków ropy, węgla i innych odpadów toksycznych oraz wykrywanie arsenu w wodzie pitnej. Niektóre drobnoustroje zmodyfikowane genetycznie mogą być również wykorzystywane w biogórnictwie i bioremediacji ze względu na ich zdolność do wydobywania metali ciężkich ze środowiska i włączania ich w związki, które są łatwiejsze do odzyskania.
W materiałoznawstwie genetycznie zmodyfikowany wirus został wykorzystany w laboratorium badawczym jako rusztowanie do montażu bardziej przyjaznego dla środowiska akumulatora litowo-jonowego . Bakterie zostały również zaprojektowane tak, aby działały jako czujniki poprzez ekspresję białka fluorescencyjnego w określonych warunkach środowiskowych.
Rolnictwo

Jednym z najbardziej znanych i kontrowersyjnych zastosowań inżynierii genetycznej jest tworzenie i wykorzystywanie genetycznie zmodyfikowanych upraw lub genetycznie zmodyfikowanego żywego inwentarza do produkcji genetycznie zmodyfikowanej żywności . Uprawy zostały opracowane w celu zwiększenia produkcji, zwiększenia tolerancji na stresy abiotyczne , zmiany składu żywności lub produkcji nowych produktów.
Pierwsze uprawy wprowadzone na skalę komercyjną zapewniały ochronę przed szkodnikami owadzimi lub tolerancję na herbicydy . Uprawy odporne na grzyby i wirusy również zostały opracowane lub są w trakcie opracowywania. Ułatwia to zwalczanie owadów i chwastów w uprawach i może pośrednio zwiększyć plony. Opracowywane są również uprawy GM, które bezpośrednio poprawiają plony poprzez przyspieszenie wzrostu lub zwiększenie odporności rośliny (poprzez poprawę tolerancji na sól, zimno lub suszę). W 2016 r. Łosoś został genetycznie zmodyfikowany za pomocą hormonów wzrostu, aby znacznie szybciej osiągnąć normalne dorosłe rozmiary.
Opracowano GMO, które modyfikują jakość produktów poprzez zwiększenie wartości odżywczej lub zapewnienie bardziej przydatnych w przemyśle właściwości lub ilości. Ziemniak Amflora wytwarza bardziej przydatną przemysłowo mieszankę skrobi. Soja i rzepak zostały genetycznie zmodyfikowane, aby produkować zdrowsze oleje. Pierwszą skomercjalizowaną żywnością GM był pomidor , który opóźnił dojrzewanie, zwiększając jego trwałość .
Rośliny i zwierzęta zostały zaprojektowane tak, aby wytwarzały materiały, których normalnie nie wytwarzają. Pharming wykorzystuje uprawy i zwierzęta jako bioreaktory do produkcji szczepionek, półproduktów leków lub samych leków; użyteczny produkt jest oczyszczany ze zbiorów, a następnie używany w standardowym procesie produkcji farmaceutycznej. Krowy i kozy zostały zmodyfikowane tak, aby wydzielały leki i inne białka w mleku, aw 2009 roku FDA zatwierdziła lek wytwarzany z mleka koziego.
Inne aplikacje
Inżynieria genetyczna ma potencjalne zastosowania w ochronie i zarządzaniu obszarami naturalnymi. Zaproponowano transfer genów przez wektory wirusowe jako sposób kontrolowania gatunków inwazyjnych, a także szczepienia zagrożonej fauny przed chorobami. Sugerowano, że drzewa transgeniczne są sposobem nadawania odporności dzikim populacjom na patogeny. Wraz ze wzrostem ryzyka nieprzystosowania organizmów w wyniku zmiany klimatu i innych perturbacji, ułatwiona adaptacja poprzez modyfikację genów może być jednym ze sposobów zmniejszenia ryzyka wyginięcia. Zastosowania inżynierii genetycznej w ochronie przyrody są jak dotąd głównie teoretyczne i nie zostały jeszcze wprowadzone w życie.
Inżynieria genetyczna jest również wykorzystywana do tworzenia sztuki mikrobiologicznej . Niektóre bakterie zostały zmodyfikowane genetycznie w celu tworzenia czarno-białych fotografii. Nowatorskie przedmioty, takie jak goździki w kolorze lawendy , niebieskie róże i świecące ryby , również zostały wyprodukowane dzięki inżynierii genetycznej.
Rozporządzenie
Regulacje dotyczące inżynierii genetycznej dotyczą podejścia stosowanego przez rządy do oceny i zarządzania ryzykiem związanym z rozwojem i uwalnianiem GMO. Rozwój ram regulacyjnych rozpoczął się w 1975 roku w Asilomar w Kalifornii. Spotkanie Asilomar zaleciło zestaw dobrowolnych wytycznych dotyczących stosowania technologii rekombinacji. Gdy technologia się poprawiła, Stany Zjednoczone utworzyły komitet w Biurze Nauki i Technologii , który przydzielił USDA, FDA i EPA zatwierdzenie regulacyjne żywności GM. Protokół z Kartageny o bezpieczeństwie biologicznym , międzynarodowy traktat regulujący przenoszenie, obchodzenie się i stosowanie GMO, został przyjęty 29 stycznia 2000 r. Sto pięćdziesiąt siedem krajów jest członkami Protokołu, a wiele z nich używa go jako punktu odniesienia dla ich własne przepisy.
Status prawny i regulacyjny żywności GM różni się w zależności od kraju, przy czym niektóre kraje zakazują jej lub ograniczają, a inne zezwalają na nią z bardzo różnymi stopniami regulacji. Niektóre kraje zezwalają na import żywności GM za zezwoleniem, ale albo nie zezwalają na jej uprawę (Rosja, Norwegia, Izrael), albo mają przepisy dotyczące upraw, mimo że nie wyprodukowano jeszcze żadnych produktów GM (Japonia, Korea Południowa). Większość krajów, które nie zezwalają na uprawę GMO, zezwala na badania. Niektóre z najbardziej wyraźnych różnic występują między Stanami Zjednoczonymi a Europą. Polityka USA koncentruje się na produkcie (nie na procesie), uwzględnia jedynie weryfikowalne ryzyko naukowe i wykorzystuje koncepcję istotnej równoważności . Natomiast Unia Europejska ma prawdopodobnie najbardziej rygorystyczne przepisy dotyczące GMO na świecie. Wszystkie GMO, wraz z napromienioną żywnością , są uważane za „nową żywność” i podlegają szczegółowej, indywidualnej, opartej na podstawach naukowych ocenie żywności przez Europejski Urząd ds. Bezpieczeństwa Żywności . Kryteria udzielania zezwoleń dzielą się na cztery szerokie kategorie: „bezpieczeństwo”, „wolność wyboru”, „etykietowanie” i „identyfikowalność”. Poziom regulacji w innych krajach, które uprawiają GMO, plasuje się pomiędzy Europą a Stanami Zjednoczonymi.
| Region | Regulatory | Notatki |
|---|---|---|
| NAS | USDA , FDA i EPA | |
| Europa | Europejski Urząd ds. Bezpieczeństwa Żywności | |
| Kanada | Health Canada i Kanadyjska Agencja Kontroli Żywności | Regulowane produkty o nowatorskich cechach, niezależnie od metody pochodzenia |
| Afryka | Wspólny rynek Afryki Wschodniej i Południowej | Ostateczna decyzja należy do każdego kraju z osobna. |
| Chiny | Biuro Administracji Bezpieczeństwa Biologicznego Inżynierii Genetycznej Rolnictwa | |
| Indie | Instytucjonalny Komitet Bezpieczeństwa Biologicznego, Komitet Przeglądowy ds. Manipulacji Genetycznych i Komitet Zatwierdzający Inżynierię Genetyczną | |
| Argentyna | Krajowy Komitet Doradczy ds. Biotechnologii Rolnej (wpływ na środowisko), Krajowa Służba Zdrowia i Jakości Rolno-Spożywczej (bezpieczeństwo żywności) oraz Krajowy Kierunek Agrobiznesu (wpływ na handel) | Ostateczna decyzja podjęta przez Sekretariat ds. Rolnictwa, Hodowli, Rybołówstwa i Żywności. |
| Brazylia | Krajowa Komisja Techniczna ds. Bezpieczeństwa Biologicznego (środowisko i bezpieczeństwo żywności) oraz Rada Ministrów (kwestie handlowe i ekonomiczne) | |
| Australia | Office of the Gene Technology Regulator (nadzoruje wszystkie produkty GM), Therapeutic Goods Administration (leki GM) i Food Standards Australia Nowa Zelandia (żywność GM). | Poszczególne rządy stanowe mogą następnie ocenić wpływ uwolnienia na rynki i handel oraz zastosować dalsze przepisy w celu kontroli zatwierdzonych produktów zmodyfikowanych genetycznie. |
Jedną z kluczowych kwestii dotyczących organów regulacyjnych jest to, czy produkty GM powinny być znakowane. Komisja Europejska twierdzi, że obowiązkowe etykietowanie i identyfikowalność są potrzebne, aby umożliwić świadomy wybór, uniknąć potencjalnej fałszywej reklamy i ułatwić wycofanie produktów w przypadku wykrycia niekorzystnego wpływu na zdrowie lub środowisko. American Medical Association i American Association for the Advancement of Science twierdzą, że brak naukowych dowodów na szkodliwość, nawet dobrowolne etykietowanie, jest mylące i fałszywie alarmuje konsumentów. Etykietowanie produktów GMO na rynku jest wymagane w 64 krajach. Etykietowanie może być obowiązkowe do poziomu progowego zawartości GMO (który różni się w zależności od kraju) lub dobrowolne. W Kanadzie i USA znakowanie żywności GMO jest dobrowolne, podczas gdy w Europie cała żywność (w tym żywność przetworzona ) lub pasza , która zawiera więcej niż 0,9% zatwierdzonych GMO, musi być oznakowana.
Spór
Krytycy sprzeciwiali się stosowaniu inżynierii genetycznej z kilku powodów, w tym ze względów etycznych, ekologicznych i ekonomicznych. Wiele z tych obaw dotyczy upraw GM i tego, czy produkowana z nich żywność jest bezpieczna i jaki wpływ będzie miała ich uprawa na środowisko. Kontrowersje te doprowadziły do sporów sądowych, międzynarodowych sporów handlowych i protestów, a także do restrykcyjnych regulacji dotyczących produktów handlowych w niektórych krajach.
Oskarżenia, że naukowcy „ bawią się w Boga ” i inne kwestie religijne były przypisywane technologii od samego początku. Inne poruszone kwestie etyczne obejmują patentowanie życia , korzystanie z praw własności intelektualnej , poziom etykietowania produktów, kontrolę dostaw żywności i obiektywność procesu regulacyjnego. Chociaż pojawiły się wątpliwości, z ekonomicznego punktu widzenia większość badań wykazała, że uprawa roślin GM jest korzystna dla rolników.
Przepływ genów między uprawami GM a kompatybilnymi roślinami, wraz ze zwiększonym stosowaniem selektywnych herbicydów , może zwiększyć ryzyko rozwoju „ superchwastów ”. Inne obawy dotyczące środowiska obejmują potencjalny wpływ na organizmy inne niż docelowe, w tym drobnoustroje glebowe , oraz wzrost wtórnych i odpornych szkodników owadzich. Zrozumienie wielu skutków środowiskowych związanych z uprawami GM może zająć wiele lat i jest również widoczne w konwencjonalnych praktykach rolniczych. Wraz z komercjalizacją genetycznie zmodyfikowanych ryb pojawiają się obawy, jakie będą konsekwencje dla środowiska, jeśli uciekną.
Istnieją trzy główne obawy dotyczące bezpieczeństwa genetycznie zmodyfikowanej żywności: czy mogą one wywołać reakcję alergiczną ; czy geny mogą przenosić się z pożywienia do ludzkich komórek; oraz czy geny niezatwierdzone do spożycia przez ludzi mogą krzyżować się z innymi uprawami. Istnieje naukowy konsensus co do tego, że obecnie dostępna żywność pochodząca z upraw GM nie stanowi większego zagrożenia dla zdrowia ludzkiego niż żywność konwencjonalna, ale każda żywność GM musi być indywidualnie testowana przed wprowadzeniem. Niemniej jednak członkowie społeczeństwa są mniej skłonni niż naukowcy postrzegać żywność GM jako bezpieczną.
W kulturze popularnej
Inżynieria genetyczna występuje w wielu opowieściach science fiction . Powieść Franka Herberta The White Plague opisuje celowe wykorzystanie inżynierii genetycznej do stworzenia patogenu , który zabija kobiety. Inne dzieło Herberta, seria powieści Dune , wykorzystuje inżynierię genetyczną do stworzenia potężnego Tleilaxu . Niewiele filmów poinformowało widzów o inżynierii genetycznej, z wyjątkiem Chłopców z Brazylii z 1978 r . i Parku Jurajskiego z 1993 r., z których oba wykorzystują lekcję, demonstrację i fragment filmu naukowego. Metody inżynierii genetycznej są słabo reprezentowane w filmie; Michael Clark, piszący dla Wellcome Trust , nazywa przedstawianie inżynierii genetycznej i biotechnologii „poważnie zniekształconym” w filmach takich jak The 6th Day . Zdaniem Clarka biotechnologii zazwyczaj „nadaje się fantastyczne, ale przykuwające wzrok formy”, podczas gdy nauka jest albo spychana na drugi plan, albo fabularyzowana, aby pasowała do młodej publiczności.
W grze wideo BioShock z 2007 roku inżynieria genetyczna odgrywa ważną rolę w głównej fabule i wszechświecie. Akcja gry toczy się w fikcyjnej podwodnej dystopii Rapture , której mieszkańcy posiadają genetyczne nadludzkie zdolności po wstrzyknięciu sobie „plazmidów”, czyli serum, które daje takie moce. Również w mieście Rapture są „Little Sisters”, małe dziewczynki, które są ogólnie modyfikowane, a także poboczny wątek, w którym piosenkarka kabaretowa sprzedaje swój płód genetykom, którzy wszczepiają noworodkowi fałszywe wspomnienia i genetycznie modyfikują go, aby rósł w dorosłego.
Zobacz też
- Inżynieria biologiczna
- Modyfikacje (genetyka)
- Edycja RNA#Terapeutyczna edycja mRNA
- Mutageneza (technika biologii molekularnej)
Dalsza lektura
- Brytyjskie Stowarzyszenie Medyczne (1999). Wpływ modyfikacji genetycznych na rolnictwo, żywność i zdrowie . Książki BMJ. ISBN 0-7279-1431-6 .
- Donnellan, Craig (2004). Modyfikacja genetyczna (problemy) . Niepodległościowe wydawnictwa edukacyjne. ISBN 1-86168-288-3 .
- Morgan S (1 stycznia 2009). Superfoods: genetyczna modyfikacja żywności . Biblioteka Heinemanna. ISBN 978-1-4329-2455-3 .
- Buźka, Zofia (2005). Modyfikacja genetyczna: przewodnik po studiach (odkrywanie problemów) . Niepodległościowe wydawnictwa edukacyjne. ISBN 1-86168-307-3 .
- Watsona JD (2007). Rekombinowane DNA: geny i genomy: krótki kurs . San Francisco: WH Freeman. ISBN 978-0-7167-2866-5 .
- Tkacz S, Michael M (2003). Annotowana bibliografia publikacji naukowych na temat zagrożeń związanych z modyfikacją genetyczną (raport). Wellington, Nowa Zelandia: Uniwersytet Wiktorii.
- Zaid A, Hughes HG, Porceddu E, Nicholas F (2001). Glosariusz biotechnologii dla wyżywienia i rolnictwa - poprawione i rozszerzone wydanie słownika biotechnologii i inżynierii genetycznej . Rzym, Włochy: FAO . ISBN 92-5-104683-2 .
Linki zewnętrzne
|
Zasoby biblioteczne dotyczące inżynierii genetycznej |