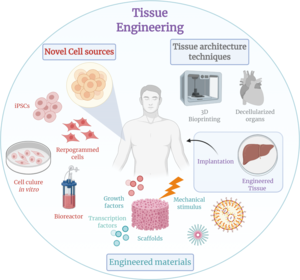
Inżynieria tkankowa
Inżynieria tkankowa to dyscyplina inżynierii biomedycznej , która wykorzystuje kombinację komórek , inżynierii , metod materiałowych oraz odpowiednich czynników biochemicznych i fizykochemicznych w celu przywrócenia, utrzymania, ulepszenia lub wymiany różnych typów tkanek biologicznych . Inżynieria tkankowa często obejmuje wykorzystanie komórek umieszczonych na rusztowaniach tkankowych do tworzenia nowej żywej tkanki do celów medycznych, ale nie ogranicza się do zastosowań związanych z komórkami i rusztowaniami tkankowymi. Chociaż kiedyś była klasyfikowana jako poddziedzina biomateriały , których zakres i znaczenie wzrosły, można uznać za dziedzinę samą w sobie.
Podczas gdy większość definicji inżynierii tkankowej obejmuje szeroki zakres zastosowań, w praktyce termin ten jest ściśle związany z zastosowaniami, które naprawiają lub zastępują części lub całe tkanki (tj. kości , chrząstki , naczynia krwionośne , pęcherz moczowy , skórę , mięśnie itp.). Często zaangażowane tkanki wymagają pewnych właściwości mechanicznych i strukturalnych do prawidłowego funkcjonowania. Terminem tym określano również próby wykonywania określonych funkcji biochemicznych przy użyciu komórek w sztucznie stworzonym systemie podporowym (np. sztuczna trzustka , czy biosztuczna wątroba ). Termin medycyna regeneracyjna jest często używany jako synonim inżynierii tkankowej, chociaż osoby zajmujące się medycyną regeneracyjną kładą większy nacisk na wykorzystanie komórek macierzystych lub komórek progenitorowych do produkcji tkanek.
Przegląd

Powszechnie stosowana definicja inżynierii tkankowej, jak stwierdzili Langer i Vacanti, to „ interdyscyplinarność ”. dziedzina, która stosuje zasady inżynierii i nauk przyrodniczych w celu opracowania substytutów biologicznych, które przywracają, utrzymują lub poprawiają funkcję [tkanki biologicznej] lub całego narządu”. Ponadto Langer i Vacanti stwierdzają również, że istnieją trzy główne typy tkanek inżynieria tkankowa: komórki, substancje indukujące tkankę oraz podejście komórka + macierz (często określane jako rusztowanie). Inżynieria tkankowa została również zdefiniowana jako „zrozumienie zasad wzrostu tkanki i zastosowanie jej do wytworzenia funkcjonalnej tkanki zastępczej do użytku klinicznego Dalszy opis mówi dalej, że „podstawowym założeniem inżynierii tkankowej jest to, że wykorzystanie naturalnej biologii systemu pozwoli na większy sukces w opracowywaniu strategii terapeutycznych mających na celu wymianę, naprawę, utrzymanie lub poprawę funkcji tkanki ".
Rozwój multidyscyplinarnej dziedziny inżynierii tkankowej zaowocował nowatorskim zestawem części zamiennych do tkanek i strategii wdrażania. Postęp naukowy w biomateriałach , komórkach macierzystych, czynnikach wzrostu i różnicowania oraz biomimetyce środowiska stworzyły wyjątkowe możliwości wytwarzania lub ulepszania istniejących tkanek w laboratorium z kombinacji inżynieryjnych macierzy zewnątrzkomórkowych („rusztowań”), komórek i biologicznie aktywnych cząsteczek. Jednym z głównych wyzwań stojących obecnie przed inżynierią tkankową jest potrzeba bardziej złożonej funkcjonalności, stabilności biomechanicznej i unaczynienia w wyhodowanych w laboratorium tkankach przeznaczonych do przeszczepów.
Etymologia
Historyczne pochodzenie tego terminu jest niejasne, ponieważ definicja tego słowa zmieniła się w ciągu ostatnich kilku dekad. Termin ten pojawił się po raz pierwszy w publikacji z 1984 r., w której opisano organizację błony przypominającej śródbłonek na powierzchni długo wszczepionej syntetycznej ocznej .
Pierwsze nowoczesne użycie tego terminu, które zostało dzisiaj uznane, miało miejsce w 1985 roku przez badacza, fizjologa i bioinżyniera Yuan-Cheng Funga z Engineering Research Center. Zaproponował połączenie terminów tkanka (w odniesieniu do fundamentalnego związku między komórkami i narządami) oraz inżynieria (w odniesieniu do dziedziny modyfikacji wspomnianych tkanek). Termin ten został oficjalnie przyjęty w 1987 roku.
Historia
Era starożytna (przed XVII wiekiem)
Podstawowe zrozumienie wewnętrznego funkcjonowania ludzkich tkanek może sięgać dalej, niż większość się spodziewa. Już w okresie neolitu szwy były używane do zamykania ran i wspomagania gojenia. Później społeczeństwa takie jak starożytny Egipt opracowały lepsze materiały do zszywania ran, takie jak szwy lniane. Około 2500 rpne w starożytnych Indiach przeszczepy skóry zostały opracowane przez odcięcie skóry z pośladków i przyszycie jej do ran w uchu, nosie lub ustach. Starożytni Egipcjanie często przeszczepiali skórę ze zwłok żywym ludziom, a nawet próbowali używać miodu jako rodzaju antybiotyku i tłuszczu jako bariery ochronnej zapobiegającej infekcjom. W I i II wieku naszej ery Gallo-Rzymianie opracowali implanty z kutego żelaza, a implanty dentystyczne można było znaleźć u starożytnych Majów.
Oświecenie (XVII-XIX wiek)
Chociaż te starożytne społeczeństwa rozwinęły techniki, które znacznie wyprzedzały swoje czasy, nadal brakowało im mechanistycznego zrozumienia, w jaki sposób ciało reaguje na te procedury. To mechanistyczne podejście towarzyszyło rozwojowi empirycznej metody nauki, której pionierem był René Descartes. Sir Isaac Newton zaczął opisywać ciało jako „maszynę fizykochemiczną” i twierdził, że choroba jest awarią tej maszyny. W XVII wieku Robert Hooke odkrył komórkę, a list Benedykta de Spinozy przedstawił ideę homeostazy między dynamicznymi procesami w ciele. Eksperymenty z hydrą przeprowadzone przez Abrahama Trembleya w XVIII wieku zaczęły zagłębiać się w zdolności regeneracyjne komórek. W XIX wieku lepsze zrozumienie reakcji różnych metali z ciałem doprowadziło do opracowania lepszych szwów i przejścia na implanty śrubowe i płytkowe w mocowaniu kości. Co więcej, w połowie XIX wieku po raz pierwszy wysunięto hipotezę, że interakcje komórka-środowisko i proliferacja komórek są niezbędne do regeneracji tkanek.
Era nowożytna (XX i XXI wiek)
W miarę upływu czasu i postępu technologicznego istnieje ciągła potrzeba zmiany podejścia, jakie naukowcy przyjmują w swoich badaniach. Inżynieria tkankowa ewoluowała przez wieki. Na początku ludzie oglądali i wykorzystywali próbki bezpośrednio ze zwłok ludzkich lub zwierzęcych. Obecnie inżynierowie tkankowi mają możliwość przetworzenia wielu tkanek w ciele za pomocą nowoczesnych technik, takich jak mikrofabrykacja i trójwymiarowy biodruk w połączeniu z natywnymi komórkami tkankowymi/komórkami macierzystymi. Postępy te umożliwiły naukowcom generowanie nowych tkanek w znacznie wydajniejszy sposób. Na przykład techniki te pozwalają na większą personalizację, co pozwala na lepszą biokompatybilność, zmniejszoną odpowiedź immunologiczną, integrację komórkową i długowieczność. Nie ma wątpliwości, że techniki te będą nadal ewoluować, ponieważ w ciągu ostatniej dekady obserwowaliśmy ewolucję mikrofabrykacji i biodruku.
W 1960 roku Wichterle i Lim jako pierwsi opublikowali eksperymenty na hydrożelach do zastosowań biomedycznych, wykorzystując je w konstrukcji soczewek kontaktowych. Prace w tej dziedzinie rozwijały się powoli przez następne dwie dekady, ale później zyskały na popularności, gdy hydrożele zostały ponownie wykorzystane do dostarczania leków. W 1984 roku Charles Hull opracował biodruk, przekształcając drukarkę atramentową Hewlett-Packard w urządzenie zdolne do osadzania komórek w 2D. Druk trójwymiarowy (3D) to rodzaj wytwarzania przyrostowego, który ze względu na wysoką precyzję i wydajność znalazł różne zastosowania w inżynierii medycznej. Wraz z opracowaniem przez biologa Jamesa Thompsona pierwszych linii ludzkich komórek macierzystych w 1998 r., a następnie przeszczepem pierwszych organów wewnętrznych wyhodowanych w laboratorium w 1999 r. i stworzeniem pierwszej biodrukarki w 2003 r. Biodruk D stał się bardziej konwencjonalnie stosowany w medycynie niż kiedykolwiek wcześniej. Jak dotąd naukowcom udało się wydrukować mini organoidy i narządy na chipach, które dały praktyczny wgląd w funkcje ludzkiego ciała. Firmy farmaceutyczne używają tych modeli do testowania leków przed przejściem do badań na zwierzętach. Jednak w pełni funkcjonalny i strukturalnie podobny narząd nie został jeszcze wydrukowany. Zespół z University of Utah podobno wydrukował uszy i z powodzeniem przeszczepił je dzieciom urodzonym z wadami, które pozostawiły ich uszy częściowo rozwinięte.
Obecnie hydrożele są uważane za preferowany wybór bio-atramentów do biodruku 3D, ponieważ naśladują naturalną ECM komórek, a jednocześnie mają silne właściwości mechaniczne zdolne do podtrzymywania struktur 3D. Co więcej, hydrożele w połączeniu z biodrukiem 3D umożliwiają naukowcom wytwarzanie różnych rusztowań, które można wykorzystać do tworzenia nowych tkanek lub narządów. Tkanki drukowane w 3D wciąż napotykają wiele wyzwań, takich jak dodanie układu naczyniowego. Tymczasem drukowanie 3D części tkanek zdecydowanie poprawi nasze zrozumienie ludzkiego ciała, przyspieszając tym samym zarówno badania podstawowe, jak i kliniczne.
Przykłady
Jak zdefiniowali Langer i Vacanti, przykłady inżynierii tkankowej należą do jednej lub więcej z trzech kategorii: „tylko komórki”, „komórki i rusztowanie” lub „czynniki indukujące tkankę”.
- Mięso in vitro : jadalna sztuczna zwierzęca tkanka mięśniowa hodowana in vitro .
- Urządzenie biosztucznej wątroby , „tymczasowa wątroba”, pozaustrojowe urządzenie wspomagające wątrobę (ELAD): Linia komórek ludzkich hepatocytów (linia C3A) w bioreaktorze z pustymi włóknami może naśladować funkcję wątroby w ostrych przypadkach niewydolności wątroby. W pełni zdolny ELAD tymczasowo funkcjonowałby jako wątroba jednostki, unikając w ten sposób przeszczepu i umożliwiając regenerację własnej wątroby.
- Sztuczna trzustka : Badania obejmują wykorzystanie komórek wysp trzustkowych do regulacji poziomu cukru we krwi, szczególnie w przypadkach cukrzycy . Czynniki biochemiczne mogą być wykorzystane do spowodowania różnicowania (przekształcenia) ludzkich pluripotencjalnych komórek macierzystych w komórki, które działają podobnie do komórek beta , które są odpowiedzialne za produkcję insuliny w komórce wysp trzustkowych .
- Sztuczne pęcherze : Anthony Atala ( Wake Forest University ) z powodzeniem wszczepił sztuczne pęcherze, zbudowane z hodowanych komórek wysianych na rusztowaniu w kształcie pęcherza, u siedmiu z około 20 badanych ludzi w ramach długoterminowego eksperymentu .
- Chrząstka : wyhodowana w laboratorium chrząstka, hodowana in vitro na rusztowaniu, została z powodzeniem wykorzystana jako autologiczny przeszczep do naprawy kolan pacjentów.
- Chrząstka bez rusztowania: Chrząstka wytworzona bez użycia egzogennego materiału rusztowania. W tej metodologii cały materiał konstruktu jest komórkowy, wytwarzany bezpośrednio przez komórki.
- Biosztuczne serce : Laboratorium Doris Taylor skonstruowało biokompatybilne serce szczura poprzez recelularyzację pozbawionego komórek serca szczura. To rusztowanie i komórki umieszczono w bioreaktorze , gdzie dojrzewały, by stać się narządem częściowo lub całkowicie nadającym się do przeszczepu. praca została nazwana „punktem orientacyjnym”. Laboratorium najpierw usunęło komórki z serca szczura (proces zwany „decelularyzacją”), a następnie wstrzyknęło szczurze komórki macierzyste do pozbawionego komórek serca szczura.
- Naczynia krwionośne wytworzone metodą inżynierii tkankowej: Naczynia krwionośne wyhodowane w laboratorium i mogą być użyte do naprawy uszkodzonych naczyń krwionośnych bez wywoływania odpowiedzi immunologicznej .
- Sztuczna skóra zbudowana z ludzkich komórek skóry osadzonych w hydrożelu , tak jak w przypadku konstruktów biodrukowanych do naprawy oparzeń na polu bitwy.
- Sztuczny szpik kostny : Szpik kostny hodowany in vitro do przeszczepu służy jako podejście „tylko komórki” do inżynierii tkankowej.
- Kość inżynierii tkankowej: matryca strukturalna może składać się z metali, takich jak tytan, polimery o różnym stopniu degradacji lub niektóre rodzaje ceramiki. Materiały są często wybierane do rekrutacji osteoblastów , aby pomóc w odbudowie kości i przywróceniu funkcji biologicznych. Różne rodzaje komórek można dodawać bezpośrednio do matrycy, aby przyspieszyć proces.
- Penis wyhodowany w laboratorium : Odkomórkowione rusztowania penisów królików poddano recelularyzacji za pomocą komórek mięśni gładkich i śródbłonka. Narząd został następnie przeszczepiony żywym królikom i funkcjonował porównywalnie do narządu natywnego, co sugeruje potencjał leczenia urazów narządów płciowych .
- Inżynieria tkankowa błony śluzowej jamy ustnej wykorzystuje podejście oparte na komórkach i rusztowaniach w celu odtworzenia trójwymiarowej struktury i funkcji błony śluzowej jamy ustnej .
Komórki jako elementy budulcowe
Komórki są jednym z głównych elementów sukcesu metod inżynierii tkankowej. Inżynieria tkankowa wykorzystuje komórki jako strategie tworzenia/zastępowania nowej tkanki. Przykłady obejmują fibroblasty stosowane do naprawy lub odnowy skóry, chondrocyty stosowane do naprawy chrząstki (produkt zatwierdzony przez MACI-FDA) oraz hepatocyty stosowane w systemach wspomagających wątrobę
Komórki mogą być używane samodzielnie lub z matrycami pomocniczymi do zastosowań w inżynierii tkankowej. Odpowiednie środowisko sprzyjające wzrostowi, różnicowaniu i integracji komórek z istniejącą tkanką jest kluczowym czynnikiem dla bloków budulcowych opartych na komórkach. Manipulowanie którymkolwiek z tych procesów komórkowych stwarza alternatywne możliwości rozwoju nowej tkanki (np. przeprogramowanie komórek somatycznych, unaczynienie).
Izolacja
Techniki izolacji komórek zależą od źródła komórek. Wirowanie i afereza to techniki stosowane do ekstrakcji komórek z biopłynów (np. krwi). Podczas gdy procesy trawienia, zazwyczaj wykorzystujące enzymy do usunięcia macierzy pozakomórkowej (ECM), są wymagane przed technikami wirowania lub aferezy w celu ekstrakcji komórek z tkanek/narządów. Trypsyna i kolagenaza to najczęściej stosowane enzymy do trawienia tkanek. Podczas gdy trypsyna jest zależna od temperatury, kolagenaza jest mniej wrażliwa na zmiany temperatury.
Źródła komórkowe
Komórki pierwotne to komórki bezpośrednio wyizolowane z tkanki gospodarza. Komórki te zapewniają model zachowania komórki ex vivo bez żadnych zmian genetycznych, epigenetycznych lub rozwojowych; co czyni je bliższymi replikacjami warunków in vivo niż komórki pochodzące z innych metod. Jednak to ograniczenie może również utrudniać ich studiowanie. Są to komórki dojrzałe, często terminalnie zróżnicowane, co oznacza, że dla wielu typów komórek proliferacja jest utrudniona lub niemożliwa. Ponadto mikrośrodowiska, w których te komórki istnieją, są wysoce wyspecjalizowane, co często utrudnia replikację tych warunków.
Komórki wtórne Część komórek z hodowli pierwotnej jest przenoszona do nowego repozytorium/naczynia w celu dalszej hodowli. Pożywkę z hodowli pierwotnej usuwa się, uzyskuje się komórki, które mają zostać przeniesione, a następnie hoduje się je w nowym naczyniu ze świeżą pożywką wzrostową. [ potrzebne źródło ] Wtórna hodowla komórkowa jest przydatna, aby zapewnić komórkom zarówno pomieszczenie, jak i składniki odżywcze, których potrzebują do wzrostu. Hodowle wtórne są przede wszystkim stosowane w każdym scenariuszu, w którym pożądana jest większa ilość komórek niż można znaleźć w hodowli pierwotnej. Komórki wtórne mają takie same ograniczenia jak komórki pierwotne (patrz wyżej), ale wiąże się z nimi dodatkowe ryzyko zanieczyszczenia podczas przenoszenia do nowego naczynia.
Klasyfikacja genetyczna komórek
Autologiczny: Dawca i biorca komórek to ta sama osoba. Komórki są zbierane, hodowane lub przechowywane, a następnie ponownie wprowadzane do gospodarza. W wyniku reintrodukcji własnych komórek gospodarza odpowiedź antygenowa nie jest wywoływana. Układ odpornościowy organizmu rozpoznaje te ponownie wszczepione komórki jako własne i nie atakuje ich. Zależność komórek autologicznych od zdrowia komórek gospodarza i chorobowości w miejscu dawcy może zniechęcać do ich stosowania. Mezenchymalne komórki macierzyste pochodzące z tkanki tłuszczowej i szpiku kostnego są zwykle z natury autologiczne i mogą być wykorzystywane na niezliczone sposoby, od pomocy w naprawie tkanki szkieletowej po uzupełnianie komórek beta u pacjentów z cukrzycą.
Allogeniczne: Komórki są uzyskiwane z ciała dawcy tego samego gatunku co biorca. Chociaż istnieją pewne ograniczenia etyczne w stosowaniu ludzkich komórek do badań in vitro (tj. rozwoju chimery ludzkiej tkanki mózgowej), wykorzystanie fibroblastów skórnych z ludzkiego napletka wykazuje immunologicznie bezpieczny, a zatem realny wybór dla allogenicznej inżynierii tkankowej skóry.
Ksenogeniczne: Komórki te pochodzą od izolowanych komórek z alternatywnych gatunków biorcy. Godnym uwagi przykładem wykorzystania tkanek ksenogenicznych jest budowa implantów sercowo-naczyniowych za pomocą komórek zwierzęcych. Chimeryczna hodowla ludzi i zwierząt budzi obawy etyczne co do możliwości poprawy świadomości dzięki wszczepianiu zwierzętom narządów ludzkich.
Syngeniczne lub izogeniczne: Komórki te opisują komórki pochodzące z identycznego kodu genetycznego. Daje to korzyść immunologiczną podobną do autologicznych linii komórkowych (patrz powyżej). Komórki autologiczne można uznać za syngeniczne, ale klasyfikacja obejmuje również komórki nieautologiczne, takie jak komórki pochodzące od bliźniaka jednojajowego, z genetycznie identycznych (sklonowanych) modeli badawczych lub indukowane komórki macierzyste (iSC) związane z dawcą .
Komórki macierzyste
Komórki macierzyste to niezróżnicowane komórki, które mają zdolność do dzielenia się w hodowli i dają początek różnym formom wyspecjalizowanych komórek. Komórki macierzyste dzielą się na „dorosłe” i „embrionalne” komórki macierzyste w zależności od pochodzenia. Chociaż nadal toczy się duża debata etyczna związana z wykorzystaniem embrionalnych komórek macierzystych, uważa się, że inne alternatywne źródło – indukowane pluripotencjalne komórki macierzyste – może być przydatne do naprawy chorych lub uszkodzonych tkanek lub może być wykorzystane do wyhodowania nowych narządów .
totipotencjalne to komórki macierzyste, które mogą dzielić się na dalsze komórki macierzyste lub różnicować się w dowolny typ komórek w organizmie, w tym w tkankę pozazarodkową.
pluripotencjalne to komórki macierzyste, które mogą różnicować się w dowolny typ komórek w organizmie z wyjątkiem tkanki pozazarodkowej. indukowane pluripotencjalne komórki macierzyste (iPSC) to podklasa pluripotencjalnych komórek macierzystych przypominających embrionalne komórki macierzyste (ESC), które pochodzą z dorosłych zróżnicowanych komórek. iPSC są tworzone poprzez zmianę ekspresji czynników transkrypcyjnych w dorosłych komórkach, aż staną się podobne do embrionalnych komórek macierzystych. [ potrzebne źródło ]
Multipotentne komórki macierzyste można różnicować w dowolne komórki należące do tej samej klasy, takie jak komórki krwi lub kości . Typowym przykładem komórek multipotencjalnych są mezenchymalne komórki macierzyste (MSC).
Rusztowania
Rusztowania to materiały, które zostały zaprojektowane tak, aby powodować pożądane interakcje komórkowe, przyczyniając się do tworzenia nowych funkcjonalnych tkanek do celów medycznych. Komórki są często „zasiewane” w te struktury zdolne do wspierania trójwymiarowej tkanki. Rusztowania naśladują macierz pozakomórkową tkanki natywnej, rekapitulując in vivo i umożliwiając komórkom wpływanie na ich własne mikrośrodowiska. Służą zwykle co najmniej jednemu z następujących celów: umożliwianie przyczepiania się i migracji komórek, dostarczanie i zatrzymywanie komórek i czynników biochemicznych, umożliwianie dyfuzji niezbędnych do życia składników odżywczych i produktów ulegających ekspresji oraz wywieranie pewnych wpływów mechanicznych i biologicznych w celu modyfikacji zachowania fazy komórkowej .
W 2009 roku interdyscyplinarny zespół kierowany przez torakochirurga Thorstena Wallesa z powodzeniem wszczepił pierwszy biosztuczny przeszczep, który zapewnia wrodzoną sieć naczyniową do zaopatrzenia przeszczepu po przeszczepie pacjentowi oczekującemu na rekonstrukcję tchawicy.

Aby osiągnąć cel odbudowy tkanek, rusztowania muszą spełniać określone wymagania. Wysoka porowatość i odpowiednia wielkość porów są niezbędne do ułatwienia zasiewania komórek i dyfuzji w całej strukturze zarówno komórek, jak i składników odżywczych. Biodegradowalność jest często istotnym czynnikiem, ponieważ rusztowania powinny być najlepiej wchłaniane przez otaczające tkanki bez konieczności ich chirurgicznego usuwania. Szybkość, z jaką następuje degradacja, musi w jak największym stopniu pokrywać się z tempem tworzenia się tkanki: oznacza to, że podczas gdy komórki wytwarzają wokół siebie swoją własną naturalną strukturę macierzy, rusztowanie jest w stanie zapewnić integralność strukturalną w organizmie i ostatecznie rozpadnie się pozostawiając nowo utworzoną tkankę, która przejmie obciążenia mechaniczne. Możliwość wstrzykiwania jest również ważna w zastosowaniach klinicznych. Ostatnie badania nad drukowaniem narządów pokazują, jak ważna jest dobra kontrola środowiska 3D, aby zapewnić powtarzalność eksperymentów i oferować lepsze wyniki.
Materiały
Dobór materiałów jest istotnym aspektem przy produkcji rusztowań. Stosowane materiały mogą być naturalne lub syntetyczne i mogą być biodegradowalne lub niebiodegradowalne. Dodatkowo muszą być biokompatybilne, co oznacza, że nie powodują żadnych niepożądanych skutków dla komórek. Na przykład silikon jest syntetycznym, nieulegającym biodegradacji materiałem powszechnie stosowanym jako materiał do dostarczania leków, podczas gdy żelatyna jest biodegradowalnym, naturalnym materiałem powszechnie stosowanym w rusztowaniach do hodowli komórkowych
Materiał potrzebny do każdego zastosowania jest inny i zależy od pożądanych właściwości mechanicznych materiału. Na przykład inżynieria tkankowa ubytków kości długich będzie wymagać sztywnego rusztowania o wytrzymałości na ściskanie podobnej do kości korowej (100-150 MPa), która jest znacznie wyższa w porównaniu z rusztowaniem do regeneracji skóry.
Istnieje kilka uniwersalnych materiałów syntetycznych używanych do wielu różnych zastosowań na rusztowaniach. Jednym z tych powszechnie stosowanych materiałów jest kwas polimlekowy (PLA), syntetyczny polimer. PLA – kwas polimlekowy. Jest to poliester, który rozkłada się w ludzkim ciele, tworząc kwas mlekowy , naturalnie występującą substancję chemiczną, która jest łatwo usuwana z organizmu. Podobnymi materiałami są kwas poliglikolowy (PGA) i polikaprolakton (PCL): ich mechanizm degradacji jest podobny do PLA, ale PCL degraduje się wolniej, a PGA degraduje się szybciej. [ potrzebne źródło ] PLA jest powszechnie łączony z PGA, tworząc kwas polimlekowy-ko-glikolowy (PLGA). Jest to szczególnie przydatne, ponieważ degradację PLGA można dostosować, zmieniając procenty wagowe PLA i PGA: więcej PLA – wolniejsza degradacja, więcej PGA – szybsza degradacja. Ta przestrajalność wraz z biokompatybilnością sprawia, że jest to niezwykle przydatny materiał do tworzenia rusztowań.
Rusztowania mogą być również zbudowane z materiałów naturalnych: w szczególności zbadano różne pochodne macierzy pozakomórkowej , aby ocenić ich zdolność do wspierania wzrostu komórek. Materiały na bazie białek – takie jak kolagen lub fibryna oraz materiały polisacharydowe – takie jak chitozan lub glikozaminoglikany (GAG), okazały się odpowiednie pod względem kompatybilności komórkowej. Wśród GAG kwas hialuronowy , ewentualnie w połączeniu ze środkami sieciującymi (np. aldehyd glutarowy , rozpuszczalny w wodzie karbodiimid , itp.), jest jednym z możliwych wyborów jako materiału na rusztowanie. Ze względu na kowalencyjne przyłączenie grup tiolowych do tych polimerów, mogą one sieciować poprzez tworzenie wiązań dwusiarczkowych. Zastosowanie tiolowanych polimerów ( tiomerów ) jako materiału na rusztowania w inżynierii tkankowej zostało po raz pierwszy zaprezentowane na 4th Central European Symposium on Pharmaceutical Technology w Wiedniu 2001. Ponieważ tiomery są biokompatybilne, wykazują właściwości naśladujące komórki i skutecznie wspierają proliferację i różnicowanie różnych typów komórek, są szeroko stosowane jako rusztowania w inżynierii tkankowej. Ponadto wykazano , że tiomery , takie jak tiolowany kwas hialuronowy i tiolowany chitozan , wykazują właściwości gojenia ran i są przedmiotem licznych badań klinicznych . Dodatkowo fragment białka macierzy pozakomórkowej, taki jak peptyd RGD , można sprzęgać z materiałem niebioaktywnym, aby promować przyleganie komórek. Inną formą rusztowania jest tkanka pozbawiona komórek. Jest to proces, w którym substancje chemiczne są wykorzystywane do ekstrakcji komórek z tkanek, pozostawiając jedynie macierz zewnątrzkomórkową. Ma to tę zaletę, że w pełni uformowana macierz jest specyficzna dla pożądanego typu tkanki. Jednak odcelulizowane rusztowanie może powodować problemy immunologiczne z wprowadzonymi w przyszłości komórkami.
Synteza
W literaturze opisano szereg różnych sposobów wytwarzania porowatych struktur do zastosowania jako rusztowania do inżynierii tkankowej. Każda z tych technik ma swoje zalety, ale żadna nie jest pozbawiona wad.
Samoorganizacja nanowłókien
Samoorganizacja molekularna jest jedną z niewielu metod tworzenia biomateriałów o właściwościach podobnych pod względem skali i składu chemicznego do właściwości naturalnej macierzy pozakomórkowej (ECM) in vivo , co jest kluczowym krokiem w kierunku inżynierii tkankowej złożonych tkanek. Co więcej, te hydrożelowe rusztowania wykazały wyższość w toksykologii in vivo i biokompatybilności w porównaniu z tradycyjnymi makro-rusztowaniami i materiałami pochodzenia zwierzęcego.
Technologie włókiennicze
Techniki te obejmują wszystkie podejścia, które z powodzeniem stosowano do wytwarzania siatek włókninowych z różnych polimerów . W szczególności włókninowe poliglikolidowe zostały przetestowane pod kątem zastosowań w inżynierii tkankowej: takie włókniste struktury okazały się przydatne do wzrostu różnych typów komórek. Główne wady są związane z trudnościami w uzyskaniu wysokiej porowatości i regularnych rozmiarów porów.
Odlewanie rozpuszczalnikowe i ługowanie cząstek stałych
Odlewanie rozpuszczalnikowe i ługowanie cząsteczkowe (SCPL) pozwala na preparację struktur o regularnej porowatości, ale o ograniczonej grubości. Najpierw polimer rozpuszcza się w odpowiednim rozpuszczalniku organicznym (np. kwas polimlekowy można rozpuścić w dichlorometanie ), następnie roztwór wlewa się do formy wypełnionej cząstkami porogenu. Takim porogenem może być sól nieorganiczna, taka jak chlorek sodu , kryształki sacharozy , kulki żelatynowe lub parafina kule. Wielkość cząstek porogenu wpłynie na wielkość porów rusztowania, podczas gdy stosunek polimeru do porogenu jest bezpośrednio skorelowany z wielkością porowatości końcowej struktury. Po odlaniu roztworu polimeru rozpuszczalnik pozostawia się do całkowitego odparowania, następnie strukturę kompozytową w formie zanurza się w kąpieli cieczy odpowiedniej do rozpuszczenia porogenu: wody w przypadku chlorku sodu, sacharozy i żelatyny lub alifatycznego rozpuszczalnik, taki jak heksan do stosowania z parafiną. Po całkowitym rozpuszczeniu porogenu uzyskuje się porowatą strukturę. Poza małym zakresem grubości, który można uzyskać, kolejną wadą SCPL jest stosowanie rozpuszczalników organicznych, które należy całkowicie usunąć, aby uniknąć jakiegokolwiek możliwego uszkodzenia komórek wysianych na rusztowaniu.
Pienienie gazu
Aby przezwyciężyć potrzebę stosowania rozpuszczalników organicznych i stałych porogenów, opracowano technikę wykorzystującą gaz jako porogen. W pierwszej kolejności wytwarza się struktury w kształcie krążków z pożądanego polimeru metodą formowania tłocznego z wykorzystaniem rozgrzanej formy. Krążki są następnie umieszczane w komorze, gdzie przez kilka dni są wystawione na działanie CO 2 pod wysokim ciśnieniem. Ciśnienie wewnątrz komory jest stopniowo przywracane do poziomu atmosferycznego. Podczas tej procedury pory są tworzone przez cząsteczki dwutlenku węgla, które opuszczają polimer, tworząc strukturę przypominającą gąbkę. Główne problemy wynikające z takiej techniki są spowodowane nadmiernym ciepłem stosowanym podczas formowania tłocznego (co uniemożliwia włączenie jakiegokolwiek materiału nietrwałego termicznie do matrycy polimerowej) oraz faktem, że pory nie tworzą wzajemnie połączonej struktury.
Liofilizacja emulgacyjna
Ta technika nie wymaga użycia stałego porogenu, takiego jak SCPL. Najpierw polimer syntetyczny rozpuszcza się w odpowiednim rozpuszczalniku (np. kwas polimlekowy w dichlorometanie), następnie do roztworu polimeru dodaje się wodę i miesza obie ciecze w celu uzyskania emulsji . Zanim dwie fazy mogą się rozdzielić, emulsję wlewa się do formy i szybko zamraża przez zanurzenie w ciekłym azocie . Zamrożoną emulsję następnie liofilizuje się w celu usunięcia rozproszonej wody i rozpuszczalnika, pozostawiając w ten sposób zestaloną, porowatą strukturę polimerową. Chociaż emulgowanie i liofilizacja pozwalają na szybsze przygotowanie w porównaniu z SCPL (ponieważ nie wymaga czasochłonnego etapu ługowania), nadal wymaga użycia rozpuszczalników. Ponadto rozmiar porów jest stosunkowo mały, a porowatość często nieregularna. Liofilizacja sama w sobie jest również powszechnie stosowaną techniką wytwarzania rusztowań. W szczególności służy do przygotowania gąbek kolagenowych: kolagen rozpuszcza się w kwaśnych roztworach kwasu octowego lub solnego które są wlewane do formy, zamrażane w ciekłym azocie, a następnie liofilizowane .
Rozdzielanie faz indukowane termicznie
Podobnie jak w poprzedniej technice, procedura separacji faz TIPS wymaga użycia rozpuszczalnika o niskiej temperaturze topnienia, który łatwo sublimuje. Na przykład dioksan można wykorzystać do rozpuszczenia kwasu polimlekowego, a następnie indukuje się rozdzielanie faz przez dodanie niewielkiej ilości wody: powstaje faza bogata w polimer i faza uboga w polimer. Po ochłodzeniu poniżej temperatury topnienia rozpuszczalnika i kilkudniowym suszeniu próżniowym w celu sublimacji rozpuszczalnika otrzymuje się porowate rusztowanie. Rozdzielanie faz ciecz-ciecz ma te same wady co emulgowanie/liofilizacja.
Elektroprzędzenie
Elektroprzędzenie to bardzo wszechstronna technika, którą można wykorzystać do wytwarzania ciągłych włókien o średnicy od kilku mikronów do kilku nanometrów. W typowej konfiguracji elektroprzędzenia pożądany materiał rusztowania rozpuszcza się w rozpuszczalniku i umieszcza w strzykawce. Roztwór ten jest podawany przez igłę, a do końcówki i przewodzącej powierzchni zbierającej przykładane jest wysokie napięcie. Nagromadzenie sił elektrostatycznych w roztworze powoduje, że wyrzuca on cienki włóknisty strumień w kierunku przeciwnie naładowanej lub uziemionej powierzchni zbiorczej. Podczas tego procesu rozpuszczalnik odparowuje, pozostawiając stałe włókna pozostawiając wysoce porowatą siatkę. Technika ta jest wysoce konfigurowalna, ze zmiennymi rozpuszczalnikami, napięciem, odległością roboczą (odległość od igły do powierzchni zbierania), szybkością przepływu roztworu, stężeniem substancji rozpuszczonej i powierzchnią zbierania. Pozwala to na precyzyjną kontrolę morfologii włókien.
na poziomie komercyjnym , ze względu na skalowalność, jednocześnie zaangażowanych jest 40, a czasem 96 igieł. Wąskie gardła w takich konfiguracjach to: 1) Utrzymanie wyżej wymienionych zmiennych jednakowo dla wszystkich igieł oraz 2) tworzenie „kuleczek” w pojedynczych włóknach, które my, inżynierowie, chcemy mieć jednakową średnicę. Modyfikując zmienne, takie jak odległość do kolektora, wielkość przyłożonego napięcia lub szybkość przepływu roztworu, badacze mogą radykalnie zmienić ogólną architekturę rusztowania.
Historycznie rzecz biorąc, badania nad elektroprzędzonymi rusztowaniami włóknistymi sięgają przynajmniej końca lat 80 . podłoża komórkowe i tkankowe. To wczesne zastosowanie sieci elektroprzędzonych w hodowli komórkowej i inżynierii tkankowej wykazało, że różne typy komórek przylegają do włókien poliwęglanowych i namnażają się na nich. Zauważono, że w przeciwieństwie do spłaszczonej morfologii typowo obserwowanej w hodowli 2D, komórki hodowane na włóknach elektroprzędzonych wykazywały bardziej zaokrągloną trójwymiarową morfologię, ogólnie obserwowaną w tkankach in vivo .
technologie CAD/CAM
Ponieważ większość z powyższych technik jest ograniczona, jeśli chodzi o kontrolę porowatości i wielkości porów, do inżynierii tkankowej wprowadzono wspomagane komputerowo techniki projektowania i wytwarzania . Najpierw za pomocą oprogramowania CAD projektowana jest trójwymiarowa struktura. Porowatość można dostosować za pomocą algorytmów w oprogramowaniu. Rusztowanie jest następnie realizowane za pomocą drukowania atramentowego proszków polimerowych lub poprzez modelowanie stopionego polimeru.
Badanie z 2011 roku przeprowadzone przez El-Ayoubi i in. zbadali „technikę kreślenia 3D w celu wytworzenia ( biokompatybilnych i biodegradowalnych ) makroporowatych rusztowań poli-L-laktydowych z dwoma różnymi rozmiarami porów” poprzez wytwarzanie stałych swobodnych form (SSF) z projektowaniem wspomaganym komputerowo (CAD), w celu zbadania terapeutycznej chrząstki stawowej zastąpienie jako „alternatywa dla konwencjonalnej naprawy tkanek”. Badanie wykazało, że im mniejszy rozmiar porów w połączeniu z obciążeniem mechanicznym w bioreaktorze (w celu wywołania warunków podobnych do in vivo), tym wyższa żywotność komórek w potencjalnej funkcjonalności terapeutycznej poprzez skrócenie czasu rekonwalescencji i zwiększenie skuteczności przeszczepu.
Biodrukowanie wspomagane laserem
W badaniu z 2012 roku Koch i in. koncentruje się na tym, czy biodrukowanie wspomagane laserem (LaBP) może być wykorzystywane do budowania wielokomórkowych wzorów 3D w naturalnej macierzy oraz czy wygenerowane konstrukty funkcjonują i tworzą tkankę. LaBP układa małe objętości zawiesin żywych komórek w ustalone wzorce o wysokiej rozdzielczości. Badanie zakończyło się sukcesem, naukowcy przewidują, że „wygenerowane konstrukty tkankowe mogą być wykorzystane do in vivo poprzez wszczepienie ich do modeli zwierzęcych ” (14). W tym badaniu zsyntetyzowano tylko ludzką tkankę skórną, chociaż naukowcy przewidują, że „poprzez integrację dalszych typów komórek (np. melanocyty , komórki Schwanna , komórki mieszków włosowych) do wydrukowanego konstruktu komórkowego, można przeanalizować zachowanie tych komórek w trójwymiarowym mikrośrodowisku in vitro podobnym do ich naturalnego”, co jest przydatne do odkrywania leków i badań toksykologicznych .
Samoorganizujące się rekombinowane nanomembrany z pajęczego jedwabiu
Gustafsson i in. wykazali wolnostojące, bioaktywne membrany o powierzchni cm, ale grubości zaledwie 250 nm, które powstały w wyniku samoorganizacji pajęczej nici na granicy faz roztworu wodnego. Membrany w unikalny sposób łączą nanoskalową grubość, biodegradowalność, ultrawysokie naprężenia i wytrzymałość, przepuszczalność dla białek oraz sprzyjają szybkiemu przyleganiu i proliferacji komórek. Wykazali wzrost spójnej warstwy keratynocytów. Te nanomembrany z pajęczego jedwabiu zostały również wykorzystane do stworzenia statycznego modelu naczynia krwionośnego in vitro .
Metody montażu
Stałym problemem inżynierii tkankowej są ograniczenia transportu masowego. Zmodyfikowane tkanki generalnie nie mają początkowego dopływu krwi, co utrudnia jakimkolwiek wszczepionym komórkom uzyskanie wystarczającej ilości tlenu i składników odżywczych, aby przetrwać lub prawidłowo funkcjonować.
Samodzielny montaż
Wykazano, że metody samoorganizacji są obiecującymi metodami inżynierii tkankowej. Metody samoorganizacji mają tę zaletę, że umożliwiają tkankom rozwój własnej macierzy pozakomórkowej, w wyniku czego tkanka lepiej oddaje biochemiczne i biomechaniczne właściwości tkanki natywnej. Samoskładająca się chrząstka stawowa została wprowadzona przez Jerry'ego Hu i Kyriacosa A. Athanasiou w 2006 r. i zastosowania tego procesu zaowocowały sztuczną chrząstką zbliżoną do wytrzymałości natywnej tkanki. Samoorganizacja to najlepsza technologia umożliwiająca komórkom wyhodowanym w laboratorium łączenie się w trójwymiarowe kształty. Aby rozbić tkanki na komórki, badacze muszą najpierw rozpuścić macierz zewnątrzkomórkową, która normalnie je łączy. Po wyizolowaniu komórki muszą utworzyć złożone struktury, które tworzą nasze naturalne tkanki.
Montaż szablonów na bazie cieczy
Powierzchnia powietrze-ciecz ustanowiona przez fale Faradaya jest badana jako szablon do składania jednostek biologicznych do oddolnej inżynierii tkankowej. Ten płynny szablon można dynamicznie rekonfigurować w ciągu kilku sekund, a montaż na szablonie można osiągnąć w sposób skalowalny i równoległy. Zademonstrowano składanie hydrożeli w mikroskali, komórek, kulek mikronośników z nasionami neuronów, sferoidów komórkowych w różne symetryczne i okresowe struktury z dobrą żywotnością komórek. Utworzenie trójwymiarowej sieci neuronowej osiągnięto po 14-dniowej hodowli tkankowej.
Produkcja dodatkowa
Być może możliwe będzie drukowanie narządów, a nawet całych organizmów przy użyciu technik wytwarzania przyrostowego . Najnowsza innowacyjna metoda konstrukcji wykorzystuje mechanizm atramentowy do drukowania precyzyjnych warstw komórek w matrycy termoodwracalnego żelu. Komórki śródbłonka, komórki wyściełające naczynia krwionośne, zostały wydrukowane w zestawie ułożonych w stos pierścieni. Po inkubacji łączyły się w rurkę. Ta technika jest określana w tej dziedzinie jako „bioprinting”, ponieważ obejmuje drukowanie składników biologicznych w strukturze przypominającej narząd skupienia.
Dziedzina trójwymiarowych i bardzo dokładnych modeli systemów biologicznych jest pionierska dzięki licznym projektom i technologiom, w tym szybkiej metodzie tworzenia tkanek, a nawet całych narządów, wykorzystującej drukarkę 3D, która może biodrukować rusztowanie i komórki warstwa po warstwie w działająca próbka tkanki lub narządu. Urządzenie zostało zaprezentowane w przemówieniu TED przez dr Anthony'ego Atala, MD, dyrektora Instytutu Medycyny Regeneracyjnej Wake Forest oraz profesora WH Boyce'a i kierownika Katedry Urologii na Uniwersytecie Wake Forest, w którym nerka jest drukowana na scenie podczas seminarium, a następnie prezentowana publiczności. Przewiduje się, że technologia ta umożliwi w przyszłości produkcję wątroby do przeszczepów, a także teoretycznie do badań toksykologicznych i innych badań biologicznych.
Niedawno w eksperymentach in vivo wykorzystano przetwarzanie wielofotonowe (MPP) poprzez inżynierię konstruktów sztucznej chrząstki. Badanie histologiczne ex vivo wykazało, że pewna geometria porów i wstępny wzrost chondrocytów (Cho) przed implantacją znacznie poprawiają wydajność tworzonych trójwymiarowych rusztowań. Uzyskana biokompatybilność była porównywalna z dostępnymi na rynku membranami kolagenowymi. Pomyślny wynik tego badania potwierdza ideę, że hybrydowe organiczno-nieorganiczne mikrostrukturalne rusztowania w kształcie sześciokątnych porów w połączeniu z wysiewem Cho mogą być z powodzeniem wdrażane do inżynierii tkanki chrzęstnej.
Rusztowanie
W 2013 roku przy użyciu trójwymiarowego rusztowania Matrigel w różnych konfiguracjach wyprodukowano in vitro istotne organoidy trzustki. Skupiska niewielkiej liczby komórek rozmnożyły się do 40 000 komórek w ciągu jednego tygodnia. Klastry przekształcają się w komórki, które wytwarzają enzymy trawienne lub hormony , takie jak insulina , samoorganizujące się w rozgałęzione organoidy trzustkowe, które przypominają trzustkę.
Komórki są wrażliwe na środowisko, takie jak sztywność żelu i kontakt z innymi komórkami. Poszczególne komórki nie rozwijają się; do późniejszego rozwoju organoidów wymagane były co najmniej cztery najbliższe komórki. Modyfikacje składu pożywki spowodowały wydrążone kulki składające się głównie z komórek progenitorowych trzustki lub złożone organoidy, które spontanicznie przechodzą morfogenezę i różnicowanie trzustki. Utrzymanie i ekspansja komórek progenitorowych trzustki wymaga aktywnej sygnalizacji Notch i FGF , rekapitulacji niszowych interakcji sygnalizacyjnych in vivo.
Organoidy były postrzegane jako potencjalnie oferujące mini-narządy do testowania leków i zapasowe komórki produkujące insulinę.
Oprócz rusztowań Matrigel 3-D opracowano inne systemy żelów kolagenowych. Rusztowania z kolagenu/kwasu hialuronowego zostały wykorzystane do modelowania gruczołu sutkowego in vitro podczas współhodowli komórek nabłonka i adipocytów. Zestaw HyStem to kolejna trójwymiarowa platforma zawierająca komponenty ECM i kwas hialuronowy, która została wykorzystana do badań nad rakiem. Ponadto składniki hydrożelu można modyfikować chemicznie, aby wspomóc sieciowanie i poprawić ich właściwości mechaniczne.
Hodowli tkankowej
W wielu przypadkach tworzenie funkcjonalnych tkanek i struktur biologicznych in vitro wymaga intensywnej hodowli w celu promowania przeżycia, wzrostu i indukcji funkcjonalności. Ogólnie rzecz biorąc, w hodowli muszą być zachowane podstawowe wymagania komórek, które obejmują tlen , pH , wilgotność , temperaturę , składniki odżywcze i utrzymanie ciśnienia osmotycznego .
Kultury inżynierii tkankowej stwarzają również dodatkowe problemy w utrzymaniu warunków hodowli. W standardowej hodowli komórkowej dyfuzja jest często jedynym środkiem transportu składników odżywczych i metabolitów. Jednak gdy kultura staje się coraz większa i bardziej złożona, tak jak w przypadku modyfikowanych narządów i całych tkanek, do utrzymania kultury należy zastosować inne mechanizmy, takie jak tworzenie sieci naczyń włosowatych w tkance.
Innym problemem związanym z kulturą tkankową jest wprowadzenie odpowiednich czynników lub bodźców wymaganych do wywołania funkcjonalności. W wielu przypadkach prosta kultura konserwacji nie wystarcza. Czasami wymagane są czynniki wzrostu , hormony , określone metabolity lub składniki odżywcze, bodźce chemiczne i fizyczne. Na przykład niektóre komórki reagują na zmiany ciśnienia tlenu w ramach ich normalnego rozwoju, na przykład chondrocyty , które muszą przystosować się do warunków niskiego poziomu tlenu lub niedotlenienia podczas rozwoju szkieletu. Inne, takie jak komórki śródbłonka, reagują na naprężenia ścinające z przepływu płynu, który występuje w naczyniach krwionośnych . Bodźce mechaniczne, takie jak impulsy ciśnienia, wydają się być korzystne dla wszystkich rodzajów tkanek układu sercowo-naczyniowego, takich jak zastawki serca, naczynia krwionośne czy osierdzie.
Bioreaktory
W inżynierii tkankowej bioreaktor to urządzenie, które próbuje symulować środowisko fizjologiczne w celu promowania wzrostu komórek lub tkanek in vitro. Środowisko fizjologiczne może składać się z wielu różnych parametrów, takich jak temperatura, ciśnienie, stężenie tlenu lub dwutlenku węgla czy osmolalność płynnego środowiska i może rozciągać się na wszelkiego rodzaju bodźce biologiczne, chemiczne lub mechaniczne. Dlatego istnieją systemy, które mogą obejmować przykładanie do tkanki sił, takich jak siły elektromagnetyczne, ciśnienia mechaniczne lub ciśnienie płynu. Systemy te mogą być konfiguracjami dwu- lub trójwymiarowymi. Bioreaktory mogą być wykorzystywane zarówno w zastosowaniach akademickich, jak i przemysłowych. Komercyjnie dostępne są również bioreaktory do ogólnego zastosowania i specyficznego zastosowania, które mogą zapewniać statyczną stymulację chemiczną lub kombinację stymulacji chemicznej i mechanicznej.
Na proliferację i różnicowanie komórek duży wpływ mają mechaniczne i biochemiczne sygnały otaczającego środowiska macierzy zewnątrzkomórkowej . Bioreaktory są zwykle opracowywane w celu odtworzenia specyficznego środowiska fizjologicznego hodowanej tkanki (np. zginanie i ścinanie płynów w celu wzrostu tkanki serca). Może to pozwolić wyspecjalizowanym liniom komórkowym rozwijać się w kulturach replikujących ich natywne środowiska, ale także sprawia, że bioreaktory są atrakcyjnymi narzędziami do hodowli komórek macierzystych . Udany bioreaktor oparty na komórkach macierzystych jest skuteczny w namnażaniu komórek macierzystych o jednolitych właściwościach i/lub promowaniu kontrolowanego, powtarzalnego różnicowania w wybrane dojrzałe typy komórek.
Istnieje wiele bioreaktorów przeznaczonych do hodowli komórkowych 3D. Istnieją małe plastikowe cylindryczne komory, a także komory szklane z regulowaną wilgotnością wewnętrzną i wilgotnością specjalnie zaprojektowaną do celów wzrostu komórek w trzech wymiarach. Bioreaktor wykorzystuje bioaktywne materiały syntetyczne, takie jak membrany z politereftalanu etylenu, aby otoczyć sferoidalne komórki w środowisku, które utrzymuje wysoki poziom składników odżywczych. Można je łatwo otwierać i zamykać, dzięki czemu sferoidy komórkowe można wyjąć do testów, a jednocześnie komora jest w stanie utrzymać 100% wilgotności przez cały czas. Ta wilgotność jest ważna dla osiągnięcia maksymalnego wzrostu i funkcjonowania komórek. Komora bioreaktora jest częścią większego urządzenia, które obraca się, aby zapewnić równy wzrost komórek w każdym kierunku w trzech wymiarach.
Firma QuinXell Technologies, obecnie podlegająca firmie Quintech Life Sciences z Singapuru , opracowała bioreaktor znany jako bioreaktor dwuosiowy TisXell , który został specjalnie zaprojektowany do celów inżynierii tkankowej. Jest to pierwszy bioreaktor na świecie, który ma sferyczną szklaną komorę z dwuosiową rotacją; w szczególności do naśladowania rotacji płodu w łonie matki; co zapewnia sprzyjające środowisko do wzrostu tkanek.
W jednym bioreaktorze połączono również wiele form mechanicznej stymulacji. Wykorzystując analizę ekspresji genów, jedno z badań akademickich wykazało, że zastosowanie kombinacji cyklicznego szczepu i stymulacji ultradźwiękami do komórek pre-osteoblastycznych w bioreaktorze przyspieszyło dojrzewanie i różnicowanie macierzy. Technologia tego połączonego bioreaktora stymulującego może zostać wykorzystana do szybszego i skuteczniejszego wzrostu komórek kostnych w przyszłych klinicznych terapiach komórkami macierzystymi.
Firma MC2 Biotek opracowała również bioreaktor znany jako ProtoTissue, który wykorzystuje wymianę gazową do utrzymania wysokiego poziomu tlenu w komorze komórkowej; ulepszenie poprzednich bioreaktorów, ponieważ wyższy poziom tlenu pomaga komórce rosnąć i przechodzić normalne oddychanie komórkowe .
Aktywne obszary badań nad bioreaktorami obejmują zwiększanie skali produkcji i udoskonalanie środowiska fizjologicznego, które mogą poprawić wydajność i skuteczność bioreaktorów w badaniach lub zastosowaniach klinicznych. Bioreaktory są obecnie wykorzystywane do badania między innymi terapii na poziomie komórkowym i tkankowym, reakcji komórek i tkanek na określone zmiany środowiska fizjologicznego oraz rozwoju chorób i urazów.
Generacja długich włókien
wielkości rzędu 100 µm . Włókna te zostały utworzone przy użyciu urządzenia mikroprzepływowego , które tworzy podwójny współosiowy przepływ laminarny. Każda „warstwa” urządzenia mikroprzepływowego (komórki zaszczepione w ECM , otoczka hydrożelowa, a na końcu roztwór chlorku wapnia). Zasiane komórki hoduje się w osłonce hydrożelowej przez kilka dni, a następnie osłonkę usuwa się wraz z żywymi włóknami komórkowymi. Do rdzenia ECM wprowadzono różne typy komórek, w tym miocyty , komórki śródbłonka , włókna komórek nerwowych i włókna komórek nabłonka . Ta grupa wykazała następnie, że włókna te mogą być splatane razem w celu wytworzenia tkanek lub organów w mechanizmie podobnym do tkania tekstyliów . Włókniste morfologie są korzystne, ponieważ stanowią alternatywę dla tradycyjnego projektu rusztowania, a wiele narządów (takich jak mięśnie) składa się z komórek włóknistych.
Biosztuczne narządy
Sztuczny narząd to skonstruowane urządzenie, które może być pozacielesne lub wszczepione w celu podtrzymania upośledzonych lub niesprawnych układów narządów. Biosztuczne narządy są zwykle tworzone z zamiarem przywrócenia krytycznych funkcji biologicznych, takich jak zastąpienie chorych serc i płuc, lub zapewnienia drastycznej poprawy jakości życia, jak w przypadku stosowania inżynierii skóry na ofiarach poparzeń. Podczas gdy niektóre przykłady biosztucznych narządów są nadal na etapie badań ze względu na ograniczenia związane z tworzeniem narządów funkcjonalnych, inne są obecnie wykorzystywane w warunkach klinicznych w celach eksperymentalnych i komercyjnych.
Płuco
do pozaustrojowego utlenowania membrany (ECMO), znane również jako maszyny serca i płuc, są adaptacją technik krążenia pozaustrojowego , które zapewniają wsparcie serca i płuc. Służy przede wszystkim do wspomagania płuc przez dłuższy, ale wciąż tymczasowy okres (1–30 dni) i umożliwia powrót do zdrowia po odwracalnych chorobach. Robert Bartlett znany jako ojciec ECMO, pierwszy zabieg u noworodka wykonał aparatem EMCO w 1975 roku.
Skóra
Skóra z inżynierii tkankowej to rodzaj biosztucznego narządu, który jest często stosowany w leczeniu oparzeń, owrzodzeń stopy cukrzycowej lub innych dużych ran, które nie mogą się dobrze zagoić. Sztuczna skóra może być wykonana z autoprzeszczepów, alloprzeszczepów i heteroprzeszczepów. Skóra autoprzeszczepiona pochodzi z własnej skóry pacjenta, co pozwala skórze właściwej na szybsze gojenie, a miejsce pobrania można pobrać kilka razy. Skóra alloprzeszczepu często pochodzi ze skóry zwłok i jest najczęściej stosowana w leczeniu ofiar oparzeń. Wreszcie ksenoprzeszczep skóry pochodzi od zwierząt i zapewnia tymczasową strukturę gojącą dla skóry. Pomagają w regeneracji skóry, ale nie mogą stać się częścią skóry żywiciela. Skóra z inżynierii tkankowej jest teraz dostępna w produktach komercyjnych. Integra, pierwotnie używana tylko do leczenia oparzeń, składa się z matrycy kolagenowej i siarczanu chondroityny, który może być stosowany jako zamiennik skóry. Siarczan chondroityny jest składnikiem proteoglikanów, które pomagają w tworzeniu macierzy pozakomórkowej. Integra może być ponownie zasiedlana i rewaskularyzowana, zachowując swoją skórną architekturę kolagenu, co czyni ją sztucznym narządem. Te fibroblasty namnażają się i wytwarzają czynniki wzrostu, kolagen i białka ECM, które pomagają budować tkankę ziarninową.
Serce
Ponieważ liczba pacjentów oczekujących na przeszczep serca stale rośnie, a liczba pacjentów na listach oczekujących przekracza dostępność narządów, sztuczne narządy stosowane jako terapia zastępcza w terminalnej niewydolności serca pomogłyby złagodzić ten problem. Sztuczne serca są zwykle używane do pomostowania przeszczepu serca lub mogą być stosowane jako terapia zastępcza w przypadku terminalnej niewydolności serca. Całkowite sztuczne serce (TAH), wprowadzone po raz pierwszy przez dr Władimira P. Demichowa w 1937 r., stało się idealną alternatywą. Od tego czasu została opracowana i ulepszona jako pompa mechaniczna, która zapewnia długotrwałe wspomaganie krążenia i zastępuje chore lub uszkodzone komory serca, które nie mogą prawidłowo pompować krwi, przywracając w ten sposób przepływ płucny i ogólnoustrojowy. Niektóre z obecnych TAH obejmują AbioCor, urządzenie zatwierdzone przez FDA, które składa się z dwóch sztucznych komór i ich zastawek i nie wymaga połączeń podskórnych i jest wskazane dla pacjentów z dwukomorową niewydolnością serca. W 2010 roku SynCardia wypuściła przenośny sterownik wolności, który umożliwia pacjentom posiadanie przenośnego urządzenia bez konieczności przebywania w szpitalu.
Nerka
Chociaż przeszczepy nerek są możliwe, niewydolność nerek jest częściej leczona za pomocą sztucznej nerki. Pierwsze sztuczne nerki i większość obecnie używanych są pozaustrojowe, na przykład z hemodializą, która bezpośrednio filtruje krew, lub dializą otrzewnową, która filtruje przez płyn w jamie brzusznej. Aby przyczynić się do biologicznych funkcji nerki, takich jak wytwarzanie czynników metabolicznych lub hormonów, niektóre sztuczne nerki zawierają komórki nerkowe. Poczyniono postępy w zmniejszaniu tych urządzeń i ułatwianiu ich transportu, a nawet wszczepiania . Jednym z wyzwań, z którymi trzeba się jeszcze zmierzyć w tych mniejszych urządzeniach, jest przeciwdziałanie ograniczonej objętości, a tym samym ograniczonym możliwościom filtrowania.
Wprowadzono również biorusztowania, aby zapewnić ramy, na których można zregenerować normalną tkankę nerki. Rusztowania te obejmują rusztowania naturalne (np. odkomórkowione nerki, hydrożel kolagenowy lub fibroina jedwabiu), rusztowania syntetyczne (np. poli[kwas mlekowy-ko-glikolowy] lub inne polimery) lub kombinację dwóch lub większej liczby rusztowań naturalnych i syntetycznych. Rusztowania te można wszczepiać do organizmu bez leczenia komórkami lub po okresie wysiewania i inkubacji komórek macierzystych. Prowadzone są badania in vitro i in vivo w celu porównania i optymalizacji rodzaju rusztowania oraz oceny, czy wysiewanie komórek przed implantacją zwiększa żywotność, regenerację i efektywne funkcjonowanie nerek. W niedawnym przeglądzie systematycznym i metaanalizie porównano wyniki opublikowanych badań na zwierzętach i stwierdzono, że lepsze wyniki odnotowano przy zastosowaniu hybrydowych (mieszanych) rusztowań i wysiania komórek; jednak metaanaliza tych wyników nie była zgodna z oceną opisowych wyników przeglądu. Dlatego wskazane są dalsze badania z udziałem większych zwierząt i nowych rusztowań oraz bardziej przejrzyste odtworzenie poprzednich badań.
Biomimetyka
Biomimetyka to dziedzina, której celem jest wytwarzanie materiałów i systemów replikujących te obecne w naturze. W kontekście inżynierii tkankowej jest to powszechne podejście stosowane przez inżynierów do tworzenia materiałów do tych zastosowań, które są porównywalne z tkankami natywnymi pod względem struktury, właściwości i biokompatybilności. Właściwości materiału w dużej mierze zależą od właściwości fizycznych, strukturalnych i chemicznych tego materiału. Następnie biomimetyczne podejście do projektowania systemów stanie się istotne w integracji materiałów i konieczne będzie wystarczające zrozumienie procesów i interakcji biologicznych. Replikacja systemów i procesów biologicznych może być również wykorzystana w syntezie materiałów inspirowanych biologią w celu uzyskania warunków, które wytwarzają pożądany materiał biologiczny. Dlatego, jeśli syntetyzowany jest materiał mający te same cechy tkanek biologicznych, zarówno strukturalnie, jak i chemicznie, to w idealnym przypadku zsyntetyzowany materiał będzie miał podobne właściwości. Technika ta ma bogatą historię, wywodzącą się z idei wykorzystania zjawisk naturalnych jako inspiracji projektowych dla rozwiązań ludzkich problemów. Wiele nowoczesnych osiągnięć technologicznych zostało zainspirowanych naturą i systemami naturalnymi, w tym samolotami, samochodami, architekturą, a nawet systemami przemysłowymi. Postępy w nanotechnologii zapoczątkowały zastosowanie tej techniki do mikro- i w skali nano , w tym inżynierii tkankowej. Technika ta została wykorzystana do opracowania syntetycznych tkanek kostnych, technologii naczyniowych, materiałów na rusztowania i technik integracji oraz funkcjonalizowanych nanocząstek.
Konstruowanie sieci neuronowych w miękkim materiale
W 2018 roku naukowcy z Brandeis University opisali swoje badania nad miękkim materiałem osadzonym w sieciach chemicznych, które mogą naśladować gładkie i skoordynowane zachowanie tkanki nerwowej. Badania te zostały sfinansowane przez Laboratorium Badawcze Armii Stanów Zjednoczonych . Badacze zaprezentowali eksperymentalny system sieci neuronowych, teoretycznie modelowany jako układy reakcyjno-dyfuzyjne . W sieci znajdował się szereg wzorzystych reaktorów, z których każdy przeprowadzał Biełousowa-Żabotyńskiego (BZ). Reaktory te mogą działać w skali nanolitrowej.
Naukowcy twierdzą, że inspiracją dla ich projektu był ruch węgorza błękitnego . Ruchy węgorza są kontrolowane przez impulsy elektryczne określone przez klasę sieci neuronowych zwaną centralnym generatorem wzorców . Centralne generatory wzorców działają w autonomicznym układzie nerwowym, kontrolując funkcje organizmu, takie jak oddychanie, ruch i perystaltyka .
Cechy zaprojektowanego reaktora obejmowały topologię sieci, warunki brzegowe , warunki początkowe, objętość reaktora, siłę sprzężenia i polaryzację synaptyczną reaktora (czy jego zachowanie jest hamujące, czy pobudzające). Zaprojektowano układ emulsyjny BZ ze stałym elastomerem polidimetylosiloksanem (PDMS). Zarówno światło, jak i brom przepuszczalny PDMS zostały zgłoszone jako realne metody tworzenia rozrusznika serca dla sieci neuronowych.
Rynek
Historię rynku inżynierii tkankowej można podzielić na trzy główne części. Czas przed krachem rynku biotechnologii na początku lat 2000, krach i czas po nim.
Początek
Większość wczesnych postępów w badaniach inżynierii tkankowej dokonano w Stanach Zjednoczonych. Wynika to z mniej restrykcyjnych przepisów dotyczących badań nad komórkami macierzystymi i większej dostępności środków finansowych niż w innych krajach. Prowadzi to do powstawania akademickich startupów, z których wiele wywodzi się z Harvardu czy MIT . Przykładami są BioHybrid Technologies, których założyciel, Bill Chick, studiował w Harvard Medical School i skupił się na stworzeniu sztucznej trzustki. Innym przykładem może być firma Organogenesis Inc., której założyciel poszedł do MIT i pracował nad produktami do inżynierii skóry. Inne firmy powiązane z MIT to TEI Biosciences, Therics i Guilford Pharmaceuticals. Ponowne zainteresowanie biotechnologiami w latach 80. sprawia, że wielu prywatnych inwestorów inwestuje w te nowe technologie, mimo że modele biznesowe tych wczesnych start-upów często nie były bardzo jasne i nie przedstawiały ścieżki do długoterminowej rentowności. Sponsorzy rządowi byli bardziej powściągliwi w finansowaniu, ponieważ inżynierię tkankową uważano za inwestycję wysokiego ryzyka.
W Wielkiej Brytanii rynek wystartował wolniej, mimo że przepisy dotyczące badań nad komórkami macierzystymi również nie były surowe. Wynika to głównie z mniejszej skłonności inwestorów do inwestowania w te nowe technologie, które uznano za inwestycje wysokiego ryzyka. Innym problemem, przed którym stanęły brytyjskie firmy, było skłonienie NHS do zapłaty za ich produkty. Dzieje się tak zwłaszcza dlatego, że NHS przeprowadza analizę opłacalności wszystkich obsługiwanych produktów. Nowe technologie często nie radzą sobie pod tym względem dobrze.
W Japonii sytuacja regulacyjna była zupełnie inna. Pierwsza hodowla komórek była dozwolona tylko w warunkach szpitalnych, a drugim naukowcom akademickim zatrudnionym przez państwowe uniwersytety nie wolno było zatrudniać się poza nią aż do 1998 roku. Co więcej, japońskie władze potrzebowały więcej czasu na zatwierdzenie nowych leków i metod leczenia niż ich amerykańskie i europejskie odpowiedniki.
Z tych powodów na początku japońskiego rynku koncentrowano się głównie na pozyskiwaniu produktów, które zostały już zatwierdzone w innych częściach Japonii i ich sprzedaży. W przeciwieństwie do rynku amerykańskiego, pierwszymi podmiotami w Japonii były głównie duże firmy lub spółki zależne takich dużych firm, jak J-TEC, Menicon i Terumo, a nie małe start-upy. Po zmianach regulacyjnych w 2014 roku, które pozwoliły na hodowlę komórek poza szpitalem, tempo badań w Japonii wzrosło, a japońskie firmy również zaczęły opracowywać własne produkty.
Rozbić się
Wkrótce po wielkim boomie zaczęły pojawiać się pierwsze problemy. Wystąpiły problemy z uzyskaniem zatwierdzenia produktów przez FDA , a jeśli zostały one zatwierdzone, często występowały trudności z nakłonieniem ubezpieczycieli do zapłaty za produkty i zaakceptowaniem ich przez pracowników służby zdrowia.
Na przykład organogeneza napotkała problemy ze sprzedażą swojego produktu i integracją jego produktu z systemem opieki zdrowotnej. Częściowo wynika to z trudności w obchodzeniu się z żywymi komórkami i zwiększonymi trudnościami napotykanymi przez lekarzy przy stosowaniu tych produktów w porównaniu z metodami konwencjonalnymi.
Innym przykładem może być produkt firmy Advanced Tissue Sciences Dermagraft, który nie byłby w stanie stworzyć wystarczająco wysokiego popytu bez zwrotu kosztów ze strony ubezpieczycieli. Powodem tego była cena 4000 dolarów i okoliczność, że firma Extra Advanced Tissue Sciences walczyła o to, by ich produkt był znany lekarzom.
Powyższe przykłady pokazują, jak firmy walczyły o zysk. To z kolei powoduje, że inwestorzy tracą cierpliwość i wstrzymują dalsze finansowanie. W rezultacie kilka firm zajmujących się inżynierią tkankową, takich jak Organogenesis i Advanced Tissue Sciences, ogłosiło upadłość na początku XXI wieku. W tamtym czasie jako jedyni mieli na rynku komercyjne produkty do pielęgnacji skóry.
Ponowne pojawienie się
Technologie upadłych lub borykających się z trudnościami firm były często kupowane przez inne firmy, które kontynuowały rozwój w ramach bardziej konserwatywnych modeli biznesowych. Przykładami firm, które sprzedawały swoje produkty po złożeniu były Curis i Intercytex.
Wiele firm porzuciło swoje długoterminowe cele rozwoju w pełni funkcjonalnych narządów na rzecz produktów i technologii, które mogą przynieść zysk w krótkim okresie. Przykładami tego rodzaju produktów są produkty z branży kosmetycznej i testowej.
W innych przypadkach, jak np. Advanced Tissue Sciences, założyciele zakładali nowe firmy.
W 2010 roku ramy regulacyjne zaczęły również ułatwiać szybsze wprowadzanie na rynek, zwłaszcza w Stanach Zjednoczonych, ponieważ FDA stworzyła nowe centra i ścieżki specjalnie ukierunkowane na produkty pochodzące z żywych komórek, takie jak Centrum Oceny i Badań Biologicznych .
Pierwsze produkty inżynierii tkankowej zaczęły przynosić zyski komercyjne w 2010 roku.
Rozporządzenie
W Europie przepisy są obecnie podzielone na trzy obszary: wyroby medyczne , produkty lecznicze i produkty biologiczne . Produkty inżynierii tkankowej często mają charakter hybrydowy, ponieważ często składają się z komórek i struktury nośnej. Podczas gdy niektóre produkty mogą zostać zatwierdzone jako produkty lecznicze, inne muszą zostać zatwierdzone jako wyroby medyczne. Derksen wyjaśnia w swojej pracy, że badacze zajmujący się inżynierią tkankową są czasami konfrontowani z regulacjami, które nie odpowiadają charakterystyce inżynierii tkankowej.
W Europie zaobserwowano nowe systemy regulacyjne, które rozwiązują te problemy. Wyjaśnieniem trudności w znalezieniu konsensusu regulacyjnego w tej sprawie jest badanie przeprowadzone w Wielkiej Brytanii. Autorzy przypisują te problemy bliskiemu pokrewieństwu i nakładaniu się z innymi technologiami, takimi jak ksenotransplantacja . Dlatego nie może być rozpatrywany oddzielnie przez organy regulacyjne. Regulacja jest dodatkowo komplikowana przez kontrowersje etyczne związane z tą i pokrewnymi dziedzinami badań (np. kontrowersje dotyczące komórek macierzystych , etyka przeszczepiania narządów ). To samo badanie, o którym mowa powyżej, pokazuje na przykładzie autologicznego przeszczepu chrząstki, że określona technologia może być uznana za „czystą” lub „zanieczyszczoną” przez tego samego aktora społecznego.
Dwa ruchy regulacyjne mają największe znaczenie dla inżynierii tkankowej w Unii Europejskiej . Są to dyrektywa w sprawie norm jakości i bezpieczeństwa w zakresie pozyskiwania i przetwarzania tkanek ludzkich przyjęta przez Parlament Europejski w 2004 r. oraz proponowane rozporządzenie w sprawie komórek i produktów inżynierii tkankowej. Ten ostatni został opracowany pod kierunkiem Dyrekcji Generalnej ds. Przedsiębiorstw Komisji Europejskiej i zaprezentowany w Brukseli w 2004 roku.
Zobacz też
- Inżynieria biomedyczna
- Inżynieria biologiczna
- Inżynieria biomolekularna
- Inżynieria biochemiczna
- Inżynieria komórkowa
- Inżynieria chemiczna
- Biomateriał ECM
- Bioreaktor in vivo
- Indukowane komórki macierzyste
- Procesor molekularny
- Samoorganizacja molekularna
- Inżynieria tkanki mięśniowej
- Narodowy Instytut Zdrowia
- Narodowa Fundacja Naukowa
- Kontrola jakości w inżynierii tkankowej
- Regeneracja u ludzi
- Miękkie chusteczki
- Tiomery
- Międzynarodowe Towarzystwo Inżynierii Tkankowej i Medycyny Regeneracyjnej
- Inżynieria tkankowa zastawek serca
- Ksenotransplantacja
Notatki
- Davis ME, Motion JP, Narmoneva DA, Takahashi T, Hakuno D, Kamm RD i in. (luty 2005). „Wstrzykiwalne samoorganizujące się nanowłókna peptydowe tworzą mikrośrodowiska mięśnia sercowego dla komórek śródbłonka” . Cyrkulacja . 111 (4): 442–50. doi : 10.1161/01.CIR.0000153847.47301.80 . PMC 2754569 . PMID 15687132 .
- Derksen MH (2008). Inżynieria ciała: w kierunku odpowiedzialności zawodowej za „żywe ciała” w inżynierii tkankowej . Technische Universiteit Eindhoven. ISBN 978-90-386-1428-1 .
- Fontanna HA (15 września 2012). „Po pierwsze: narządy szyte na miarę z własnych komórek ciała” . New York Timesa .
- Holmes TC, de Lacalle S, Su X, Liu G, Rich A, Zhang S (czerwiec 2000). „Rozległy wzrost neurytów i tworzenie aktywnych synaps na samoorganizujących się rusztowaniach peptydowych” . Proceedings of the National Academy of Sciences of the United States of America . 97 (12): 6728–6733. Bibcode : 2000PNAS...97.6728H . doi : 10.1073/pnas.97.12.6728 . PMC 18719 . PMID 10841570 .
- Idrus AA (12 września 2018). „Terapie witalne spadają o 88%, rezygnuje z leczenia wątroby po niepowodzeniu fazy 3” . FierceBiotech .
- Ma PX (maj 2004). „Rusztowania do wytwarzania tkanek” . Materiały dzisiaj . 7 (5): 30–40. doi : 10.1016/s1369-7021(04)00233-0 .
- Mikos AG, Temenoff JS (2000). „Tworzenie wysoce porowatych, biodegradowalnych rusztowań do inżynierii tkankowej” (PDF) . Elektroniczny Dziennik Biotechnologii . 3 (2): 114–19. doi : 10.2225/vol3-issue2-fulltext-5 .
- Nerem RM (2000). Vacanti J, Lanza RP, Langer RS (red.). Zasady inżynierii tkankowej (wyd. 2). Boston: prasa akademicka. ISBN 978-0-12-436630-5 .
- Semino CE, Kasahara J, Hayashi Y, Zhang S (2004). „Uwięzienie migrujących komórek nerwowych hipokampa w trójwymiarowym rusztowaniu z nanowłókien peptydowych”. Inżynieria tkankowa . 10 (3–4): 643–55. doi : 10.1089/107632704323061997 . PMID 15165480 .
- Thompson J, Jones N, Al-Khafaji A, Malik S, Reich D, Munoz S i in. (marzec 2018). „Pozaustrojowa terapia komórkowa (ELAD) w ciężkim alkoholowym zapaleniu wątroby: międzynarodowe, prospektywne, kontrolowane, randomizowane badanie” . Transplantacja wątroby . 24 (3): 380–93. doi : 10.1002/lt.24986 . PMC 5873437 . PMID 29171941 .
- Vishwakarma A (2014). Biologia komórek macierzystych i inżynieria tkankowa w naukach dentystycznych . Elsevier. ISBN 978-0123971579 .
- Viola J, Lal B, Grad O (14 października 2003). Pojawienie się inżynierii tkankowej jako dziedziny badawczej (PDF) (raport). Abt Associates Inc. „Alternatywna strona internetowa” – za pośrednictwem nsf.gov.
Linki zewnętrzne
- Inżynieria tkanki kostnej oparta na komórkach
- Kliniczne Centrum Inżynierii Tkankowej State of Ohio Initiative for Tissue Engineering (National Center for Regenerative Medicine)
- Druk organowy zarchiwizowany 28 sierpnia 2008 r. W wielozakładowej inicjatywie Wayback Machine finansowanej przez NSF
- LOEX Center Université Laval Inicjatywa na rzecz inżynierii tkankowej