Inżynieria tkankowa zastawek serca
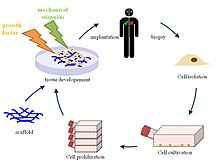
Zastawki serca z inżynierii tkankowej (TEHV) oferują nową i postępującą metodę leczenia polegającą na stworzeniu żywej zastawki serca dla osób, które potrzebują całkowitej lub częściowej wymiany zastawki serca . Obecnie rocznie wszczepia się ponad ćwierć miliona protez zastawek serca, a liczba pacjentów wymagających operacji wymiany prawdopodobnie wzrośnie, a nawet potroi się w ciągu następnych pięćdziesięciu lat. Podczas gdy obecne oferowane zabiegi, takie jak zastawki mechaniczne lub zastawki biologiczne nie są szkodliwe dla zdrowia, oba mają swoje własne ograniczenia, ponieważ zastawki mechaniczne wymagają dożywotniego stosowania antykoagulantów, podczas gdy zastawki biologiczne są podatne na degradację strukturalną i ponowne działanie. Tak więc inżynieria tkankowa zastawek serca in situ (w jej pierwotnej pozycji lub miejscu) służy jako nowe podejście, które bada zastosowanie tworzenia żywej zastawki serca złożonej z własnych komórek gospodarza, która jest zdolna do wzrostu, adaptacji i interakcji w organizmie człowieka system biologiczny organizmu.
Badania nie osiągnęły jeszcze etapu badań klinicznych.
Procedura
Rusztowania
Różne biomateriały , zarówno biologiczne, syntetyczne, jak i kombinacje obu, można wykorzystać do stworzenia rusztowań, które po wszczepieniu w ludzkie ciało mogą promować regenerację tkanek żywiciela . Najpierw pobierane są komórki od pacjenta, w które zostanie wszczepione rusztowanie. Komórki te są namnażane i umieszczane w utworzonym rusztowaniu, które jest następnie wprowadzane do ludzkiego ciała. Organizm ludzki pełni rolę bioreaktora, który umożliwia tworzenie macierzy pozakomórkowej (ECM) wraz z włóknistymi białkami wokół rusztowania, aby zapewnić niezbędne środowisko dla serca i układ krążenia . Początkowa implantacja obcego rusztowania uruchamia różne szlaki sygnałowe kierowane przez reakcję na ciało obce do rekrutacji komórek z sąsiednich tkanek. Nowa sieć nanowłókien otaczająca rusztowanie naśladuje natywną ECM organizmu gospodarza. Gdy komórki zaczną zapełniać komórkę, rusztowanie ma stopniowo ulegać degradacji, pozostawiając skonstruowaną zastawkę serca wykonaną z własnych komórek organizmu gospodarza, która jest w pełni zdolna do ponownego zaludnienia komórek i wytrzymywania zmian środowiskowych w ciele. Rusztowanie zaprojektowane do inżynierii tkankowej jest jednym z najważniejszych elementów, ponieważ kieruje budową tkanki, żywotnością i funkcjonalnością długo po implantacji i degradacji. [ potrzebne źródło ]
Biologiczny
Rusztowania biologiczne można tworzyć z tkanki dawcy ludzkiego lub ze zwierząt; jednak tkanka zwierzęca jest często bardziej popularna, ponieważ jest szerzej dostępna i występuje w większej ilości. Ksenoprzeszczep , od dawcy innego gatunku niż biorca, zastawki serca mogą pochodzić od świń, krów lub owiec. Jeśli używana jest tkanka ludzka lub zwierzęca, pierwszym krokiem w tworzeniu użytecznych rusztowań jest decelularyzacja , co oznacza usunięcie zawartości komórek przy jednoczesnym zachowaniu matrycy ECM, co jest korzystne w porównaniu z wytwarzaniem syntetycznych rusztowań od podstaw. Stosowano wiele metod decelularyzacji, takich jak stosowanie niejonowych i jonowych detergentów, które zakłócają interakcje materiałów komórkowych lub stosowanie enzymów do rozszczepiania wiązań peptydowych, RNA i DNA.
Sfabrykowany
Istnieją również obecne podejścia, które polegają na wytwarzaniu rusztowań i łączeniu ich z sygnałami biologicznymi. Sfabrykowane rusztowania można również wytwarzać od podstaw przy użyciu materiałów biologicznych, syntetycznych lub kombinacji obu materiałów, aby naśladować natywną zastawkę serca obserwowaną za pomocą technik obrazowania. Ponieważ rusztowanie jest tworzone z surowców, istnieje znacznie większa elastyczność w kontrolowaniu właściwości rusztowania i można je lepiej dopasować. Niektóre typy gotowych rusztowań obejmują solidne trójwymiarowe porowate rusztowania, które mają dużą sieć porów, która umożliwia przepływ szczątków komórkowych, umożliwiając dalszy wzrost tkanki i naczyń. Rusztowania porowate 3D można wytwarzać za pomocą druku 3D lub różnych polimerów, od kwasu poliglikolowego (PGA) i kwasu polimlekowego (PLA) po bardziej naturalne polimery, takie jak kolagen.
Rusztowania włókniste mają potencjał ścisłego dopasowania do struktury ECM dzięki zastosowaniu włókien o wysokim współczynniku wzrostu . Techniki wytwarzania rusztowań włóknistych obejmują elektroprzędzenie , w którym ciekły roztwór polimerów jest rozciągany pod wpływem przyłożonego wysokiego napięcia elektrycznego w celu wytworzenia cienkich włókien. W przeciwieństwie do trójwymiarowych rusztowań porowatych, rusztowania włókniste mają bardzo mały rozmiar porów, co zapobiega przenikaniu komórek w obrębie rusztowania.
Rusztowania hydrożelowe są tworzone przez sieciowanie hydrofilowych polimerów w różnych reakcjach, takich jak polimeryzacja wolnorodnikowa lub reakcja addycji koniugatu . Hydrożele są korzystne, ponieważ mają wysoką zawartość wody, co umożliwia łatwe przenikanie składników odżywczych i małych materiałów.
Biokompatybilność
Biokompatybilność chirurgicznie wszczepionego obcego biomateriału odnosi się do interakcji między biomateriałem a tkanką organizmu gospodarza . Linia komórkowa, a także typ komórek, taki jak fibroblasty, mogą w dużym stopniu wpływać na reakcje tkanek na wszczepione obce urządzenia poprzez zmianę morfologii komórek. Zatem źródło komórek, jak również adsorpcja białek , która jest zależna od właściwości powierzchni biomateriału, odgrywają kluczową rolę w odpowiedzi tkankowej i infiltracji komórek w miejscu rusztowania. [ potrzebne źródło ]
Metodologia
Odpowiedź zapalna
Ostre zapalenie
Implantacja jakiegokolwiek obcego urządzenia lub materiału drogą chirurgiczną powoduje przynajmniej pewien stopień urazu tkanki. Dlatego, zwłaszcza w przypadku częściowego lub całkowitego usunięcia natywnej zastawki serca, uraz tkanki wywoła kaskadę reakcji zapalnych i wywoła ostry stan zapalny . W początkowej fazie ostrego stanu zapalnego dochodzi do rozszerzenia naczyń występuje w celu zwiększenia przepływu krwi do miejsca rany wraz z uwalnianiem czynników wzrostu, cytokin i innych komórek odpornościowych. Ponadto komórki uwalniają reaktywne formy tlenu i cytokiny, które powodują wtórne uszkodzenia otaczających tkanek. Te czynniki chemiczne następnie promują rekrutację innych komórek reagujących na układ odpornościowy, takich jak monocyty lub białe krwinki, które pomagają sprzyjać tworzeniu się skrzepu krwi i bogatej w białko macierzy. [ potrzebne źródło ]
Przewlekłe zapalenie
Jeśli ostra reakcja zapalna utrzymuje się, organizm przechodzi do przewlekłego stanu zapalnego . Podczas tej ciągłej i ogólnoustrojowej fazy zapalenia jedną z głównych sił napędowych jest infiltracja makrofagów . Makrofagi i limfocyty indukują tworzenie nowych tkanek i naczyń krwionośnych, aby pomóc w dostarczaniu składników odżywczych do miejsca biomateriału. Nowa tkanka włóknista otacza następnie obcy biomateriał, aby zminimalizować interakcje między biomateriałem a otaczającą tkanką. Podczas gdy przedłużający się przewlekły stan zapalny może być prawdopodobnym wskaźnikiem infekcji, czasami stan zapalny może występować nawet do pięciu lat po operacji. Przewlekłe zapalenie charakteryzujące się obecnością zwłóknienia i komórek zapalnych zaobserwowano w komórkach szczura 30 dni po wszczepieniu urządzenia.
Po przewlekłym zapaleniu mineralizacja następuje około 60 dni po implantacji z powodu gromadzenia się szczątków komórkowych i zwapnień , co może zagrozić funkcjonalności biokompatybilnych wszczepionych urządzeń in vivo.

Reakcja na ciało obce
W normalnych warunkach fizjologicznych komórki zapalne chronią organizm przed ciałami obcymi, a organizm przechodzi reakcję na ciało obce polegającą na adsorpcji krwi i białek na powierzchni biomateriału. W ciągu pierwszych dwóch do czterech tygodni po implantacji istnieje związek między makrofagami przylegającymi do biomateriału a ekspresją cytokin w pobliżu obcego miejsca implantu, co można zbadać za pomocą półilościowej reakcji RT-PCR . Makrofagi łączą się ze sobą, tworząc olbrzymie komórki ciała obcego (FBGC), które podobnie wyrażają receptory cytokin na swoich błonach komórkowych i aktywnie uczestniczą w odpowiedzi zapalnej. Awaria urządzenia w stymulatorach z organicznego polieteropoliuretanu (PEU) w porównaniu z kauczukiem silikonowym pokazuje, że reakcja na ciało obce może rzeczywiście prowadzić do degradacji biomateriałów, powodując kolejne awarie urządzenia. Proponuje się wykorzystanie w celu zapobieżenia pogorszenia funkcjonalności i trwałości w celu zminimalizowania i spowolnienia tempa degradacji biomateriałów.
Korzyści
Zastawki serca wytwarzane metodą inżynierii tkankowej mają pewne zalety w porównaniu z tradycyjnymi zastawkami biologicznymi i mechanicznymi:
- Żywa zastawka – Opcja wymiany żywej zastawki serca jest wysoce optymalna dla dzieci, ponieważ żywa zastawka ma zdolność wzrostu i reagowania na swoje środowisko biologiczne, co jest szczególnie korzystne dla dzieci, których ciała nieustannie się zmieniają. Ta opcja pomogłaby zmniejszyć liczbę reoperacji potrzebnych w życiu dziecka.
- Indywidualny proces – ponieważ rusztowania stosowane w inżynierii tkankowej mogą być wytwarzane od podstaw, istnieje wyższy stopień elastyczności i kontroli. Pozwala to na dostosowanie potencjału zastawek serca z inżynierii tkankowej i ich właściwości, takich jak kształt rusztowania i skład biomateriału, do konkretnego pacjenta.
Ryzyka i wyzwania
Zanim zastawki serca z inżynierii tkankowej będą mogły zostać w pełni wdrożone klinicznie, należy jeszcze zająć się i zbadać wiele zagrożeń i wyzwań:
- Zanieczyszczenie – określone materiały źródłowe mogą stwarzać środowisko mikrobiologiczne sprzyjające podatności na wirusy i choroby zakaźne. Za każdym razem, gdy zewnętrzne rusztowanie jest wszczepiane w ludzkie ciało, zanieczyszczenie, choć nieuniknione, można zmniejszyć poprzez zastosowanie sterylnej techniki.
- Interakcje rusztowań — Istnieje wiele zagrożeń związanych z interakcjami między komórkami a wszczepionym rusztowaniem, ponieważ w ramach obecnych badań nadal w dużej mierze nie są znane określone wymagania dotyczące biokompatybilności. Reakcje na te interakcje są również wysoce zindywidualizowane, zależne od środowiska biologicznego konkretnego pacjenta; dlatego modele zwierzęce badane wcześniej mogą nie przedstawiać dokładnie wyników w ludzkim ciele. Ze względu na wysoce interaktywny charakter między rusztowaniem a otaczającą tkanką, właściwości takie jak biodegradowalność , biokompatybilność i immunogenność muszą być dokładnie rozważone, ponieważ są kluczowymi czynnikami wpływającymi na działanie produktu końcowego.
- Złożoność strukturalna – Zastawki serca ze swoją heterogenną strukturą są bardzo złożone i dynamiczne, co stanowi wyzwanie dla zastawek wytwarzanych metodą inżynierii tkankowej. Nowe zastawki muszą charakteryzować się dużą wytrzymałością, a jednocześnie odpowiadać anatomicznemu kształtowi i mechanicznym funkcjom naturalnej zastawki.
Historia
Rusztowania syntetyczne
Przeprowadzono badania zaszczepionych rusztowań wykonanych z polimerów z różnymi liniami komórkowymi in vitro , w których rusztowania ulegały degradacji w czasie, pozostawiając po sobie macierz komórkową i białka. Pierwsze badanie dotyczące inżynierii tkankowej zastawek serca zostało opublikowane w 1995 roku. W latach 1995 i 1996 Shinoka użył rusztowania wykonanego z kwasu poliglikolowego (PGA), zatwierdzonego przez FDA do implantacji u ludzi, i zaszczepił je komórkami śródbłonka owcy i fibroblastami z celem wymiany płatka zastawki płucnej owiec. Wynikiem badań Shinoki była sztucznie zaprojektowana zastawka serca, która była znacznie grubsza i sztywniejsza, co skłoniło Hoerstrupa do przeprowadzenia badania mającego na celu wymianę wszystkich trzech płatków zastawki płucnej u owcy przy użyciu rusztowania PGA pokrytego poli-4-hydroksymaślanem (P4HB) i owcy komórki śródbłonka i miofibroblasty.
Rusztowania biologiczne
Inną badaną opcją było użycie odkomórkowionych rusztowań biologicznych i zaszczepienie ich odpowiednimi komórkami in vitro . W 2000 roku Steinhoff wszczepił odkomórkowione rusztowanie zastawki płucnej owcy, zaszczepione komórkami śródbłonka owiec i miofibroblastami. Następnie Dohmen stworzył odkomórkowione, kriokonserwowane rusztowanie alloprzeszczepu płuc i zaszczepił je ludzkimi komórkami śródbłonka naczyniowego, aby zrekonstruować drogę odpływu prawej komory (RVOT) u pacjenta będącego człowiekiem w 2002 r. Perry w 2003 r. Zaszczepił rusztowanie PGA pokryte P4HB mezenchymalnymi komórkami macierzystymi owiec in vitro ; jednak in vivo badanie nie zostało wykonane. W 2004 roku Iwai przeprowadził badanie z użyciem poli(kwasu mlekowego i glikolowego) PLGA połączonego z rusztowaniem z mikrogąbki kolagenowej, które zostało zaszczepione komórkami śródbłonka i mięśni gładkich w miejscu tętnicy płucnej psa. Sutherland w 2005 roku wykorzystał rusztowanie z PGA i kwasu poli-L-mlekowego (PLLA) wysiane mezenchymalnymi komórkami macierzystymi owiec, aby zastąpić wszystkie trzy płatki zastawki płucnej u owcy.
Badania implantów in vivo
W kilku badaniach wykorzystano inżynierię tkankową zastawek serca in vivo na modelach zwierzęcych i ludziach. W 2000 roku Matheny przeprowadził badanie, w którym użył błony podśluzowej jelita cienkiego świni do zastąpienia jednego płatka zastawki płucnej. Przeprowadzono również ograniczone badania w warunkach klinicznych. Na przykład w 2001 roku Elkins wszczepił pacjentom odkomórkowione ludzkie zastawki płucne leczone preparatem SynerGraft. Simon podobnie zastosował odkomórkowione zastawki świńskie SynerGraft do implantacji u dzieci; jednak te zastawki często zawodziły, ponieważ nie było komórek gospodarza, ale raczej duże ilości komórek zapalnych znalezionych w miejscu rusztowania. Badania prowadzone przez Dohmena, Konertza i współpracowników w Berlinie w Niemczech obejmowały wszczepienie biologicznej zastawki świńskiej u 50 pacjentów, którzy przeszli Operacja Rossa w latach 2002-2004. Celem badania było zastosowanie odkomórkowionej ksenoprzeszczepu świńskiej zastawki, zwanej także Matrix P, u dorosłych w wieku średnio 46 lat. Celem badania było przedstawienie propozycji wymiany zastawki płucnej. Podczas gdy niektórzy pacjenci zmarli po operacji i musieli przejść reoperację, krótkoterminowe wyniki wydają się być dobre, ponieważ zastawka zachowuje się podobnie do rodzimej, zdrowej zastawki. Jedno badanie na zwierzętach obejmowało przezcewnikową wymianę zastawki aortalnej (TAVR) z zastawkami serca wykonanymi metodą inżynierii tkankowej (TEHV). Stent TAVR zintegrowany z macierzą zewnątrzkomórkową pochodzącą z komórek ludzkich został wszczepiony i zbadany u owiec, u których zastawka utrzymywała integralność strukturalną i infiltrację komórek, co umożliwiło potencjalne zastosowanie kliniczne rozszerzenia TAVR na młodszych pacjentów.
Badania
Chociaż wiele badań in vitro i in vivo zostało przetestowanych na modelach zwierzęcych, tłumaczenie z modeli zwierzęcych na ludzi jeszcze się nie rozpoczęło. Należy wziąć pod uwagę takie czynniki, jak wielkość miejsc cięcia chirurgicznego, czas trwania zabiegu oraz dostępne zasoby i koszty. Syntetyczne nanomateriały mogą przyczynić się do rozwoju rusztowań stosowanych w inżynierii tkankowej zastawek serca. Zastosowanie nanotechnologii może pomóc w rozszerzeniu korzystnych właściwości wytwarzanych rusztowań, takich jak wyższa wytrzymałość na rozciąganie.