Dwutlenek węgla

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
Inne nazwy
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| 1900390 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.004.271 | ||
| Numer WE |
|
||
| Numer E | E290 (konserwanty) | ||
| 989 | |||
| KEGG | |||
| Siatka | węgiel + dwutlenek | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 1013 (gaz), 1845 (ciało stałe) | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| CO 2 _ | |||
| Masa cząsteczkowa | 44,009 g · mol -1 | ||
| Wygląd | Bezbarwny gaz | ||
| Zapach |
|
||
| Gęstość |
|
||
| Punkt krytyczny ( T , P ) | 304,128(15) K ( 30,978(15) °C ), 7,3773(30) MPa ( 72,808(30) atm ) | ||
| 194,6855(30) K ( -78,4645(30) ° C ) przy 1 atm ( 0,101 325 MPa ) | |||
| 1,45 g/l przy 25°C (77°F), 100 kPa (0,99 atm) | |||
| Ciśnienie pary | 5,7292 (30) MPa , 56,54 (30) atm ( 20 ° C ( 293,15 K )) | ||
| Kwasowość ( p Ka ) | 6.35, 10.33 | ||
| −20,5·10 −6 cm 3 /mol | |||
| Przewodność cieplna | 0,01662 W · m -1 · K -1 (300 K (27 ° C; 80 ° F)) | ||
|
Współczynnik załamania światła ( n D )
|
1.00045 | ||
| Lepkość |
|
||
| 0 D | |||
| Struktura | |||
| Trójkątny | |||
| Liniowy | |||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
37,135 J/K·mol | ||
|
Standardowa entropia molowa ( S ⦵ 298 ) |
214 J · mol -1 · K -1 | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−393,5 kJ·mol −1 | ||
| Farmakologia | |||
| V03AN02 ( KTO ) | |||
| Zagrożenia | |||
| NFPA 704 (ognisty diament) | |||
| Śmiertelna dawka lub stężenie (LD, LC): | |||
|
LC Lo ( najniższy opublikowany )
|
90 000 ppm (człowiek, 5 min) | ||
| NIOSH (limity ekspozycji na zdrowie w USA): | |||
|
PEL (dopuszczalny)
|
TWA 5000 ppm (9000 mg/m 3 ) | ||
|
REL (zalecane)
|
TWA 5000 ppm (9000 mg/m 3 ), ST 30 000 ppm (54 000 mg/m 3 ) | ||
|
IDLH (bezpośrednie zagrożenie)
|
40 000 stron na minutę | ||
| Karta charakterystyki (SDS) | Sigma-Aldrich | ||
| Związki pokrewne | |||
|
Inne aniony
|
|
||
|
Inne kationy
|
|||
|
Związki pokrewne
|
|||
| Strona danych uzupełniających | |||
| Dwutlenek węgla (strona danych) | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
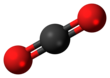
Dwutlenek węgla ( wzór chemiczny CO 2 ) jest związkiem chemicznym składającym się z cząsteczek , z których każda ma jeden atom węgla kowalencyjnie połączony wiązaniem podwójnym z dwoma atomami tlenu . Występuje w stanie gazowym w temperaturze pokojowej. W powietrzu dwutlenek węgla jest przezroczysty dla światła widzialnego, ale pochłania promieniowanie podczerwone , działając jak gaz cieplarniany . Jest to gaz śladowy w atmosferze ziemskiej w stężeniu 421 części na milion (ppm), czyli około 0,04% objętości (stan na maj 2022 r.), Który wzrósł z poziomu sprzed epoki przemysłowej wynoszącego 280 ppm. Spalanie paliw kopalnych jest główną przyczyną zwiększonego stężenia CO 2 , a także główną przyczyną zmian klimatu . Dwutlenek węgla jest rozpuszczalny w wodzie i występuje w wodach gruntowych , jeziorach , pokrywach lodowych i wodzie morskiej . Kiedy dwutlenek węgla rozpuszcza się w wodzie, tworzy węglany , a głównie wodorowęglany ( HCO
- 3 ), co powoduje zakwaszenie oceanów wraz ze wzrostem poziomu CO 2 w atmosferze .
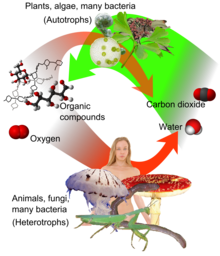
Jako źródło dostępnego węgla w obiegu węgla , atmosferyczny CO 2 jest głównym źródłem węgla dla życia na Ziemi. Jego stężenie w przedindustrialnej atmosferze Ziemi od późnego prekambru było regulowane przez organizmy i zjawiska geologiczne. Rośliny , algi i cyjanobakterie wykorzystują energię światła słonecznego do syntezy węglowodanów z dwutlenku węgla i wody w procesie zwanym fotosyntezą , w wyniku którego tlen jest produktem ubocznym. Z kolei tlen jest zużywany, a CO2 uwalniany jako odpad przez wszystkie organizmy tlenowe , gdy metabolizują związki organiczne w celu wytworzenia energii poprzez oddychanie . CO 2 jest uwalniany z materiałów organicznych podczas ich rozkładu lub spalania, na przykład podczas pożarów lasów. Ponieważ rośliny potrzebują CO 2 do fotosyntezy, a ludzie i zwierzęta są uzależnieni od roślin jako pożywienia, CO 2 jest niezbędny do przetrwania życia na ziemi.
Dwutlenek węgla ma o 53% większą gęstość niż suche powietrze, ale jest długowieczny i dokładnie miesza się z atmosferą. Około połowa nadwyżki emisji CO 2 do atmosfery jest pochłaniana przez lądowe i oceaniczne pochłaniacze dwutlenku węgla . Te pochłaniacze mogą ulec nasyceniu i są niestabilne, ponieważ rozkład i pożary powodują uwalnianie CO 2 z powrotem do atmosfery. CO 2 jest ostatecznie sekwestrowany (magazynowany przez długi czas) w skałach i złożach organicznych, takich jak węgiel , ropa naftowa i gaz ziemny . Sekwestrowany CO 2 jest uwalniany do atmosfery poprzez spalanie paliw kopalnych lub naturalnie przez wulkany , gorące źródła , gejzery oraz gdy skały węglanowe rozpuszczają się w wodzie lub reagują z kwasami.
CO 2 to uniwersalny materiał przemysłowy, używany na przykład jako gaz obojętny w spawalnictwie i gaśnicach , jako gaz sprężający w wiatrówkach i do odzyskiwania oleju oraz jako płynny rozpuszczalnik w stanie nadkrytycznym do odkofeinowania kawy i suszenia w stanie nadkrytycznym . Jest produktem ubocznym fermentacji cukrów w produkcji chleba , piwa i wina i jest dodawany do napojów gazowanych, takich jak seltzer i piwo w celu musowania. Ma ostry i kwaśny zapach i daje w ustach smak wody sodowej , ale w normalnych stężeniach jest bezwonny.
Właściwości chemiczne i fizyczne
Struktura, wiązania i drgania molekularne
Symetria cząsteczki dwutlenku węgla jest liniowa i centrosymetryczna w geometrii równowagi. Długość wiązania węgiel-tlen w dwutlenku węgla wynosi 116,3 µm , zauważalnie mniej niż około 140 µm długości typowego pojedynczego wiązania C – O i krótsza niż większość innych grup funkcyjnych z wielokrotnymi wiązaniami C – O , takich jak karbonyle . Ponieważ jest centrosymetryczna, cząsteczka nie ma elektrycznego momentu dipolowego .

Jako liniowa cząsteczka trójatomowa, CO 2 ma cztery tryby wibracyjne , jak pokazano na schemacie. W symetrycznym i antysymetrycznym trybie rozciągania atomy poruszają się wzdłuż osi cząsteczki. Istnieją dwa tryby zginania, które są zdegenerowane , co oznacza, że mają tę samą częstotliwość i tę samą energię, ze względu na symetrię cząsteczki. Kiedy cząsteczka dotyka powierzchni lub dotyka innej cząsteczki, dwa tryby zginania mogą różnić się częstotliwością, ponieważ interakcja jest różna dla tych dwóch trybów. Niektóre z modów wibracyjnych są obserwowane w widmie w podczerwieni (IR) : antysymetryczny tryb rozciągania przy liczbie falowej 2349 cm -1 (długość fali 4,25 μm) oraz zdegenerowana para modów zginania przy 667 cm -1 (długość fali 15 μm). Tryb symetrycznego rozciągania nie tworzy dipol elektryczny, więc nie jest obserwowany w spektroskopii w podczerwieni, ale jest wykrywany przez spektroskopię Ramana przy 1388 cm -1 (długość fali 7,2 μm).
W fazie gazowej cząsteczki dwutlenku węgla podlegają znacznym ruchom wibracyjnym i nie zachowują stałej struktury. Jednak w z obrazowaniem eksplozji kulombowskiej można wywnioskować natychmiastowy obraz struktury molekularnej. Taki eksperyment przeprowadzono dla dwutlenku węgla. Wynikiem tego eksperymentu i konkluzją obliczeń teoretycznych opartych na powierzchni energii potencjalnej ab initio cząsteczki jest to, że żadna z cząsteczek w fazie gazowej nie jest nigdy dokładnie liniowa. Ten sprzeczny z intuicją wynik jest trywialnie spowodowany faktem, że element objętości ruchu jądrowego znika dla geometrii liniowych. Dotyczy to wszystkich cząsteczek (z wyjątkiem cząsteczek dwuatomowych!).
W roztworze wodnym
Dwutlenek węgla jest rozpuszczalny w wodzie, w której odwracalnie tworzy H 2 CO 3 (kwas węglowy), który jest słabym kwasem , ponieważ jego jonizacja w wodzie jest niepełna.
Stała równowagi hydratacji kwasu węglowego w temperaturze 25 ° C wynosi:
W związku z tym większość dwutlenku węgla nie jest przekształcana w kwas węglowy, ale pozostaje w postaci cząsteczek CO 2 , nie wpływających na pH.
Względne stężenia CO 2 , H 2 CO 3 i form zdeprotonowanych HCO − 3 ( wodorowęglan ) i CO 2 − 3 ( węglan ) zależą od pH . Jak pokazano na wykresie Bjerrum , w wodzie obojętnej lub lekko zasadowej (pH > 6,5) dominuje forma wodorowęglanowa (>50%), stając się najbardziej rozpowszechnioną (>95%) przy pH wody morskiej. W wodzie bardzo alkalicznej (pH > 10,4) dominującą (>50%) formą jest węglan. Oceany, jako lekko zasadowe, o typowym pH = 8,2–8,5, zawierają około 120 mg wodorowęglanu na litr.
Będąc diprotonowym , kwas węglowy ma dwie stałe dysocjacji kwasowej , pierwszą dla dysocjacji na jon wodorowęglanowy (zwany także wodorowęglanem) ( HCO - 3 ):
- K a1 = 2,5 × 10 -4 mol / l ; p Ka1 = 3,6 w temperaturze 25°C.
Jest to prawdziwa pierwsza stała dysocjacji kwasu, zdefiniowana jako
gdzie mianownik obejmuje tylko kowalencyjnie związany H 2 CO 3 i nie obejmuje uwodnionego CO 2 (aq) . Znacznie mniejsza i często podawana wartość bliska 4,16 × 10-7 obliczoną jest wartością pozorną na podstawie (błędnego) założenia, że cały rozpuszczony CO 2 występuje w postaci kwasu węglowego, więc
Ponieważ większość rozpuszczonego CO 2 pozostaje w postaci cząsteczek CO 2 , Ka1 ( pozorny ) ma znacznie większy mianownik i znacznie mniejszą wartość niż prawdziwy Ka1 .
Jon wodorowęglanowy jest związkiem amfoterycznym , który może działać jako kwas lub zasada, w zależności od pH roztworu. Przy wysokim pH dysocjuje znacząco na węglanowy ( CO 2− 3 ):
- K a2 = 4,69 × 10 -11 mol / l ; p Ka2 = 10,329
węglowego jest katalizowane przez enzym anhydrazę węglanową .
Reakcje chemiczne CO 2
CO2 jest silnym elektrofilem o reaktywności elektrofilowej porównywalnej z benzaldehydem lub silnymi α ,β-nienasyconymi związkami karbonylowymi . Jednakże, w przeciwieństwie do elektrofilów o podobnej reaktywności, reakcje nukleofili z CO2 są termodynamicznie mniej uprzywilejowane i często okazuje się, że są wysoce odwracalne. Tylko bardzo silne nukleofile, takie jak karboaniony dostarczane przez odczynniki Grignarda i związki litoorganiczne reagują z CO 2 dając karboksylany :
W kompleksach metali z dwutlenkiem węgla CO 2 służy jako ligand , który może ułatwiać konwersję CO 2 do innych związków chemicznych.
Redukcja CO 2 do CO jest zazwyczaj trudną i powolną reakcją:
Fotoautotrofy (tj. rośliny i cyjanobakterie ) wykorzystują energię zawartą w świetle słonecznym do fotosyntezy cukrów prostych z CO 2 absorbowanego z powietrza i wody:
Potencjał redoks tej reakcji w pobliżu pH 7 wynosi około -0,53 V w stosunku do standardowej elektrody wodorowej . Enzym zawierający nikiel, dehydrogenaza tlenku węgla, katalizuje ten proces.
Właściwości fizyczne
Dwutlenek węgla jest bezbarwny. Przy niskich stężeniach gaz jest bezwonny; jednak w wystarczająco wysokich stężeniach ma ostry, kwaśny zapach. W standardowej temperaturze i ciśnieniu gęstość dwutlenku węgla wynosi około 1,98 kg/m3 , czyli około 1,53 razy więcej niż powietrza .
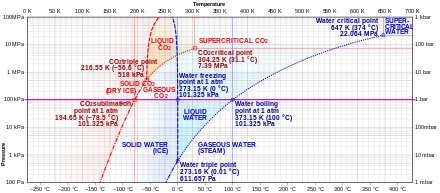
Dwutlenek węgla nie ma stanu ciekłego przy ciśnieniu poniżej 0,517 95 (10) MPa ( 5,111 77 (99) atm ). Przy ciśnieniu 1 atm ( 0,101 325 MPa ) gaz osadza się bezpośrednio w ciele stałym w temperaturze poniżej 194,6855(30) K ( -78,4645(30) °C ), a ciało stałe sublimuje bezpośrednio do stanu gazowego powyżej tej temperatury. W stanie stałym dwutlenek węgla jest powszechnie nazywany suchym lodem .

Ciekły dwutlenek węgla tworzy się tylko przy ciśnieniach powyżej 0,517 95 (10) MPa ( 5,111 77 (99) atm ); punkt potrójny dwutlenku węgla wynosi 216,592 (3) K ( -56,558 (3) ° C ) przy 0,517 95 (10) MPa ( 5,111 77 (99) atm ) (patrz diagram fazowy). Punkt krytyczny to 304,128(15) K ( 30,978(15) °C ) przy 7,3773(30) MPa ( 72,808(30) atm ). Inną postacią stałego dwutlenku węgla obserwowaną pod wysokim ciśnieniem jest bezpostaciowe, przypominające szkło ciało stałe . Ta forma szkła, zwana carbonią , jest wytwarzana przez przechłodzenie ogrzanego CO2 pod ekstremalnymi ciśnieniami (40–48 GPa , czyli około 400 000 atmosfer) w diamentowym kowadle . Odkrycie to potwierdziło teorię, że dwutlenek węgla może istnieć w stanie szklistym, podobnie jak inni członkowie jego rodziny pierwiastków, jak dwutlenek krzemu (szkło krzemionkowe) i dwutlenek germanu . Jednak w przeciwieństwie do szkieł krzemionkowych i germanowych szkło karbonowe nie jest stabilne przy normalnym ciśnieniu i powraca do stanu gazowego po zwolnieniu ciśnienia.
W temperaturach i ciśnieniach powyżej punktu krytycznego dwutlenek węgla zachowuje się jak nadkrytyczny płyn znany jako dwutlenek węgla w stanie nadkrytycznym .
Tabela właściwości termicznych i fizycznych nasyconego ciekłego dwutlenku węgla:
| Temperatura (°C) | Gęstość (kg/m^3) | Ciepło właściwe (kJ/kg K) | Lepkość kinematyczna (m^2/s) | Przewodność (W/m·K) | Dyfuzyjność cieplna (m^2/s) | liczba Prandtla | Moduł objętościowy (K^-1) |
| -50 | 1156,34 | 1,84 | 1.19E-07 | 0,0855 | 4.02E-08 | 2,96 | - |
| -40 | 1117,77 | 1,88 | 1.18E-07 | 0,1011 | 4.81E-08 | 2.46 | - |
| -30 | 1076,76 | 1,97 | 1.17E-07 | 0,1116 | 5.27E-08 | 2.22 | - |
| -20 | 1032,39 | 2.05 | 1.15E-07 | 0,1151 | 5.45E-08 | 2.12 | - |
| -10 | 983,38 | 2.18 | 1.13E-07 | 0,1099 | 5.13E-08 | 2.2 | - |
| 0 | 926,99 | 2.47 | 1.08E-07 | 0,1045 | 4.58E-08 | 2.38 | - |
| 10 | 860.03 | 3.14 | 1.01E-07 | 0,0971 | 3.61E-08 | 2.8 | - |
| 20 | 772,57 | 5 | 9.10E-08 | 0,0872 | 2.22E-08 | 4.1 | 1.40E-02 |
| 30 | 597,81 | 36,4 | 8.00E-08 | 0,0703 | 0,279E-08 | 28,7 | - |
Tabela właściwości termicznych i fizycznych dwutlenku węgla (CO 2 ) pod ciśnieniem atmosferycznym:
| Temperatura (K) | Gęstość (kg/m^3) | Ciepło właściwe (kJ/kg °C) | Lepkość dynamiczna (kg/ms) | Lepkość kinematyczna (m^2/s) | Przewodność cieplna (W/m °C) | Dyfuzyjność cieplna (m^2/s) | liczba Prandtla |
| 220 | 2,4733 | 0,783 | 1.11E-05 | 4.49E-06 | 0,010805 | 5.92E-06 | 0,818 |
| 250 | 2.1657 | 0,804 | 1.26E-05 | 5.81E-06 | 0,012884 | 7.40E-06 | 0,793 |
| 300 | 1,7973 | 0,871 | 1,50E-05 | 8.32E-06 | 0,016572 | 1.06E-05 | 0,77 |
| 350 | 1,5362 | 0,9 | 1.72E-05 | 1.12E-05 | 0,02047 | 1.48E-05 | 0,755 |
| 400 | 1,3424 | 0,942 | 1.93E-05 | 1.44E-05 | 0,02461 | 1.95E-05 | 0,738 |
| 450 | 1.1918 | 0,98 | 2.13E-05 | 1.79E-05 | 0,02897 | 2.48E-05 | 0,721 |
| 500 | 1.0732 | 1.013 | 2.33E-05 | 2.17E-05 | 0,03352 | 3.08E-05 | 0,702 |
| 550 | 0,9739 | 1.047 | 2.51E-05 | 2.57E-05 | 0,03821 | 3,75E-05 | 0,685 |
| 600 | 0,8938 | 1.076 | 2.68E-05 | 3.00E-05 | 0,04311 | 4.48E-05 | 0,668 |
| 650 | 0,8143 | 1.1 | 2.88E-05 | 3.54E-05 | 0,0445 | 4.97E-05 | 0,712 |
| 700 | 0,7564 | 1,13E+00 | 3.05E-05 | 4.03E-05 | 0,0481 | 5.63E-05 | 0,717 |
| 750 | 0,7057 | 1.15 | 3.21E-05 | 4.55E-05 | 0,0517 | 6.37E-05 | 0,714 |
| 800 | 0,6614 | 1,17E+00 | 3.37E-05 | 5.10E-05 | 0,0551 | 7.12E-05 | 0,716 |
Rola biologiczna
Dwutlenek węgla jest końcowym produktem oddychania komórkowego w organizmach, które uzyskują energię poprzez rozkład cukrów, tłuszczów i aminokwasów z tlenem w ramach ich metabolizmu . Obejmuje to wszystkie rośliny, glony i zwierzęta oraz tlenowe i bakterie. U kręgowców dwutlenek węgla przemieszcza się we krwi z tkanek ciała do skóry (np. u płazów ) lub skrzeli (np. u ryb ), skąd rozpuszcza się w wodzie lub do płuc, skąd jest wydychany. Podczas aktywnej fotosyntezy rośliny mogą wchłonąć więcej dwutlenku węgla z atmosfery, niż uwalniają podczas oddychania.
Fotosynteza i wiązanie węgla

Wiązanie węgla to proces biochemiczny, w którym atmosferyczny dwutlenek węgla jest włączany przez rośliny, algi i (cyjanobakterie) do bogatych w energię cząsteczek organicznych, takich jak glukoza , tworząc w ten sposób własne pożywienie w procesie fotosyntezy. Fotosynteza wykorzystuje dwutlenek węgla i wodę do produkcji cukrów, z których można zbudować inne związki organiczne , a tlen jest wytwarzany jako produkt uboczny.
Oksygenaza karboksylazy rybulozo-1,5-bisfosforanu , powszechnie określana skrótem RuBisCO, jest enzymem biorącym udział w pierwszym głównym etapie wiązania węgla, produkcji dwóch cząsteczek 3-fosfoglicerynianu z CO 2 i bisfosforanu rybulozy , jak pokazano na schemacie w lewy.
Uważa się, że RuBisCO jest najbardziej rozpowszechnionym białkiem na Ziemi.
Fototrofy wykorzystują produkty swojej fotosyntezy jako wewnętrzne źródła pożywienia i jako surowiec do biosyntezy bardziej złożonych cząsteczek organicznych, takich jak polisacharydy , kwasy nukleinowe i białka. Są one wykorzystywane do ich własnego wzrostu, a także jako podstawa łańcuchów pokarmowych i sieci, które karmią inne organizmy, w tym zwierzęta takie jak my. Niektóre ważne fototrofy, coccolithophores , syntetyzują twarde łuski węglanu wapnia . Gatunkiem kokkolithoforu o znaczeniu globalnym jest Emiliania huxleyi , którego kalcytowe łuski stanowiły podstawę wielu skał osadowych, takich jak wapień , gdzie to, co wcześniej było węglem atmosferycznym, może pozostać niezmienione w geologicznych skalach czasowych.
Rośliny mogą rosnąć nawet o 50 procent szybciej przy stężeniu 1000 ppm CO 2 w porównaniu z warunkami otoczenia, chociaż zakłada to brak zmian klimatu i brak ograniczeń w zakresie innych składników odżywczych. Podwyższony poziom CO 2 powoduje zwiększony wzrost odzwierciedlony w plonach upraw, przy czym pszenica, ryż i soja wykazują wzrost plonów o 12-14% przy podwyższonym poziomie CO 2 w doświadczeniach FACE.
Zwiększone stężenie CO 2 w atmosferze skutkuje mniejszą liczbą aparatów szparkowych rozwijających się na roślinach, co prowadzi do zmniejszenia zużycia wody i zwiększenia jej efektywności . Badania z wykorzystaniem FACE wykazały, że wzbogacanie CO 2 prowadzi do zmniejszenia stężenia mikroelementów w roślinach uprawnych. Może to mieć efekt domina w innych częściach ekosystemów , ponieważ zwierzęta roślinożerne będą musiały jeść więcej pożywienia, aby uzyskać taką samą ilość białka.
Stężenie metabolitów wtórnych , takich jak fenylopropanoidy i flawonoidy, może również ulec zmianie w roślinach narażonych na wysokie stężenia CO2 .
Rośliny również emitują CO 2 podczas oddychania, więc większość roślin i glonów, które wykorzystują fotosyntezę C3 , pochłania tylko netto w ciągu dnia. Chociaż rosnący las będzie pochłaniał wiele ton CO 2 każdego roku, dojrzały las będzie wytwarzał tyle CO 2 z oddychania i rozkładu martwych okazów (np. opadłych gałęzi), ile zużywa się w fotosyntezie rosnących roślin. Wbrew panującemu od dawna poglądowi, że są one neutralne pod względem emisji dwutlenku węgla, dojrzałe lasy mogą nadal gromadzić dwutlenek węgla i pozostawać cennymi pochłaniaczami dwutlenku węgla , pomagając w utrzymaniu równowagi węgla w ziemskiej atmosferze. Dodatkowo, co ma kluczowe znaczenie dla życia na Ziemi, fotosynteza przeprowadzana przez fitoplankton zużywa rozpuszczony CO 2 w górnych warstwach oceanu, a tym samym sprzyja absorpcji CO 2 z atmosfery.
Toksyczność

Zawartość dwutlenku węgla w świeżym powietrzu (średnia między poziomem morza a poziomem 10 kPa, tj. około 30 km (19 mil) wysokości) waha się od 0,036% (360 ppm) do 0,041% (412 ppm), w zależności od lokalizacji. [ wymagane wyjaśnienie ]
CO 2 jest gazem duszącym i nie jest klasyfikowany jako toksyczny ani szkodliwy zgodnie z normami Globalnie Zharmonizowanego Systemu Klasyfikacji i Oznakowania Chemikaliów Europejskiej Komisji Gospodarczej Organizacji Narodów Zjednoczonych przy użyciu Wytycznych OECD dotyczących badania chemikaliów . W stężeniu do 1% (10 000 ppm) powoduje u niektórych osób uczucie senności i duszności w płucach. Stężenia od 7% do 10% (70 000 do 100 000 ppm) mogą powodować uduszenie, nawet w obecności wystarczającej ilości tlenu, objawiające się zawrotami głowy, bólem głowy, zaburzeniami wzroku i słuchu oraz utratą przytomności w ciągu kilku minut do godziny. Fizjologiczne skutki ostrej ekspozycji na dwutlenek węgla są zgrupowane pod terminem hiperkapnia , podgrupa uduszenia .
Ponieważ jest cięższy od powietrza, w miejscach, w których gaz wycieka z ziemi (z powodu podpowierzchniowej aktywności wulkanicznej lub geotermalnej) w stosunkowo wysokich stężeniach, bez rozpraszającego wpływu wiatru, może gromadzić się w osłoniętych / kieszonkowych miejscach poniżej przeciętnego gruntu poziomu, powodując uduszenie znajdujących się w nim zwierząt. Karmniki padliną, które przyciągają tusze, są następnie zabijane. Dzieci zostały zabite w ten sam sposób w pobliżu miasta Goma przez emisje CO2 z pobliskiego wulkanu Mount Nyiragongo . Terminem suahili określającym to zjawisko jest mazuku .

Adaptacja do zwiększonych stężeń CO 2 występuje u ludzi, w tym modyfikacja oddychania i produkcji wodorowęglanów w nerkach, w celu zrównoważenia skutków zakwaszenia krwi ( kwasicy ). W kilku badaniach zasugerowano, że 2,0-procentowe stężenie wdechowe może być stosowane w zamkniętych przestrzeniach powietrznych (np. w łodzi podwodnej ), ponieważ adaptacja jest fizjologiczna i odwracalna, ponieważ pogorszenie wydajności lub normalnej aktywności fizycznej nie występuje przy takim poziomie narażenia przez pięć dni. Jednak inne badania wykazują spadek funkcji poznawczych nawet na znacznie niższych poziomach. Również przy trwającej kwasicy oddechowej mechanizmy adaptacyjne lub kompensacyjne nie będą w stanie odwrócić tego stanu .
poniżej 1%
Istnieje niewiele badań dotyczących skutków zdrowotnych długotrwałej ciągłej ekspozycji na CO 2 u ludzi i zwierząt na poziomie poniżej 1%. Limity narażenia zawodowego na CO 2 zostały ustalone w Stanach Zjednoczonych na poziomie 0,5% (5000 ppm) przez okres ośmiu godzin. Przy takim stężeniu CO 2 załoga Międzynarodowej Stacji Kosmicznej odczuwała bóle głowy, letarg, spowolnienie umysłowe, irytację emocjonalną i zaburzenia snu. Badania na zwierzętach przy 0,5% CO 2 wykazały zwapnienie nerek i utratę masy kostnej po ośmiu tygodniach ekspozycji. Badanie ludzi narażonych podczas 2,5-godzinnych sesji wykazało znaczący negatywny wpływ na zdolności poznawcze przy stężeniach tak niskich jak 0,1% (1000 ppm) CO2 , prawdopodobnie z powodu wywołanego przez CO2 wzrostu przepływu krwi w mózgu. W innym badaniu zaobserwowano spadek podstawowego poziomu aktywności i wykorzystania informacji przy 1000 ppm w porównaniu do 500 ppm. Jednak przegląd literatury wykazał, że większość badań nad zjawiskiem wywołanym przez dwutlenek węgla upośledzenie funkcji poznawczych miało niewielki wpływ na podejmowanie decyzji na wysokim szczeblu, a większość badań była zakłócona przez nieodpowiednie projekty badań, komfort środowiskowy, niepewność co do dawek narażenia i stosowane różne oceny poznawcze. Podobnie krytykowano badanie wpływu stężenia CO 2 w kaskach motocyklowych za wątpliwą metodologię polegającą na nieodnotowywaniu samoopisów motocyklistów i wykonywaniu pomiarów przy użyciu manekinów. Ponadto po osiągnięciu normalnych warunków motocyklowych (takich jak prędkość na autostradzie lub w mieście) lub podniesieniu przyłbicy stężenie CO 2 spadło do bezpiecznego poziomu (0,2%).
Wentylacja

Słaba wentylacja jest jedną z głównych przyczyn nadmiernego stężenia CO 2 w pomieszczeniach zamkniętych, co prowadzi do złej jakości powietrza w pomieszczeniach . Różnice dwutlenku węgla powyżej stężeń na zewnątrz w warunkach stanu ustalonego (kiedy przebywanie i działanie systemu wentylacyjnego są wystarczająco długie, aby stężenie CO 2 ustabilizowało się) są czasami wykorzystywane do oszacowania szybkości wentylacji na osobę. [ potrzebne źródło ] Wyższe stężenia CO 2 są związane ze zdrowiem, komfortem i pogorszeniem wydajności użytkowników. Standardowe wskaźniki wentylacji ASHRAE 62.1–2007 mogą skutkować stężeniami w pomieszczeniach do 2100 ppm powyżej warunków panujących na zewnątrz. Tak więc, jeśli stężenie na zewnątrz wynosi 400 ppm, stężenie w pomieszczeniach może osiągnąć 2500 ppm przy współczynnikach wentylacji, które spełniają ten konsensus branżowy. Stężenia w słabo wentylowanych pomieszczeniach mogą być nawet wyższe (zakres 3000 lub 4000 ppm).
Górnicy, którzy są szczególnie narażeni na kontakt z gazem z powodu niedostatecznej wentylacji, określali mieszaniny dwutlenku węgla i azotu jako „ czarną wilgoć ”, „wilgoć dławiącą” lub „stythe”. Zanim opracowano bardziej efektywne technologie, górnicy często monitorowali niebezpieczne poziomy czarnej wilgoci i innych gazów w szybach kopalnianych, zabierając ze sobą kanarka w klatce podczas pracy. Kanarek jest bardziej wrażliwy na duszące gazy niż ludzie, a gdy tracił przytomność, przestawał śpiewać i spadał z grzędy. Lampa Davy'ego może również wykrywać wysoki poziom czarnej wilgoci (która tonie i zbiera się w pobliżu podłogi), spalając się mniej jasno, podczas gdy metan , inny duszący gaz i ryzyko wybuchu, sprawi, że lampa będzie świecić jaśniej.
W lutym 2020 roku trzy osoby zmarły w wyniku uduszenia się na imprezie w Moskwie, kiedy do basenu dodano suchy lód (zamrożony CO 2 ), aby go schłodzić. Podobny wypadek miał miejsce w 2018 r., kiedy kobieta zmarła z powodu oparów CO 2 wydobywających się z dużej ilości suchego lodu, którą przewoziła w swoim samochodzie.
Obszary zewnętrzne o podwyższonych stężeniach
Lokalne stężenia dwutlenku węgla mogą osiągać wysokie wartości w pobliżu silnych źródeł, zwłaszcza tych odizolowanych od otaczającego terenu. W gorącym źródle Bossoleto w pobliżu Rapolano Terme w Toskanii we Włoszech, położonym w zagłębieniu w kształcie misy o średnicy około 100 m (330 stóp), stężenie CO 2 wzrasta do ponad 75% w ciągu nocy, co wystarcza do zabijania owadów i małych zwierząt. Po wschodzie słońca gaz jest rozpraszany przez konwekcję. , że wysokie stężenia CO 2 wytwarzane przez zaburzenia głębokich wód jezior nasyconych CO 2 spowodowały 37 ofiar śmiertelnych w jeziorze Monoun w Kamerunie w 1984 r. i 1700 ofiar w jeziorze Nyos w Kamerunie w 1986 r.
Ludzka psychologia
Treść
| Przedział krwi | ( kPa ) | ( mm Hg ) | |
|---|---|---|---|
| Dwutlenek węgla we krwi żylnej | 5,5–6,8 | 41–51 | 41–51 |
| Pęcherzykowe ciśnienie gazów płucnych |
4.8 | 36 | 36 |
| Dwutlenek węgla we krwi tętniczej | 4,7–6,0 | 35–45 | 35–45 |
Ciało wytwarza około 2,3 funta (1,0 kg) dwutlenku węgla dziennie na osobę, zawierającego 0,63 funta (290 g) węgla. U ludzi ten dwutlenek węgla jest przenoszony przez układ żylny i jest wydychany przez płuca, co skutkuje niższymi stężeniami w tętnicach . Zawartość dwutlenku węgla we krwi jest często podawana jako ciśnienie cząstkowe , czyli ciśnienie, jakie miałby dwutlenek węgla, gdyby sam zajmował objętość. U ludzi zawartość dwutlenku węgla we krwi przedstawiono w sąsiedniej tabeli.
Transport we krwi
CO 2 jest przenoszony we krwi na trzy różne sposoby. (Dokładne wartości procentowe różnią się w zależności od krwi tętniczej i żylnej).
- Większość (około 70% do 80%) jest przekształcana w jony wodorowęglanowe HCO - 3 przez enzym anhydrazę węglanową w krwinkach czerwonych, w reakcji CO 2 + H 2 O → H 2 CO 3 → H + + HCO - 3 .
- 5–10% rozpuszcza się w osoczu krwi
- 5–10% wiąże się z hemoglobiną w postaci związków karbaminowych
Hemoglobina , główna cząsteczka przenosząca tlen w czerwonych krwinkach , przenosi zarówno tlen, jak i dwutlenek węgla. Jednak CO2 związany z hemoglobiną nie wiąże się z tym samym miejscem co tlen. Zamiast tego łączy się z N-końcowymi grupami czterech łańcuchów globiny. Jednakże, ze względu na allosteryczne oddziaływanie na cząsteczkę hemoglobiny, wiązanie CO2 zmniejsza ilość tlenu związanego przy danym ciśnieniu cząstkowym tlenu. Jest to znane jako efekt Haldane'a i jest ważne w transporcie dwutlenku węgla z tkanek do płuc. I odwrotnie, wzrost ciśnienia cząstkowego CO 2 lub niższe pH spowoduje odciążenie hemoglobiny od tlenu, co jest znane jako efekt Bohra .
Regulacja oddychania
Dwutlenek węgla jest jednym z mediatorów lokalnej autoregulacji ukrwienia. Jeśli jego stężenie jest wysokie, naczynia włosowate rozszerzają się, umożliwiając większy przepływ krwi do tej tkanki.
Jony wodorowęglanowe są kluczowe dla regulacji pH krwi. Częstotliwość oddychania człowieka wpływa na poziom CO 2 we krwi. Oddychanie zbyt wolne lub płytkie powoduje kwasicę oddechową , podczas gdy oddychanie zbyt szybkie prowadzi do hiperwentylacji , która może powodować zasadowicę oddechową .
Chociaż organizm potrzebuje tlenu do metabolizmu, niski poziom tlenu zwykle nie stymuluje oddychania. Oddychanie jest raczej stymulowane przez wyższy poziom dwutlenku węgla. W rezultacie oddychanie powietrzem o niskim ciśnieniu lub mieszaniną gazów bez tlenu (takich jak czysty azot) może prowadzić do utraty przytomności bez odczuwania głodu powietrza . Jest to szczególnie niebezpieczne dla pilotów myśliwców na dużych wysokościach. Z tego też powodu stewardesy instruują pasażerów, aby w przypadku utraty ciśnienia w kabinie założyli sobie maskę tlenową , zanim udzielą pomocy innym; w przeciwnym razie grozi utrata przytomności.
Ośrodki oddechowe starają się utrzymać tętnicze ciśnienie CO 2 na poziomie 40 mm Hg. Przy zamierzonej hiperwentylacji zawartość CO 2 we krwi tętniczej może spaść do 10-20 mm Hg (zawartość tlenu we krwi jest w niewielkim stopniu zmieniona), a napęd oddechowy jest osłabiony. Dlatego po hiperwentylacji można dłużej wstrzymać oddech niż bez hiperwentylacji. Wiąże się to z ryzykiem utraty przytomności, zanim potrzeba oddychania stanie się przytłaczająca, dlatego hiperwentylacja jest szczególnie niebezpieczna przed nurkowaniem swobodnym.
Stężenia i rola w środowisku
Atmosfera

Dwutlenek węgla w ziemskiej atmosferze jest gazem śladowym , który odgrywa integralną rolę w efekcie cieplarnianym , obiegu węgla , fotosyntezie i oceanicznym obiegu węgla . Jest to jeden z kilku gazów cieplarnianych w atmosferze ziemskiej , które przyczyniają się do zmian klimatu ze względu na rosnącą emisję gazów cieplarnianych w wyniku działalności człowieka. Obecne średnie globalne stężenie CO 2 w atmosferze wynosi 421 ppm według stanu na maj 2022 r. Jest to wzrost o 50% od początku rewolucji przemysłowej , w porównaniu z 280 ppm w ciągu 10 000 lat przed połową XVIII wieku. Wzrost wynika z działalności człowieka . Spalanie paliw kopalnych jest główną przyczyną zwiększonego stężenia CO2 , a także główną przyczyną zmian klimatycznych. Inne duże źródła antropogeniczne obejmują produkcję cementu, wylesianie i spalanie biomasy.
dwutlenek węgla jest przezroczysty dla światła widzialnego , jest gazem cieplarnianym, pochłaniającym i emitującym promieniowanie podczerwone o dwóch aktywnych w podczerwieni częstotliwościach wibracyjnych. CO 2 pochłania i emituje promieniowanie podczerwone o długości fali 4,26 μm (2347 cm -1 ) ( tryb drgań z asymetrycznym rozciąganiem ) i 14,99 μm (667 cm -1 ) (tryb drgań zginających). Odgrywa znaczącą rolę we wpływaniu na Ziemi poprzez efekt cieplarniany. Emisja światła z powierzchni Ziemi jest najbardziej intensywna w zakresie podczerwieni między 200 a 2500 cm -1 , w przeciwieństwie do emisji światła ze znacznie gorętszego Słońca, które jest najbardziej intensywne w obszarze widzialnym. Absorpcja światła podczerwonego o częstotliwościach drgań atmosferycznego CO 2 zatrzymuje energię w pobliżu powierzchni, ogrzewając powierzchnię i niższe warstwy atmosfery. Mniej energii dociera do górnych warstw atmosfery, która z powodu tej absorpcji jest chłodniejsza.
Wzrost stężenia atmosferycznego CO 2 i innych długożyciowych gazów cieplarnianych, takich jak metan , podtlenek azotu i ozon , zwiększa absorpcję i emisję promieniowania podczerwonego przez atmosferę, powodując obserwowany wzrost średniej globalnej temperatury i zakwaszenie oceanów . Kolejnym efektem bezpośrednim jest efekt nawożenia CO 2 . Zmiany te powodują szereg pośrednich skutków zmian klimatu dla środowiska fizycznego, ekosystemów i społeczności ludzkich. Dwutlenek węgla wywiera większy ogólny wpływ na ocieplenie niż wszystkie inne gazy cieplarniane razem wzięte. Ma czas życia w atmosferze , który wzrasta wraz ze skumulowaną ilością wydobywanego i spalanego węgla kopalnego, ze względu na brak równowagi, jaki ta aktywność narzuciła szybkiemu obiegowi węgla na Ziemi . Oznacza to, że pewna część (przewidywane 20-35%) dotychczas przeniesionego węgla kopalnego będzie się utrzymywać w atmosferze jako podwyższone poziomy CO 2 przez wiele tysięcy lat po tym, jak aktywność przenoszenia węgla zacznie słabnąć. Cykl węglowy to cykl biogeochemiczny, w którym węgiel jest wymieniany między ziemskimi oceanami , glebą, skałami i biosferą . Rośliny i inne fotoautotrofy wykorzystują energię słoneczną do produkcji węglowodanów z atmosferycznego dwutlenku węgla i wody w procesie fotosyntezy . Prawie wszystkie inne organizmy są uzależnione od węglowodanów pochodzących z fotosyntezy jako podstawowego źródła energii i związków węgla.
Obecne stężenie CO 2 w atmosferze jest najwyższe od 14 milionów lat. Stężenie CO 2 w atmosferze dochodziło do 4000 ppm w okresie kambru około 500 milionów lat temu, kiedy to stężenie było 20 razy większe niż obecnie, i do 180 ppm podczas czwartorzędowego zlodowacenia ostatnich dwóch milionów lat. Zrekonstruowane zapisy temperatur z ostatnich 420 milionów lat wskazują, że stężenie CO 2 w atmosferze osiągnęło wartość szczytową ~2000 ppm w okresie dewonu (~400 mln lat temu) i ponownie w okresie triasu (220-200 mln lat) i było czterokrotnie wyższe niż obecne w okresie Okres jurajski (201-145 mln lat).Oceany
zakwaszenie oceanu
Dwutlenek węgla rozpuszcza się w oceanie, tworząc kwas węglowy (H 2 CO 3 ), wodorowęglan (HCO 3 − ) i węglan (CO 3 2− ). W oceanach rozpuszczonych jest około pięćdziesiąt razy więcej dwutlenku węgla niż w atmosferze. Oceany pełnią rolę ogromnego pochłaniacza dwutlenku węgla i pochłonęły około jednej trzeciej CO2 emitowanego w wyniku działalności człowieka.

Zmiany w chemii oceanów mogą mieć rozległy bezpośredni i pośredni wpływ na organizmy i ich siedliska. Jednym z najważniejszych skutków rosnącej kwasowości oceanów jest wytwarzanie muszli z węglanu wapnia ( CaCO
3 ). Proces ten nazywany jest zwapnieniem i jest ważny dla biologii i przetrwania wielu organizmów morskich. Zwapnienie obejmuje wytrącanie rozpuszczonych jonów w stałe struktury CaCO
3 , struktury wielu organizmów morskich, takich jak coccolithophores , foraminifera , skorupiaki , mięczaki itp. Po ich utworzeniu te struktury CaCO
3 są podatne na rozpuszczenie , chyba że otaczająca woda morska zawiera nasycone stężenia jonów węglanowych (CO 3 2− ).
Kominy hydrotermalne
Dwutlenek węgla jest również wprowadzany do oceanów przez kominy hydrotermalne. Otwór w Szampanii , znaleziony na północno-zachodnim wulkanie Eifuku w Rowie Mariana , wytwarza prawie czysty ciekły dwutlenek węgla, jedno z zaledwie dwóch znanych miejsc na świecie od 2004 r., Drugie znajduje się w niecce Okinawa . Znalezienie podwodnego jeziora ciekłego dwutlenku węgla w niecce Okinawy odnotowano w 2006 roku.
Produkcja
Procesy biologiczne
Dwutlenek węgla jest produktem ubocznym fermentacji cukru przy warzeniu piwa , whisky i innych napojów alkoholowych oraz przy produkcji bioetanolu . Drożdże metabolizują cukier w celu wytworzenia CO 2 i etanolu , znanego również jako alkohol, w następujący sposób:
Wszystkie organizmy tlenowe wytwarzają CO2 podczas utleniania węglowodanów , kwasów tłuszczowych i białek . Duża liczba zachodzących reakcji jest niezwykle złożona i niełatwa do opisania. Patrz ( oddychanie komórkowe , oddychanie beztlenowe i fotosynteza ). Równanie oddychania glukozy i innych cukrów prostych jest następujące:
Organizmy beztlenowe rozkładają materię organiczną, wytwarzając metan i dwutlenek węgla wraz ze śladowymi ilościami innych związków. Niezależnie od rodzaju materiału organicznego wytwarzanie gazów odbywa się zgodnie z dobrze określonym schematem kinetycznym . Dwutlenek węgla stanowi około 40–45% gazu powstającego w wyniku rozkładu na składowiskach odpadów (określanego jako „ gaz wysypiskowy ”). Większość z pozostałych 50–55% to metan.
Procesy przemysłowe
Dwutlenek węgla można otrzymać przez destylację z powietrza, ale metoda ta jest nieefektywna. W przemyśle dwutlenek węgla jest głównie nieodzyskiwanym produktem odpadowym, wytwarzanym kilkoma metodami, które mogą być stosowane w różnych skalach.
Spalanie
Spalanie wszystkich paliw opartych na węglu , takich jak metan ( gaz ziemny ), destylaty ropy naftowej ( benzyna , olej napędowy , nafta , propan ), węgiel, drewno i ogólna materia organiczna wytwarza dwutlenek węgla i , z wyjątkiem czystego węgla, wodę . Na przykład reakcja chemiczna między metanem a tlenem :
Żelazo jest redukowane z jego tlenków za pomocą koksu w wielkim piecu , w wyniku czego powstaje surówka i dwutlenek węgla:
Produkt uboczny przy produkcji wodoru
Dwutlenek węgla jest produktem ubocznym przemysłowej produkcji wodoru w procesie reformingu parowego i reakcji przemiany gazu wodnego w produkcji amoniaku . Procesy te rozpoczynają się od reakcji wody i gazu ziemnego (głównie metanu). Jest to główne źródło dwutlenku węgla przeznaczonego do kontaktu z żywnością, wykorzystywanego do nasycania dwutlenkiem węgla piwa i napojów bezalkoholowych , a także do ogłuszania zwierząt, takich jak drób . Latem 2018 roku w Europie pojawił się niedobór dwutlenku węgla do tych celów w związku z czasowym wyłączeniem kilku instalacji amoniaku do celów remontowych.
Rozkład termiczny wapienia
Jest wytwarzany przez rozkład termiczny wapienia, CaCO 3 przez ogrzewanie ( kalcynację ) w temperaturze około 850 ° C (1560 ° F), w produkcji wapna palonego ( tlenek wapnia , CaO ), związku, który ma wiele zastosowań przemysłowych:
Kwasy uwalniają CO 2 z większości węglanów metali. W związku z tym można go pozyskiwać bezpośrednio z naturalnych źródeł dwutlenku węgla , gdzie powstaje w wyniku działania zakwaszonej wody na wapień lub dolomit . Reakcję między kwasem chlorowodorowym a węglanem wapnia (wapień lub kreda) przedstawiono poniżej:
Następnie kwas węglowy ( H 2 CO 3 ) rozkłada się na wodę i CO 2 :
Takim reakcjom towarzyszy pienienie lub bulgotanie lub jedno i drugie podczas uwalniania gazu. Mają szerokie zastosowanie w przemyśle, ponieważ mogą być wykorzystywane do neutralizacji strumieni kwasów odpadowych.
Zastosowania komercyjne
Dwutlenek węgla jest wykorzystywany przez przemysł spożywczy, naftowy i chemiczny. Związek ma różne zastosowania komercyjne, ale jednym z jego największych zastosowań jako substancji chemicznej jest produkcja napojów gazowanych; nadaje blasku napojom gazowanym, takim jak woda sodowa, piwo i wino musujące.
Prekursor chemikaliów
W przemyśle chemicznym dwutlenek węgla jest zużywany głównie jako składnik do produkcji mocznika , a mniejsza jego część jest wykorzystywana do produkcji metanolu i szeregu innych produktów. Niektóre pochodne kwasu karboksylowego, takie jak salicylan sodu , są przygotowywane przy użyciu CO2 w reakcji Kolbe-Schmitta .
Oprócz konwencjonalnych procesów wykorzystujących CO 2 do produkcji chemicznej, metody elektrochemiczne są również badane na poziomie badawczym. W szczególności wykorzystanie energii odnawialnej do produkcji paliw z CO 2 (takich jak metanol) jest atrakcyjne, ponieważ mogłoby to skutkować paliwami, które mogłyby być łatwo transportowane i wykorzystywane w ramach konwencjonalnych technologii spalania, ale nie emitują netto CO 2 .
Rolnictwo
Rośliny potrzebują dwutlenku węgla do przeprowadzenia fotosyntezy. Atmosfery szklarni mogą (jeśli są duże, muszą) być wzbogacone dodatkowym CO 2 w celu podtrzymania i zwiększenia tempa wzrostu roślin. Przy bardzo wysokich stężeniach (100-krotność stężenia atmosferycznego lub więcej) dwutlenek węgla może być toksyczny dla życia zwierząt, więc podniesienie stężenia do 10 000 ppm (1%) lub więcej na kilka godzin wyeliminuje szkodniki, takie jak mączliki i przędziorków w szklarnia.
Żywność
Dwutlenek węgla to dodatek do żywności stosowany jako propelent i regulator kwasowości w przemyśle spożywczym. Jest dopuszczony do użytku w UE (wymieniony jako numer E290), USA, Australii i Nowej Zelandii (wymieniony pod numerem INS 290).
Cukierek o nazwie Pop Rocks jest poddawany działaniu dwutlenku węgla pod ciśnieniem około 4000 kPa (40 barów ; 580 psi ). Po włożeniu do ust rozpuszcza się (podobnie jak inne twarde cukierki) i uwalnia pęcherzyki gazu ze słyszalnym trzaskiem.
Środki spulchniające powodują wzrost ciasta poprzez wytwarzanie dwutlenku węgla. Drożdże piekarskie wytwarzają dwutlenek węgla w wyniku fermentacji cukrów w cieście, podczas gdy chemiczne środki spulchniające, takie jak proszek do pieczenia i soda oczyszczona , uwalniają dwutlenek węgla po podgrzaniu lub wystawieniu na działanie kwasów .
Napoje
Dwutlenek węgla jest używany do produkcji napojów gazowanych i wody sodowej . Tradycyjnie gazowanie piwa i wina musującego odbywało się w drodze naturalnej fermentacji, ale wielu producentów gazuje te napoje dwutlenkiem węgla odzyskanym z procesu fermentacji. W przypadku piwa butelkowanego i beczkowanego najpowszechniej stosowaną metodą jest nasycanie dwutlenkiem węgla pochodzącym z recyklingu. Z wyjątkiem brytyjskiego real ale , piwo z beczki jest zwykle przenoszone z beczek w chłodni lub piwnicy do kranów na barze za pomocą dwutlenku węgla pod ciśnieniem, czasami zmieszanego z azotem.
Smak wody sodowej (i związane z nim doznania smakowe w innych napojach gazowanych) jest raczej efektem rozpuszczonego dwutlenku węgla niż pękających pęcherzyków gazu. Anhydraza węglanowa 4 przekształca się w kwas węglowy , co prowadzi do kwaśnego smaku, a rozpuszczony dwutlenek węgla wywołuje reakcję somatosensoryczną .
Produkcja wina
Dwutlenek węgla w postaci suchego lodu jest często używany w fazie zimnego namaczania w produkcji wina do szybkiego schłodzenia kiści winogron po zbiorze, aby zapobiec spontanicznej fermentacji przez dzikie drożdże . Główną zaletą stosowania suchego lodu zamiast lodu wodnego jest to, że chłodzi winogrona bez dodawania dodatkowej wody, która mogłaby zmniejszyć stężenie cukru w moszczu gronowym , a tym samym stężenie alkoholu w gotowym winie. Dwutlenek węgla jest również używany do tworzenia niedotlenionego środowiska do maceracji węglowej , procesu stosowanego do produkcji wina Beaujolais .
Dwutlenek węgla jest czasami używany do uzupełniania butelek wina lub innych pojemników do przechowywania , takich jak beczki, aby zapobiec utlenianiu, chociaż ma problem z rozpuszczaniem się w winie, powodując lekkie musowanie wcześniej niegazowanego wina. Z tego powodu profesjonalni producenci wina preferują do tego procesu inne gazy, takie jak azot lub argon .
Oszałamiające zwierzęta
Dwutlenek węgla jest często używany do „ogłuszania” zwierząt przed ubojem. „Ogłuszanie” może być mylącym określeniem, ponieważ zwierzęta nie są natychmiast ogłuszone i mogą odczuwać niepokój.
Gaz obojętny
Dwutlenek węgla jest jednym z najczęściej stosowanych gazów sprężonych w układach pneumatycznych (gaz pod ciśnieniem) w przenośnych narzędziach ciśnieniowych. Dwutlenek węgla jest również używany jako atmosfera podczas spawania , chociaż w łuku spawalniczym reaguje utleniając większość metali. Zastosowanie w przemyśle motoryzacyjnym jest powszechne pomimo istotnych dowodów na to, że spoiny wykonane w dwutlenku węgla są bardziej kruche niż te wykonane w bardziej obojętnej atmosferze. [ potrzebne źródło ] W przypadku spawania MIG , użycie CO 2 jest czasami określane jako spawanie MAG, w przypadku gazu aktywnego metalicznie, ponieważ CO 2 może reagować w tak wysokich temperaturach. Ma tendencję do tworzenia gorętszej kałuży niż prawdziwie obojętna atmosfera, co poprawia charakterystykę przepływu. Chociaż może to być spowodowane reakcjami atmosferycznymi zachodzącymi w miejscu kałuży. Jest to zwykle przeciwieństwo pożądanego efektu podczas spawania, ponieważ ma tendencję do kruchości miejsca, ale może nie stanowić problemu w przypadku ogólnego spawania stali miękkiej, gdzie ostateczna plastyczność nie jest głównym problemem.
Dwutlenek węgla jest stosowany w wielu produktach konsumpcyjnych, które wymagają gazu pod ciśnieniem, ponieważ jest niedrogi i niepalny oraz ponieważ przechodzi przemianę fazową z gazu w ciecz w temperaturze pokojowej przy osiągalnym ciśnieniu około 60 barów (870 psi ; 59 atm ) , umożliwiając o wiele więcej dwutlenku węgla, aby zmieścić się w danym pojemniku, niż w innym przypadku. Kamizelki ratunkowe często zawierają kanistry z dwutlenkiem węgla pod ciśnieniem do szybkiego napełniania. Aluminiowe kapsułki CO 2 są również sprzedawane jako zapas sprężonego gazu do wiatrówek , markerów/pistoletów do paintballa , pompowania opon rowerowych oraz do produkcji wody gazowanej . Wysokie stężenia dwutlenku węgla mogą być również wykorzystywane do zabijania szkodników. Ciekły dwutlenek węgla znajduje zastosowanie w suszeniu nadkrytycznym niektórych produktów spożywczych i materiałów technologicznych, w przygotowaniu preparatów do skaningowej mikroskopii elektronowej oraz w odkofeinowaniu ziaren kawy .
Gaśnica
Dwutlenek węgla może być użyty do gaszenia płomieni przez zalanie gazem otoczenia wokół płomienia. Sam nie reaguje, aby zgasić płomień, ale pozbawia płomień tlenu, wypierając go. Niektóre gaśnice , zwłaszcza przeznaczone do pożarów urządzeń elektrycznych , zawierają ciekły dwutlenek węgla pod ciśnieniem. Gaśnice z dwutlenkiem węgla dobrze sprawdzają się w przypadku małych pożarów cieczy łatwopalnych i urządzeń elektrycznych, ale nie w przypadku zwykłych pożarów palnych, ponieważ nie chłodzą znacznie palących się substancji, a gdy dwutlenek węgla się rozproszy, mogą się zapalić pod wpływem tlenu atmosferycznego . Stosowane są głównie w serwerowniach.
Dwutlenek węgla znalazł również szerokie zastosowanie jako środek gaśniczy w stałych instalacjach przeciwpożarowych do miejscowego zwalczania określonych zagrożeń i całkowitego zalania chronionej przestrzeni. Normy Międzynarodowej Organizacji Morskiej uznają systemy dwutlenku węgla do ochrony przeciwpożarowej ładowni statków i maszynowni. Systemy ochrony przeciwpożarowej oparte na dwutlenku węgla były powiązane z kilkoma zgonami, ponieważ może on powodować uduszenie w wystarczająco wysokich stężeniach. Przegląd systemów CO 2 zidentyfikował 51 incydentów między 1975 r. a datą raportu (2000 r.), w wyniku których zginęły 72 osoby, a 145 zostało rannych.
Nadkrytyczny CO 2 jako rozpuszczalnik
Ciekły dwutlenek węgla jest dobrym rozpuszczalnikiem wielu lipofilowych związków organicznych i służy do usuwania kofeiny z kawy . Dwutlenek węgla zwrócił uwagę przemysłu farmaceutycznego i innych gałęzi przemysłu chemicznego jako mniej toksyczna alternatywa dla bardziej tradycyjnych rozpuszczalników, takich jak chlorki organiczne . Z tego powodu jest również używany przez niektóre pralnie chemiczne . Jest stosowany do wytwarzania niektórych aerożeli ze względu na właściwości dwutlenku węgla w stanie nadkrytycznym.
Zastosowania medyczne i farmakologiczne
W medycynie do tlenu dodaje się do 5% dwutlenku węgla (stężenie 130 razy atmosferyczne) w celu stymulacji oddychania po bezdechu i stabilizacji równowagi O 2 / CO 2 we krwi.
Dwutlenek węgla można mieszać z maksymalnie 50% tlenem, tworząc gaz do wdychania; jest to znane jako Carbogen i ma wiele zastosowań medycznych i badawczych.
Innym zastosowaniem medycznym są mofety , suche uzdrowiska, które wykorzystują dwutlenek węgla z wyładowań powulkanicznych do celów terapeutycznych.
Energia
Nadkrytyczny CO 2 jest używany jako płyn roboczy w silniku cyklu mocy Allama .
Odzyskiwanie paliw kopalnych
Dwutlenek węgla jest stosowany we wzmocnionym wydobyciu ropy naftowej , gdzie jest wtryskiwany do szybów naftowych lub w ich okolice, zwykle w warunkach nadkrytycznych , kiedy staje się mieszalny z ropą naftową. Takie podejście może zwiększyć pierwotny odzysk ropy poprzez zmniejszenie nasycenia pozostałości olejem o 7–23% dodatkowo w stosunku do pierwotnej ekstrakcji . Działa zarówno jako czynnik zwiększający ciśnienie, jak i po rozpuszczeniu w podziemnej ropie naftowej znacznie zmniejsza jej lepkość i zmieniając chemię powierzchni, umożliwiając szybszy przepływ ropy przez złoże do szybu wydobywczego. Na dojrzałych polach naftowych stosuje się rozległe sieci rurociągów do przenoszenia dwutlenku węgla do punktów zatłaczania.
W przypadku zwiększonego odzyskiwania metanu z pokładów węgla dwutlenek węgla byłby pompowany do pokładu węgla w celu wyparcia metanu, w przeciwieństwie do obecnych metod, które polegają głównie na usuwaniu wody (w celu zmniejszenia ciśnienia) w celu uwolnienia uwięzionego metanu w pokładach węgla.
Bioprzemiana w paliwo
Zaproponowano, aby CO 2 z produkcji energii był wprowadzany do stawów w celu stymulowania wzrostu glonów , które następnie mogłyby zostać przekształcone w biodiesel . Szczep cyjanobakterii Synechococcus elongatus został zmodyfikowany genetycznie w celu wytwarzania paliw, aldehydu izomasłowego i izobutanolu z CO 2 w procesie fotosyntezy.
Naukowcy opracowali proces zwany elektrolizą, wykorzystujący enzymy wyizolowane z bakterii do napędzania reakcji chemicznych przekształcających CO 2 w paliwa.
Chłodziwo
Ciekły i stały dwutlenek węgla to ważne czynniki chłodnicze , zwłaszcza w przemyśle spożywczym, gdzie są wykorzystywane podczas transportu i przechowywania lodów i innych mrożonek. Stały dwutlenek węgla nazywany jest „suchym lodem” i jest używany do małych przesyłek, w których sprzęt chłodniczy jest niepraktyczny. Stały dwutlenek węgla jest zawsze poniżej -78,5 ° C (-109,3 ° F) przy normalnym ciśnieniu atmosferycznym, niezależnie od temperatury powietrza.
Ciekły dwutlenek węgla (nomenklatura branżowa R744 lub R-744) był używany jako czynnik chłodniczy przed użyciem [ potrzebne źródło ] dichlorodifluorometanu (R12, związek chlorofluorowęglowodoru (CFC)) . CO 2 może przeżywać renesans, ponieważ jeden z głównych substytutów CFC, 1,1,1,2-tetrafluoroetan ( R134a , związek wodorofluorowęglowodoru (HFC)) przyczynia się do zmian klimatu bardziej niż CO 2 . Właściwości fizyczne CO 2 są bardzo korzystne dla celów chłodzenia, chłodzenia i ogrzewania, mając wysoką objętościową wydajność chłodzenia. Ze względu na konieczność pracy przy ciśnieniu do 130 barów (1900 psi; 13 000 kPa), systemy CO 2 wymagają wysoce odpornych mechanicznie zbiorników i komponentów, które zostały już opracowane do masowej produkcji w wielu sektorach. W klimatyzacji samochodowej, w ponad 90% wszystkich warunków jazdy na szerokościach geograficznych powyżej 50°, CO 2 (R744) działa wydajniej niż systemy wykorzystujące HFC (np. R134a). Jego zalety środowiskowe ( GWP równy 1, brak niszczenia warstwy ozonowej, nietoksyczny, niepalny) mogą sprawić, że w przyszłości płyn roboczy zastąpi obecne HFC w samochodach, supermarketach i podgrzewaczach wody z pompą ciepła, między innymi. Coca-Cola wprowadziła chłodziarki do napojów na bazie CO2, a armia amerykańska jest zainteresowana technologią chłodzenia i ogrzewania CO2 .
Drobne zastosowania

Dwutlenek węgla jest medium laserowym w laserze na dwutlenek węgla , który jest jednym z najwcześniejszych rodzajów laserów.
Dwutlenek węgla może być stosowany jako środek kontrolujący pH basenów, poprzez ciągłe dodawanie gazu do wody, zapobiegając w ten sposób wzrostowi pH. Jedną z zalet tego rozwiązania jest uniknięcie obchodzenia się z (bardziej niebezpiecznymi) kwasami. Podobnie jest również stosowany w akwariach rafowych , gdzie jest powszechnie stosowany w reaktorach wapniowych do tymczasowego obniżenia pH wody przepuszczanej przez węglan wapnia , aby umożliwić swobodniejsze rozpuszczanie się węglanu wapnia w wodzie, gdzie jest używany przez niektóre koralowce do budowy szkieletu.
Używany jako główny czynnik chłodzący w brytyjskim zaawansowanym reaktorze chłodzonym gazem do wytwarzania energii jądrowej.
Indukcja dwutlenku węgla jest powszechnie stosowana do eutanazji zwierząt laboratoryjnych. Sposoby podawania CO2 obejmują umieszczanie zwierząt bezpośrednio w zamkniętej, wstępnie napełnionej komorze zawierającej CO2 lub wystawianie na stopniowo wzrastające stężenie CO2 . Wytyczne Amerykańskiego Stowarzyszenia Lekarzy Weterynarii na rok 2020 dotyczące indukcji dwutlenku węgla stanowią, że szybkość przemieszczania wynosząca 30–70% objętości komory lub klatki na minutę jest optymalna do humanitarnej eutanazji małych gryzoni. Procent CO 2 różni się dla różnych gatunków, w oparciu o zidentyfikowane optymalne wartości procentowe w celu zminimalizowania stresu.
Dwutlenek węgla jest również używany w kilku powiązanych technikach czyszczenia i przygotowania powierzchni .
Historia odkrycia

Dwutlenek węgla był pierwszym gazem opisanym jako dyskretna substancja. Około 1640 roku flamandzki chemik Jan Baptist van Helmont zauważył, że kiedy spalał węgiel drzewny w zamkniętym naczyniu, masa powstałego popiołu była znacznie mniejsza niż masa pierwotnego węgla drzewnego. Jego interpretacja była taka, że reszta węgla drzewnego została przekształcona w niewidzialną substancję, którą nazwał „gazem” lub „dzikim duchem” ( spiritus sylvestris ).
Właściwości dwutlenku węgla były dalej badane w latach pięćdziesiątych XVIII wieku przez szkockiego lekarza Josepha Blacka . Odkrył, że wapień ( węglan wapnia ) można podgrzać lub potraktować kwasami , aby uzyskać gaz, który nazwał „stałym powietrzem”. Zauważył, że nieruchome powietrze jest gęstsze od powietrza i nie podtrzymuje ani płomienia, ani życia zwierząt. Black odkrył również, że podczas przepuszczania bąbelków przez wodę wapienną (nasycony wodny roztwór wodorotlenku wapnia ) wytrąciłby się węglan wapnia. Użył tego zjawiska, aby zilustrować, że dwutlenek węgla jest wytwarzany przez oddychanie zwierząt i fermentację mikrobiologiczną. W 1772 roku angielski chemik Joseph Priestley opublikował artykuł zatytułowany Impregnating Water with Fixed Air, w którym opisał proces kapania kwasu siarkowego (lub oleju witriolowego , jak go znał Priestley) na kredę w celu wytworzenia dwutlenku węgla i zmuszenia gazu do rozpuścić, mieszając miskę z wodą w kontakcie z gazem.
Dwutlenek węgla został po raz pierwszy skroplony (przy podwyższonym ciśnieniu) w 1823 roku przez Humphry'ego Davy'ego i Michaela Faradaya . Najwcześniejszy opis stałego dwutlenku węgla ( suchy lód ) został podany przez francuskiego wynalazcę Adriena-Jeana-Pierre'a Thiloriera , który w 1835 roku otworzył pojemnik z ciekłym dwutlenkiem węgla pod ciśnieniem, tylko po to, by stwierdzić, że chłodzenie wywołane szybkim odparowaniem cieczy dał „śnieg” stałego CO 2 .
Zobacz też
- Gazometria krwi tętniczej — badanie krwi pobranej z tętnicy, które mierzy ilość niektórych rozpuszczonych gazów
- Reakcja Boscha - tworzy węgiel elementarny z CO2 i wodoru przy użyciu metalicznego katalizatora
- Usuwanie dwutlenku węgla - Usuwanie atmosferycznego dwutlenku węgla (z atmosfery)
- Lista elektrowni najmniej wydajnych pod względem emisji dwutlenku węgla
- Lista krajów według emisji dwutlenku węgla
- Jezioro meromiktyczne - trwale uwarstwione jezioro z warstwami wody, które się nie mieszają
- Gilbert Plass – kanadyjski fizyk (wczesne prace nad CO 2 i zmianami klimatycznymi)
- Reakcja Sabatiera – Proces metanizacji dwutlenku węgla wodorem
- NASA's Orbiting Carbon Observatory 2 - satelita klimatyczny NASA
- Satelita do obserwacji gazów cieplarnianych – satelita do obserwacji Ziemi
- Gaz glebowy – glebowa wymiana gazów między korzeniami roślin a atmosferą
Linki zewnętrzne
|
Zasoby biblioteczne dotyczące dwutlenku węgla |
- Aktualna globalna mapa stężenia dwutlenku węgla
- CDC – kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych – dwutlenek węgla
- Trendy atmosferycznego dwutlenku węgla (NOAA)
- Bezwodniki kwasowe
- Kwaśne tlenki
- Dwutlenek węgla
- Płyny chłodzące
- Dodatki o numerze E
- Środki gaśnicze
- Gazowe cząsteczki sygnałowe
- Gazy cieplarniane
- Domowe środki chemiczne
- Rozpuszczalniki nieorganiczne
- Media wzmacniające laser
- Chłodziwa reaktorów jądrowych
- oksywęglowodory
- propelenty
- Czynniki chłodnicze
- Cząsteczki trójatomowe



![{\displaystyle K_{\mathrm {h} }={\frac {{\ce {[H2CO3]}}}{{\ce {[CO2_{(aq)}]}}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)

![{\displaystyle K_{\mathrm {a1} }={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{\displaystyle K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3] + [CO2_{(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)