Cyjanowodór
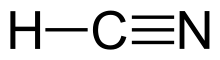
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
nazwa IUPAC
|
|||
Inne nazwy
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| CHEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.000.747 | ||
| Numer WE |
|
||
| KEGG | |||
| Siatka | Wodór + Cyjanek | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 1051 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| HCN | |||
| Masa cząsteczkowa | 27,0253 g/mol | ||
| Wygląd | Bezbarwna ciecz lub gaz | ||
| Zapach | Migdałowy [ potrzebne źródło ] | ||
| Gęstość | 0,6876 g/ cm3 | ||
| Temperatura topnienia | -13,29 ° C (8,08 ° F; 259,86 K) | ||
| Temperatura wrzenia | 26 ° C (79 ° F; 299 K) | ||
| Mieszalny | |||
| Rozpuszczalność w etanolu | Mieszalny | ||
| Ciśnienie pary | 100 kPa (25°C) | ||
|
Stała prawa Henry'ego
( k H ) |
75 μmol Pa- 1 kg -1 | ||
| Kwasowość ( p Ka ) | 9,21 (w wodzie), 12,9 (w DMSO) |
||
| Zasadowość (p K b ) | 4,79 (anion cyjankowy) | ||
| Kwas sprzężony | hydrocyjanonium | ||
| Baza sprzężona | Cyjanek | ||
|
Współczynnik załamania światła ( n D )
|
1,2675 | ||
| Lepkość | 0,183 mPa·s (25 °C) | ||
| Struktura | |||
| do ∞w | |||
| Liniowy | |||
| 2,98 D | |||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
35,9 JK -1 mol -1 (gaz) | ||
|
Standardowa entropia molowa ( S ⦵ 298 ) |
201,8 JK -1 mol -1 | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
135,1 kJ mol -1 | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
   
|
|||
| Niebezpieczeństwo | |||
| H225 , H300 , H310 , H319 , H330 , H336 , H370 , H410 | |||
| P210 , P261 , P305+P351+P338 | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | -17,8 ° C (0,0 ° F; 255,3 K) | ||
| 538 ° C (1000 ° F; 811 K) | |||
| Wybuchowe granice | 5,6% – 40,0% | ||
| Śmiertelna dawka lub stężenie (LD, LC): | |||
|
LC 50 ( mediana stężenia )
|
501 ppm (szczur, 5 min) 323 ppm (mysz, 5 min) 275 ppm (szczur, 15 min) 170 ppm (szczur, 30 min) 160 ppm (szczur, 30 min) 323 ppm (szczur, 5 min) |
||
|
LC Lo ( najniższy opublikowany )
|
200 ppm (ssak, 5 min) 36 ppm (ssak, 2 godz.) 107 ppm (człowiek, 10 min) 759 ppm (królik, 1 min) 759 ppm (kot, 1 min) 357 ppm (człowiek, 2 min) 179 ppm (człowiek, 1 godz.) |
||
| NIOSH (limity ekspozycji na zdrowie w USA): | |||
|
PEL (dopuszczalny)
|
TWA 10 ppm (11 mg/m 3 ) [skóra] | ||
|
REL (zalecane)
|
ST 4,7 ppm (5 mg/m 3 ) [skóra] | ||
|
IDLH (bezpośrednie zagrożenie)
|
50 str./min | ||
| Związki pokrewne | |||
|
Powiązane alkanonitryle
|
|||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Cyjanowodór , zwany czasem kwasem pruskim , jest związkiem chemicznym o wzorze HCN i strukturze H−C≡N . Jest to bezbarwna, wyjątkowo trująca i łatwopalna ciecz, która wrze nieco powyżej temperatury pokojowej , w temperaturze 25,6 ° C (78,1 ° F). HCN jest produkowany na skalę przemysłową i jest wysoko cenionym prekursorem wielu związków chemicznych począwszy od polimerów do farmaceutyków. Zastosowania na dużą skalę dotyczą produkcji cyjanku potasu i adyponitrylu , stosowanych odpowiednio w górnictwie i tworzywach sztucznych. Jest bardziej toksyczny niż stałe związki cyjanku ze względu na swój lotny charakter.
Struktura i właściwości ogólne
Cyjanowodór jest cząsteczką liniową , z potrójnym wiązaniem między węglem i azotem . Tautomerem HCN jest HNC, izocyjanek wodoru .
Cyjanowodór jest słabo kwaśny , a p Ka wynosi 9,2. Częściowo jonizuje w roztworze wodnym , dając anion cyjankowy CN - . Roztwór cyjanowodoru w wodzie , reprezentowany jako HCN, nazywa się kwasem cyjanowodorowym . Sole anionu cyjankowego są znane jako cyjanki .
HCN ma słaby zapach przypominający gorzkie migdały , którego niektórzy ludzie nie są w stanie wykryć z powodu recesywnej cechy genetycznej . Lotny związek był używany jako inhalacyjny rodentycyd i trucizna dla ludzi , a także do zabijania wielorybów. Jony cyjankowe zakłócają enzymy oddechowe zawierające żelazo.
Właściwości chemiczne
Cyjanowodór będzie reagował z alkenami pod wpływem katalizy kompleksów niklu. Ta reakcja nazywa się hydrocyjanowaniem .
- RCH=CH2 + HCN → RCH2 - CH2 - CN
Cztery cząsteczki HCN ulegną tetrameryzacji do diaminomaleonitrylu , który można przekształcić w różne puryny.
Historia odkrycia
Cyjanowodór został po raz pierwszy wyizolowany z niebieskiego pigmentu ( błękitu pruskiego ), który był znany od 1706 roku, ale którego struktura była nieznana. Obecnie wiadomo, że jest to polimer koordynacyjny o złożonej strukturze i empirycznym wzorze uwodnionego żelazocyjanku żelaza . W 1752 roku francuski chemik Pierre Macquer dokonał ważnego kroku, pokazując, że błękit pruski można przekształcić w tlenek żelaza plus lotny składnik i że można ich użyć do jego odtworzenia. Nowym składnikiem był tak zwany cyjanowodór. Podążając za przykładem Macquera, został po raz pierwszy przygotowany z błękitu pruskiego przez szwedzkiego chemika Carla Wilhelma Scheele w 1782 roku i ostatecznie otrzymał niemiecką nazwę Blausäure ( dosł . „Niebieski kwas”) ze względu na jego kwaśny charakter w wodzie i pochodzenie od błękitu pruskiego . W języku angielskim stał się znany jako kwas pruski.
W 1787 roku francuski chemik Claude Louis Berthollet wykazał, że kwas pruski nie zawiera tlenu, co stanowi ważny wkład w teorię kwasów, która dotychczas postulowała, że kwasy muszą zawierać tlen (stąd sama nazwa tlenu , która pochodzi od greckich pierwiastków oznaczających „kwasotwórcze” i są również określane po niemiecku jako Sauerstoff ). W 1811 roku Joseph Louis Gay-Lussac przygotował czysty, skroplony cyjanowodór. W 1815 roku Gay-Lussac wydedukował wzór chemiczny kwasu pruskiego. Radykalny cyjanek w cyjanowodorze nadano jej nazwę od cyjanu , nie tylko angielskiego słowa oznaczającego odcień niebieskiego, ale także greckiego słowa oznaczającego niebieski ( starogrecki : κύανος ), ponownie ze względu na jego pochodzenie od błękitu pruskiego .
Produkcja i synteza
Cyjanowodór tworzy się w co najmniej ograniczonych ilościach z wielu kombinacji wodoru, węgla i amoniaku . Cyjanowodór jest obecnie wytwarzany w dużych ilościach w kilku procesach, a także jest odzyskiwanym produktem odpadowym z produkcji akrylonitrylu . W 2006 roku w Stanach Zjednoczonych wyprodukowano od 500 milionów do 1 miliarda funtów (od 230 000 do 450 000 ton).
Najważniejszym procesem jest utlenianie Andrussowa wynalezione przez Leonida Andrussowa z IG Farben, w którym metan i amoniak reagują w obecności tlenu w temperaturze około 1200 ° C (2190 ° F) nad katalizatorem platynowym :
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
Energii potrzebnej do reakcji dostarcza częściowe utlenianie metanu i amoniaku.
Mniejsze znaczenie ma proces Degussy ( proces BMA ), w którym nie dodaje się tlenu, a energia musi być przenoszona pośrednio przez ścianę reaktora:
- CH4 + NH3 → HCN + 3H2
Ta reakcja jest podobna do reformingu parowego , reakcji metanu i wody, w wyniku której powstaje tlenek węgla i wodór .
W procesie Shawinigana węglowodory , np. propan , poddawane są reakcji z amoniakiem.
W laboratorium niewielkie ilości HCN powstają w wyniku dodania kwasów do soli cyjankowych metali alkalicznych :
- H + + NaCN → HCN + Na +
Ta reakcja jest czasami podstawą przypadkowych zatruć, ponieważ kwas przekształca nielotną sól cyjanku w gazowy HCN.
Historyczne metody produkcji
Duże zapotrzebowanie na cyjanki do operacji wydobywczych w latach 90. XIX wieku zostało zaspokojone przez George'a Thomasa Beilby'ego , który w 1892 r. Opatentował metodę produkcji cyjanowodoru poprzez przepuszczanie amoniaku nad żarzącym się węglem . Metoda ta była stosowana do czasu, gdy Hamilton Castner w 1894 r. opracował syntezę wychodzącą z węgla , amoniak i sód , dając cyjanek sodu , który reaguje z kwasem, tworząc gazowy HCN.
Aplikacje
HCN jest prekursorem cyjanku sodu i cyjanku potasu , które są wykorzystywane głównie w górnictwie złota i srebra oraz do galwanizacji tych metali. Za pośrednictwem cyjanohydryn z HCN wytwarza się wiele użytecznych związków organicznych, w tym monomer metakrylanu metylu , z acetonu , aminokwasu metioniny , poprzez syntezę Streckera oraz środki chelatujące EDTA i NTA . W hydrocyjanowania HCN dodaje się do butadienu , otrzymując adiponitryl , prekursor nylonu-6,6 .
HCN jest stosowany na całym świecie jako fumigant przeciwko wielu gatunkom szkodników, które atakują zakłady produkujące żywność. Zarówno skuteczność, jak i sposób aplikacji powodują, że fumigant zużywa się w bardzo małych ilościach w porównaniu z innymi substancjami toksycznymi stosowanymi w tym samym celu. Stosowanie HCN jako fumiganta ma również minimalny wpływ na środowisko w porównaniu z podobnymi strukturalnymi cząsteczkami fumigantu, takimi jak fluorek sulfurylu i bromek metylu .
Występowanie
HCN można uzyskać z owoców z pestką , takich jak wiśnie , morele , jabłka i gorzkie migdały , z których wytwarzany jest olej migdałowy i aromat. Wiele z tych pestek zawiera niewielkie ilości cyjanohydryn , takich jak mandelonitryl i amigdalina , które powoli uwalniają cyjanowodór. Sto gramów rozgniecionych nasion jabłek może dać około 70 mg HCN. Tak zwane „gorzkie” korzenie manioku roślina może zawierać do 1 grama HCN na kilogram. Niektóre krocionogi , takie jak Harpaphe haydeniana , Desmoxytes purpurosea i Apheloria uwalniają cyjanowodór jako mechanizm obronny, podobnie jak niektóre owady, takie jak ćmy biedronkowe i larwy eukaliptusa Paropsisterna . Cyjanowodór jest zawarty w spalinach pojazdów oraz w dymie ze spalania tworzyw sztucznych zawierających azot .
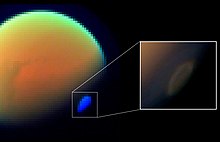
HCN na Tytanie
HCN został zmierzony w atmosferze Tytana przez cztery instrumenty sondy kosmicznej Cassini , jeden instrument na Voyagerze i jeden instrument na Ziemi. Jeden z tych pomiarów był in situ , kiedy sonda Cassini zanurzyła się między 1000 a 1100 km (620 a 680 mil) nad powierzchnią Tytana, aby zebrać gaz atmosferyczny do analizy spektrometrii mas . HCN początkowo tworzy się w atmosferze Tytana w wyniku fotochemicznej reakcji rodników metanu i azotu, które przechodzą przez półprodukt H 2 CN, np. (CH 3 + N → H 2CN + H → HCN + H 2 ). Promieniowanie ultrafioletowe rozbija HCN na CN + H; jednakże CN jest wydajnie zawracany do HCN w reakcji CN + CH4 → HCN + CH3 .
HCN na młodej Ziemi
Postulowano, że węgiel z kaskady asteroid (znanej jako późne ciężkie bombardowanie ), powstałe w wyniku interakcji Jowisza i Saturna, wysadził powierzchnię młodej Ziemi i zareagował z azotem w ziemskiej atmosferze, tworząc HCN.
HCN u ssaków
Niektórzy autorzy [ kto? ] wykazali, że neurony mogą wytwarzać cyjanowodór po aktywacji ich receptorów opioidowych przez endogenne lub egzogenne opioidy. Wykazali również, że neuronalna produkcja HCN aktywuje receptory NMDA i odgrywa rolę w przekazywaniu sygnału między komórkami nerwowymi ( neuroprzekaźnictwo ). Co więcej, zwiększona endogenna neuronalna produkcja HCN pod wpływem opioidów była najwyraźniej potrzebna do uzyskania odpowiedniej analgezji opioidowej , ponieważ przeciwbólowe działanie opioidów zostało osłabione przez zmiatacze HCN. Uznali endogenny HCN za neuromodulator .
Wykazano również, że podczas stymulacji muskarynowych receptorów cholinergicznych w hodowanych komórkach guza chromochłonnego zwiększa się wytwarzanie HCN, w żywym organizmie ( in vivo ) stymulacja cholinergiczna muskarynu faktycznie zmniejsza wytwarzanie HCN.
Leukocyty wytwarzają HCN podczas fagocytozy i mogą zabijać bakterie , grzyby i inne patogeny, wytwarzając kilka różnych toksycznych substancji chemicznych, z których jednym jest cyjanowodór.
w rozszerzaniu naczyń spowodowanym przez nitroprusydek sodu pośredniczy nie tylko wytwarzanie NO, ale także endogenne wytwarzanie cyjanku, co nie tylko zwiększa toksyczność, ale także zapewnia dodatkową skuteczność przeciwnadciśnieniową w porównaniu z nitrogliceryną i innymi azotanami niecyjanogennymi, które nie powodują poziom cyjanku we krwi wzrośnie.
HCN jest składnikiem dymu tytoniowego .
HCN i pochodzenie życia
Cyjanowodór został omówiony jako prekursor aminokwasów i kwasów nukleinowych i sugeruje się, że odegrał rolę w powstaniu życia . Chociaż związek tych reakcji chemicznych z teorią powstania życia pozostaje spekulacją, badania w tej dziedzinie doprowadziły do odkrycia nowych szlaków do związków organicznych pochodzących z kondensacji HCN (np. adeniny ).
HCN w kosmosie
HCN wykryto w ośrodku międzygwiazdowym i atmosferach gwiazd węglowych . Od tego czasu w szeroko zakrojonych badaniach zbadano ścieżki powstawania i niszczenia HCN w różnych środowiskach i zbadano jego zastosowanie jako znacznika dla różnych gatunków i procesów astronomicznych. HCN można obserwować z naziemnych teleskopów przez szereg okien atmosferycznych . Zaobserwowano czyste przejścia obrotowe J=1→0, J=3→2, J= 4→3 i J=10→9 .
HCN powstaje w obłokach międzygwiazdowych jednym z dwóch głównych szlaków: poprzez reakcję obojętno-obojętną (CH 2 + N → HCN + H) i poprzez rekombinację dysocjacyjną (HCNH + + e − → HCN + H). Szlak rekombinacji dysocjacyjnej jest dominujący o 30%; jednakże HCNH + musi mieć postać liniową. W wyniku rekombinacji dysocjacyjnej z jego izomerem strukturalnym H 2 NC + powstaje wyłącznie izocyjanek wodoru (HNC).
HCN jest niszczony w obłokach międzygwiazdowych poprzez szereg mechanizmów zależnych od lokalizacji w obłoku. W regionach zdominowanych przez fotony (PDR) dominuje fotodysocjacja, w wyniku której powstaje CN (HCN + ν → CN + H). Na dalszych głębokościach dominuje fotodysocjacja pod wpływem promieni kosmicznych, w wyniku której powstaje CN (HCN + cr → CN + H). W ciemnym jądrze niszczą go dwa konkurujące ze sobą mechanizmy, tworząc HCN + i HCNH + (HCN + H + → HCN + + H; HCN + HCO + → HCNH + + CO). Reakcja z HCO + dominuje współczynnikiem ~ 3,5. HCN był używany do analizy różnych gatunków i procesów w ośrodku międzygwiazdowym. Sugerowano, że jest znacznikiem gęstego gazu molekularnego i znacznikiem napływu gwiazd w obszarach formowania się gwiazd o dużej masie. Ponadto wykazano, że stosunek HNC / HCN jest doskonałą metodą rozróżniania PDR i regionów zdominowanych przez promieniowanie rentgenowskie (XDR).
W dniu 11 sierpnia 2014 r. astronomowie opublikowali wyniki badań, po raz pierwszy wykorzystując Atacama Large Millimeter/Submillimeter Array (ALMA) , które wyszczególniły rozkład HCN, HNC , H 2 CO i pyłu wewnątrz komet komety C/2012 F6 ( Lemmon) i C/2012 S1 (ISON) .
za pomocą Kosmicznego Teleskopu Hubble'a znaleziono ślady cyjanowodoru w atmosferze gorącej superziemi 55 Cancri e .
Jako trucizna i broń chemiczna
Podczas I wojny światowej cyjanowodór był używany przez Francuzów od 1916 r. jako broń chemiczna przeciwko państwom centralnym , aw 1918 r. przez Stany Zjednoczone i Włochy . Nie okazał się wystarczająco skuteczny ze względu na warunki pogodowe. Gaz jest lżejszy od powietrza i szybko rozprasza się w atmosferze. Szybkie rozcieńczanie sprawiło, że jego użycie w terenie było niepraktyczne. Natomiast gęstsze środki, takie jak fosgen lub chlor, zwykle pozostawały na poziomie gruntu i opadały do rowów z pól bitewnych frontu zachodniego. W porównaniu z takimi środkami, cyjanowodór musiał być obecny w wyższych stężeniach, aby był śmiertelny.
Stężenie cyjanowodoru wynoszące 100–200 ppm w powietrzu do oddychania zabija człowieka w ciągu 10 do 60 minut. Stężenie cyjanowodoru na poziomie 2000 ppm (około 2380 mg/m 3 ) zabije człowieka w ciągu około jednej minuty. Efekt toksyczny jest spowodowany działaniem jonu cyjanku, który zatrzymuje oddychanie komórkowe . Działa jako niekonkurencyjny inhibitor enzymu w mitochondriach, zwanego oksydazą cytochromu c . W związku z tym cyjanowodór jest powszechnie wymieniany wśród broni chemicznej jako czynnik krwi .
Konwencja o zakazie broni chemicznej wymienia ją w załączniku 3 jako potencjalną broń mającą zastosowania przemysłowe na dużą skalę. Kraje-sygnatariusze muszą zadeklarować zakłady produkcyjne, które produkują więcej niż 30 ton metrycznych rocznie, i zezwolić na inspekcję Organizacji ds. Zakazu Broni Chemicznej .
Być może jego najbardziej niesławnym zastosowaniem jest Cyklon B (niem. Cyclone B , gdzie B oznacza Blausäure – kwas pruski; także, aby odróżnić go od wcześniejszego produktu znanego później jako Cyklon A), używany w niemieckich nazistowskich obozach zagłady podczas II wojny światowej masowo zabijać w ramach ich ostatecznego rozwiązania program ludobójstwa. Cyjanowodór był również używany w obozach do odwszawiania odzieży w celu zwalczania chorób przenoszonych przez wszy i inne pasożyty. Jeden z oryginalnych czeskich producentów kontynuował produkcję Cyklonu B pod nazwą handlową „Uragan D2” do około 2015 roku.
Podczas II wojny światowej Stany Zjednoczone rozważały użycie go wraz z chlorkiem cyjanowym w ramach operacji Downfall , planowanej inwazji na Japonię, ale prezydent Harry Truman zdecydował, że nie, zamiast tego użył bomb atomowych opracowanych przez tajny Projekt Manhattan .
Cyjanowodór był również środkiem stosowanym w egzekucjach sądowych w niektórych stanach USA , gdzie powstawał podczas egzekucji poprzez działanie kwasu siarkowego na cyjanek sodu lub potasu .
Pod nazwą kwas pruski , HCN był używany jako środek zabijający w harpunach wielorybniczych , chociaż okazał się dość niebezpieczny dla załogi go rozmieszczającej i szybko został porzucony. Od połowy XVIII wieku był używany do wielu zatruć i samobójstw.
Gazowy cyjanowodór w powietrzu jest wybuchowy przy stężeniu powyżej 5,6%. To stężenie jest znacznie powyżej poziomu toksycznego.
Linki zewnętrzne
- Institut National de recherche et de sécurité (1997). " Cyanure d'hydrogène et Solutions aqueuses ". Fiche toxicologique n° 4 , Paryż: INRS, 5 pp. (Plik PDF, w języku francuskim )
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0492
- Cyjanowodór i cyjanki ( CICAD 61)
- National Pollutant Inventory: Arkusz informacyjny związków cyjanku
- Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych
- Departament przeglądu zdrowia
- Gęstość gazowego cyjanowodoru



