Pentafluorek azotu
| Nazwy | |
|---|---|
|
nazwa IUPAC
Pentafluorek azotu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
|
|
|
|
| Nieruchomości | |
| NF 5 | |
| Masa cząsteczkowa | 108,999 g/mol |
| Struktura | |
| Trygonalny bipiramidalny | |
| 0 D | |
| Związki pokrewne | |
|
Inne kationy
|
pięciofluorek fosforu pięciofluorek arsenu pięciofluorek antymonu pięciofluorek bizmutu |
|
Związki pokrewne
|
Trifluorek azotu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Pentafluorek azotu (NF 5 ) jest teoretycznym związkiem azotu i fluoru , którego istnienie zakłada się na podstawie istnienia pentafluorków atomów poniżej azotu w układzie okresowym, takich jak pentafluorek fosforu . Teoretyczne modele cząsteczki pięciofluorku azotu to albo trygonalna bipiramidowa kowalencyjnie związana cząsteczka z grupą symetrii D 3h , albo NF
+ 4 F − , która byłaby jonowym ciałem stałym.
Ciało stałe jonowe
wiele innych soli tetrafluoroamoniowych (NF
+ 4 X - ), podobnie jak sole fluorkowe innych kationów amonowych (NR
+ 4 F - ).
W 1966 roku WE Tolberg po raz pierwszy zsyntetyzował pięciowartościowy związek azotu i fluoru, tworząc związki tetrafluoroamoniowe, heksafluoroantymonian tetrafluoroamonu NF 4 SbF 6 i heksafluoroarsenian tetrafluoroamonu NF 4 AsF 6 . W 1971 roku CT Goetschel ogłosił przygotowanie NF 4 BF 4 , a także wyprodukował białą substancję stałą, którą uważa się za fluorek tetrafluoroamonu (NF
+ 4 F - ). Zostało to wykonane przez potraktowanie trifluorku azotu i fluoru promieniowaniem elektronowym 3 MeV w temperaturze 77 K. Rozłożyło się z powrotem na te składniki w temperaturze powyżej 143 K. Badania teoretyczne pokazują również, że związek jonowy z dużym prawdopodobieństwem ulegnie rozkładowi do trifluorku azotu i gazowego fluoru .
Karl O. Christe zsyntetyzował heksafluoronikelan bis(tetrafluoroamoniowy) (NF 4 ) 2 NiF 6 . Wykonywał również związki z solami manganu, fluorouranianu, nadchloranu, fluorosiarczanu i N 2 F
+ 3 . Christe próbował wytworzyć NF4F przez metatezę NF4SbF6 z CsF w rozpuszczalniku HF w temperaturze 20° C . Jednak wariant, wodorofluorek tetrafluoroamonu (NF 4 HF 2 · n HF), został wyprodukowany. W temperaturze pokojowej był to mleczny płyn, ale po schłodzeniu zmienił się w pastę. W temperaturze -45 ° C miał postać białej substancji stałej. Po ponownym podgrzaniu pienił się, wydzielając F 2 , HF i NF 3 jako gazy. Ma numer CAS 71485-49-9.
IJ Solomon uważał, że pentafluorek azotu powstał w wyniku termicznego rozkładu NF 4 AsF 6 , ale wyników eksperymentów nie powtórzono.
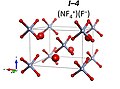
Dominik Kurzydłowski i Patryk Zaleski-Ejgierd przewidują, że mieszanina fluoru i trójfluorku azotu pod ciśnieniem od 10 do 33 GPa tworzy NF
+ 4 F − z grupą przestrzenną R3m . Jest to utlenianie pod wysokim ciśnieniem. Powyżej 33 GPa utworzy stabilny związek jonowy o wzorze (NF
+ 4 ) 2 NF
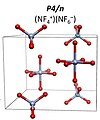
− 6 F – o grupie przestrzennej I4/m . Przewiduje się, że powyżej 151 GPa przekształci się to w NF
+ 4 NF
- 6 z grupą przestrzenną P4/n . Związek cząsteczkowy NF 5 nie jest stabilny w żadnych warunkach ciśnienia.
Cząsteczka kowalencyjna
Aby powstała cząsteczka NF 5 , pięć atomów fluoru musi być ułożonych wokół atomu azotu. Nie ma wystarczająco dużo miejsca, aby zrobić to w najbardziej zwarty sposób, więc długości wiązań muszą być dłuższe. Z obliczeń wynika, że cząsteczka NF 5 jest termodynamicznie korzystnie skłonna do tworzenia rodników NF 4 i F o energii 36 kJ/mol i barierze przejścia około 67–84 kJ/mol. Pentafluorek azotu narusza również regułę oktetu , zgodnie z którą związki z ośmioma elektronami na zewnętrznej powłoce są szczególnie stabilne.
- ^ Jäger, Susanne; von Jouanne, Jörn; Keller-Rudek, Hannelore; Koschel, Dieter; Kuhn, Piotr; Merlet, Piotr; Rupecht, Sigrid; Vanecek, Hans; Wagner, Joachim (1986). F Fluor: związki z tlenem i azotem . Gmelin Handbook of Chemii Nieorganicznej. Tom. 4. Berlin: Springer. P. 163. doi : 10.1007/978-3-662-06339-2 . ISBN 978-3-662-06341-5 . Źródło 29 sierpnia 2015 r .
-
^ ab Goetschel
, CT; VA Campanile; RM Curtisa; KR Loos; CD Wagnera; JN Wilson (lipiec 1972). „Wytwarzanie i właściwości tetrafluoroboranu perfluoroamonu, NF
+ 4 BF
− 4 oraz możliwa synteza pentafluorku azotu”. Chemia nieorganiczna . 11 (7): 1696–1701. doi : 10.1021/ic50113a051 . - ^ Christe, Karl O.; William W. Wilson (grudzień 1992). „Pięciofluorek azotu: kowalencyjny NF 5 kontra jonowy NF 4 + F - i badania niestabilności tego ostatniego”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 114 (25): 9934–9936. doi : 10.1021/ja00051a027 .
- ^ Christe, Karl O. (wrzesień 1977). „Synteza i charakterystyka bis (tetrafluoroamoniowego) heksafluoronikelanu”. Chemia nieorganiczna . 16 (9): 2238–2241. doi : 10.1021/ic50175a017 .
- ^ ab Christe , Karl O. (23 maja 1980). „Badania badawcze nad solami NF 4 + ” (PDF) . Rockwella. Zarchiwizowane (PDF) od oryginału w dniu 27 grudnia 2015 r . Źródło 23 lutego 2012 r .
- ^ Dwufluorek tetrafluoroamonu
- ^ Christe, Karl O.; Williama W. Wilsona; Gary J. Schrobilgen; Raman V. Chirakal; George A. Olah (marzec 1998). „O istnieniu pięciokoordynacyjnego azotu”. Chemia nieorganiczna . 27 (5): 789–790. doi : 10.1021/ic00278a009 .
-
^
Kurzydłowski, Dominik; Zaleski-Ejgierd, Patryk (3 listopada 2016). „Azot sześciokoordynacyjny (V) stabilizowany wysokim ciśnieniem” . Raporty naukowe . 6 : 36049. Bibcode : 2016NatSR...636049K . doi : 10.1038/srep36049 . PMC 5093683 . PMID 27808104 .

-
^
Holger F. Bettinger, Paul vR Schleyer i Henry F. Schaefer III (27 października 1998). „NF 5 - opłacalne czy nie?”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 120 (44): 11439–11448. doi : 10.1021/ja9813921 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ Lewars, Errol G. (3 listopada 2008). „Pięciofluorek azotu i związki pokrewne” . Cuda modelowania: obliczeniowe przewidywanie nowych cząsteczek . Skoczek. s. 53–67. doi : 10.1007/978-1-4020-6973-4_4 . ISBN 978-1-4020-6972-7 .