Batrachotoksyna
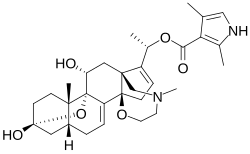
Szkieletowa formuła batrachotoksyny
|
|
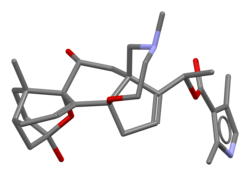
Model sztyftu batrachotoksyny oparty na strukturze krystalicznej batrachotoksyny A O - p -bromobenzoesan
|
|

Model batrachotoksyny typu kula i patyk, jw.
|
|
| Nazwy | |
|---|---|
| Inne nazwy 3α,9α-epoksy-14β,18-(2′-oksyetylo- N -metyloamino)-5β-pregna-7,16-dieno-3β,11α,20α-triol 20α-2,4-dimetylopirolo-3-karboksylan
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C31H42N2O6 _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 538,685 g · mol -1 |
| Gęstość | 1,304 g/ml |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Wysoce toksyczny |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
2 μg/kg (mysz, podskórnie) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Batrachotoksyna ( BTX ) jest niezwykle silnym kardio- i neurotoksycznym alkaloidem steroidowym występującym u niektórych gatunków chrząszczy, ptaków i żab. Nazwa pochodzi od greckiego słowa βάτραχος , bátrachos , „żaba”. Związki chemiczne o podobnej strukturze są często określane zbiorczo jako batrachotoksyny. Jest to niezwykle trujący alkaloid. U niektórych żab ten alkaloid występuje głównie na skórze. Takie żaby należą do tych używanych do zatruwania strzałek . Batrachotoksyna wiąże się i nieodwracalnie otwiera kanały sodowe komórek nerwowych i zapobiega ich zamykaniu, co powoduje paraliż i śmierć. Nie jest znane żadne antidotum.
Historia
Batrachotoksyna została odkryta przez Fritza Märki i Bernharda Witkopa w National Institute of Arthritis and Metabolic Diseases, National Institutes of Health, Bethesda, Maryland , USA . Wyizolowali cztery główne toksyczne alkaloidy steroidowe, w tym batrachotoksynę, izobatrachotoksynę, pseudobatrachotoksynę i batrachotoksynę A. Ze względu na trudność w obchodzeniu się z tak silną toksyną i niewielką ilość, którą można było zebrać, kompleksowe określenie struktury wiązało się z kilkoma trudnościami. Jednak Takashi Tokuyama, który później dołączył do badań, przekształcił jeden z pokrewnych związków, batrachotoksynę A, w krystaliczną pochodną, a jego unikalną strukturę steroidową rozwiązano za pomocą technik dyfrakcji rentgenowskiej (1968). Kiedy widmo masowe i widmo NMR batrachotoksyny i pochodnych batrachotoksyniny A, zdano sobie sprawę, że obie mają tę samą strukturę steroidową i że batrachotoksyna była batrachotoksyniną A z pojedynczym dodatkowym ugrupowaniem pirolowym przyłączony. W rzeczywistości batrachotoksynę można było częściowo zhydrolizować przy użyciu wodorotlenku sodu do materiału o identycznych reakcjach TLC i barwnych jak batrachotoksyna A. Struktura batrachotoksyny została ustalona w 1969 roku poprzez rekombinację chemiczną obu fragmentów. Batrachotoksyna A została zsyntetyzowana przez Michio Kurosu, Lawrence R. Marcin, Timothy J. Grinsteiner i Yoshito Kishi w 1998 roku.
Toksyczność
Według eksperymentów na gryzoniach , batrachotoksyna jest jednym z najsilniejszych znanych alkaloidów: jej dożylna wartość LD50 u myszy wynosi 2–3 µg/kg. LD50 Tymczasem jej pochodna, batrachotoksynina A, ma znacznie niższą toksyczność z wynoszącym 1000 µg/kg.
Toksyna uwalniana jest poprzez bezbarwne lub mleczne wydzieliny z gruczołów znajdujących się na grzbiecie i za uszami żab z rodzaju Phyllobates . Kiedy jedna z tych żab jest poruszona, czuje się zagrożona lub odczuwa ból, toksyna jest odruchowo uwalniana przez kilka kanałów.
Aktywność batrachotoksyny zależy od temperatury, z maksymalną aktywnością w temperaturze 37 ° C (99 ° F). Jego aktywność jest również szybsza w zasadowym pH, co sugeruje, że forma nieprotonowana może być bardziej aktywna.
Neurotoksyczność
Jako neurotoksyna oddziałuje na układ nerwowy . Funkcja neurologiczna polega na depolaryzacji włókien nerwowych i mięśniowych na skutek zwiększonej przepuszczalności jonów sodu przez pobudliwą błonę komórkową . Toksyny rozpuszczalne w tłuszczach , takie jak batrachotoksyna, działają bezpośrednio na sodowe kanały jonowe zaangażowane w generowanie potencjału czynnościowego i modyfikując zarówno ich selektywność jonową, jak i wrażliwość na napięcie. Batrachotoksyna nieodwracalnie wiąże się z Na + kanałów, co powoduje zmianę konformacyjną w kanałach, która zmusza kanały sodowe do pozostania otwartymi. Batrachotoksyna nie tylko utrzymuje bramkowane napięciem, ale także zmniejsza przewodnictwo jednokanałowe. Innymi słowy, toksyna wiąże się z kanałem sodowym i utrzymuje błonę przepuszczalną dla jonów sodu w sposób „wszystko albo nic”.
Ma to bezpośredni wpływ na obwodowy układ nerwowy (PNS). Batrachotoksyna w OUN powoduje zwiększoną przepuszczalność (selektywną i nieodwracalną) spoczynkowej błony komórkowej dla jonów sodu, bez zmiany potasu lub wapnia stężenie. Ten napływ sodu depolaryzuje wcześniej spolaryzowaną błonę komórkową. Batrachotoksyna zmienia również selektywność jonową kanału jonowego, zwiększając przepuszczalność kanału w kierunku większych kationów. Wrażliwe na napięcie kanały sodowe stają się trwale aktywne przy potencjale spoczynkowym błony. Batrachotoksyna zabija, trwale blokując transmisję sygnału nerwowego do mięśni.
Batrachotoksyna wiąże się i nieodwracalnie otwiera kanały sodowe komórek nerwowych i zapobiega ich zamykaniu. Neuron nie może już wysyłać sygnałów, co powoduje paraliż. Ponadto masowy napływ jonów sodu powoduje osmotyczne w nerwach i mięśniach, co powoduje zmiany strukturalne. Sugerowano, że może to również mieć wpływ na ośrodkowy układ nerwowy , chociaż obecnie nie wiadomo, jaki może to być efekt.
Kardiotoksyczność
Chociaż ogólnie klasyfikowana jako neurotoksyna , batrachotoksyna ma wyraźny wpływ na mięsień sercowy , a jej działanie odbywa się za pośrednictwem aktywacji kanału sodowego. Upośledzone przewodzenie serca prowadzi do zaburzeń rytmu , skurczów dodatkowych , migotania komór i innych zmian prowadzących do asystolii i zatrzymania akcji serca . Batrachotoksyna indukuje masowe uwalnianie acetylocholiny w nerwach i mięśniach oraz zniszczenie pęcherzyków synaptycznych . [ potrzebne źródło ] Batrachotoksyna R jest bardziej toksyczna niż pokrewna batrachotoksyna A. [ potrzebne źródło ]
Leczenie
Obecnie nie istnieje skuteczne antidotum do leczenia zatrucia batrachotoksyną. Weratrydyna , akonityna i grejanotoksyna — podobnie jak batrachotoksyna — są rozpuszczalnymi w tłuszczach truciznami, które podobnie zmieniają selektywność jonową kanałów sodowych, co sugeruje wspólne miejsce działania. Ze względu na te podobieństwa leczenie zatrucia batrachotoksyną może być najlepiej wzorowane na leczeniu jednej z tych trucizn lub na nim oparte. Leczenie może być również wzorowane na leczeniu naparstnicy , która wywołuje nieco podobne efekty kardiotoksyczne.
Chociaż nie jest to antidotum, depolaryzacji błony można zapobiec lub ją odwrócić za pomocą tetrodotoksyny (z ryb rozdymkowatych ), która jest niekonkurencyjnym inhibitorem , lub saksytoksyny („ czerwony przypływ ”). [ potrzebne źródło ] Oba mają działanie antagonistyczne do działania batrachotoksyny na przepływ sodu. Niektóre środki znieczulające mogą działać jako antagoniści receptorów dla działania tej trucizny alkaloidowej, podczas gdy inne środki znieczulające miejscowo całkowicie zablokować jego działanie, działając jako konkurencyjni antagoniści.
Źródła
Batrachotoksynę stwierdzono u czterech gatunków chrząszczy papuaskich, wszystkich z rodzaju Choresine z rodziny Melyridae ; C. pulchra , C. semiopaca , C. rugiceps i C. sp. A.
Kilka gatunków ptaków endemicznych dla Nowej Gwinei ma toksynę na skórze i na piórach: ifryt niebieskogłowy ( Ifrita kowaldi ), drozd mały (znany również jako drozd szorstki, Colluricincla megarhyncha ) oraz następujące gatunki pitohui : pitohui ( Pitohui dichrous , najbardziej toksyczny z ptaków), czubaty pitohui ( Ornorectes cristatus ), czarny pitohui ( Melanorectes nigrescens ), rdzawy pitohui ( Pseudorectes ferrugineus ) i zmienny pitohui , który jest obecnie podzielony na trzy gatunki: północny zmienny pitohui ( Pitohui kirhocephalus ), Raja Ampat pitohui ( P. cerviniventris ) i południowy zmienny pitohui ( P. uropygialis ).
Chociaż cel toksyczności u tych ptaków nie jest pewny, obecność batrachotoksyn u tych gatunków jest przykładem zbieżnej ewolucji . Uważa się, że ptaki te pozyskują toksynę z owadów zawierających batrachotoksynę, które zjadają, a następnie wydzielają ją przez skórę.
Batrachotoksyna została również znaleziona we wszystkich opisanych gatunkach z rodzaju Phyllobates z rodzaju Phyllobates od Nikaragui po Kolumbię , w tym u żaby złocistej ( Phyllobates terribilis ), czarnonogiej żaby trującej ( P. bicolor ), uroczej żaby trującej ( P. lugubris ) , golfodulcean trująca żaba ( P. vittatus ) i kokoe trująca żaba ( P. aurotaenia ). Trująca żaba Kokoe obejmowała kiedyś P. sp. aff. aurotaenia , obecnie uznawana za odrębną. Wszystkie sześć z tych gatunków żab należy do żab zatrutych .
Żaby same nie wytwarzają batrachotoksyny. Uważa się, że podobnie jak u ptaków, żaby te pozyskują toksynę z owadów zawierających batrachotoksynę, które zjadają, a następnie wydzielają ją przez skórę. Chrząszcze z rodzaju Choresine nie występują w Kolumbii, ale uważa się, że żaby mogą otrzymywać toksynę od chrząszczy z innych rodzajów z tej samej rodziny ( Melyridae ), z których kilka występuje w Kolumbii.
Żaby hodowane w niewoli nie wytwarzają batrachotoksyny, dlatego można się z nimi obchodzić bez ryzyka. Ogranicza to jednak ilość batrachotoksyny dostępnej do badań, ponieważ 10 000 żab dało tylko 180 mg batrachotoksyny. Ponieważ te żaby są zagrożone, ich zbiory są nieetyczne . Badania biosyntetyczne są również kwestionowane przez powolne tempo syntezy batrachotoksyny.
Rodzimym siedliskiem żab jadowitych są ciepłe regiony Ameryki Środkowej i Południowej , w których wilgotność wynosi około 80 procent.
Używać
Najczęstszym zastosowaniem tej toksyny jest Noanamá Chocó i Emberá Chocó z Embera -Wounaan w zachodniej Kolumbii do zatruwania strzałek do dmuchawek używanych podczas polowań.
Trujące strzałki są przygotowywane przez Chocó poprzez nabicie żaby na kawałek drewna. Według niektórych relacji żaba jest następnie przetrzymywana lub pieczona żywcem nad ogniem, aż zacznie płakać z bólu. Bąbelki trucizny tworzą się, gdy na skórze żaby pojawiają się pęcherze. Końcówki do rzutek są przygotowywane przez dotknięcie nimi toksyny lub toksyna może zostać złapana w pojemniku i pozostawiona do fermentacji. Zatrute strzałki wykonane ze świeżej lub sfermentowanej batrachotoksyny wystarczą, by upuścić małpy i ptaki. Porażenie nerwów jest niemal natychmiastowe. Inne relacje mówią, że kij siurukida („bambusowy ząb”) jest wkładany przez pysk żaby i wydalany przez jedną z jej tylnych nóg. Powoduje to, że żaba poci się na grzbiecie, który pokrywa się białą pianą. Strzałki są zanurzane lub toczone w pianie, dzięki czemu zachowują swoją śmiertelną moc nawet przez rok.
Zobacz też
- Tetrodotoksyna , toksyna, która działa w odwrotny sposób niż batrachotoksyna
Cytaty
Literatura ogólna i cytowana
- Daly, JW; Witkop, B. (1971). „Chemia i farmakologia jadów żab” . W Bücherl, W.; Buckley, EE; Deulofeu, V. (red.). Jadowite zwierzęta i ich jady . Tom. 2. Nowy Jork: Academic Press. LCCN 66014892 . OCLC 299757 .