Histrionikotoksyny
Histrionikotoksyny to grupa pokrewnych toksyn znajdujących się w skórze trujących żab z rodziny Dendrobatidae , w szczególności Oophaga histrionica (dawniej Dendrobates histrionicus ), które pochodzą z Kolumbii. Jest prawdopodobne, że podobnie jak w przypadku innych alkaloidów jadowitych żab, histrionikotoksyny nie są wytwarzane przez płazy, ale są wchłaniane z pokarmu owadów i magazynowane w gruczołach ich skóry. Są znacznie mniej toksyczne niż inne alkaloidy występujące w trujących żabach, ale ich odrębna struktura działa jak neurotoksyna poprzez niekonkurencyjne hamowanie nikotynowych receptorów acetylocholiny .
Historia
Pierwsza wzmianka o histrionikotoksynach pochodzi z 1823 roku od kapitana Charlesa Stuarta Cochrane'a. Cochrane badał tropikalne lasy deszczowe wokół Kolumbii i Panamy. Jego raporty wspominają o plemionach Indian, które używały strzał z zatrutymi grotami i dmuchawek do polowań i wojny. Po dalszych badaniach Cochrane odkrył, że ci Indianie wydobyli truciznę ze skór żaby zatrutej strzałki, znanej wówczas jako Dendrobates histrionicus . Relacja z jego pamiętnika brzmi:
„[…] zwany przez Hiszpanów rana de veneno , około trzech cali długości, żółty na grzbiecie, z bardzo dużymi czarnymi oczami… ci, którzy używają trucizny, łapią żaby w lesie i zamykają je w wydrążonej lasce, gdzie regularnie karmią je, aż zechcą trucizny, kiedy biorą nieszczęsnego gada i wsuwają mu do gardła ostry kawałek drewna z jednej nogi.Ta tortura powoduje, że biedna żaba bardzo się poci, zwłaszcza na grzbiecie, co pokrywa się białą pianą, jest to najpotężniejsza trucizna, jaką wydaje, w której zanurzają lub toczą czubki swoich strzał, co zachowuje ich niszczycielską moc przez rok. Następnie pod tą białą substancją pojawia się żółta olej, który jest starannie zeskrobywany i zachowuje swój śmiercionośny wpływ przez cztery do sześciu miesięcy, zgodnie z dobrocią (jak mówią) żaby. W ten sposób z jednej żaby uzyskuje się wystarczającą ilość trucizny na około pięćdziesiąt strzał.
Właściwości chemiczne
Histrionikotoksyny są raczej klasą niż konkretną trucizną, a to szerokie spektrum stwarza syntetyczne wyzwania. Struktury histrionikotoksyn zostały scharakteryzowane w 1971 roku. Od tego czasu przeprowadzono kilka badań syntetycznych i syntez całkowitych. Tabela 1 opisuje niektóre z wielu odmian alkaloidów histrionikotoksyny z cząsteczki macierzystej (283A).
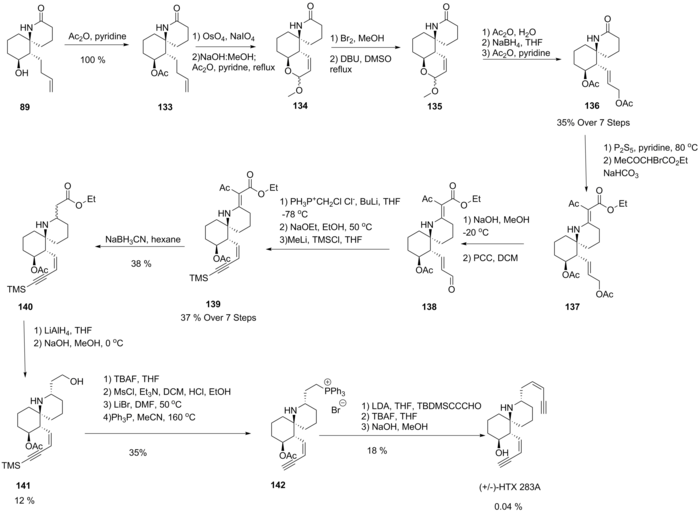
Synteza
Od czasu scharakteryzowania rozwój szlaków syntetycznych do histrionikotoksyny był przedmiotem zainteresowania grup badawczych ze względu na jej niezwykłą funkcjonalność. Grupa Kishi zaproponowała pierwszą całkowitą syntezę macierzystego 283A w 1985 r., Używając 89, wcześniej zsyntetyzowanego laktamu używanego do syntezy innych wariantów. Traktowanie bezwodnikiem octowym dało 133 z wydajnością ilościową. Cykliczny eter enolowy 134 powstał w wyniku rozszczepienia oksydacyjnego sprzyjającego dodaniu wewnątrzcząsteczkowemu, po którym nastąpiło zasadowe odbezpieczenie i odwodnienie. Stwierdzono, że bromowanie, a następnie odwodorobromowanie w metanolu dało epimeryczną mieszaninę nienasyconego 135. Hydroliza, redukcja i acetylacja dały 136. Tworzenie tiolaktamu, a następnie kondensacja z bromooctanem etylu dała 137. Selektywne odbezpieczenie alkoholu allilowego, a następnie utlenianie dało 138 Następnie reakcja Wittiga wygenerowała chloroalken, który po eliminacji HCl promowanej zasadą dał końcowy alkin, który następnie zabezpieczono, tworząc 139. Funkcja olefinowa 139 została najpierw zredukowana przy użyciu cyjanoborowodorku przed dalszą redukcją 140 do epimerycznego mieszanina alkoholi. Następnie przeprowadzono addycję retro-Michael w warunkach zasadowych w niskiej temperaturze, z powodzeniem epimeryzując ten związek, otrzymując żądany epimer 141. Reakcja z trifenylofosfiną następnie wygenerowała sól fosfoniową 142, a następnie można było przeprowadzić reakcję Wittiga w celu przyłączenia silil- zabezpieczoną funkcję cis-en-yn, którą następnie odbezpieczono, otrzymując docelowy (±)-HTX 283A.
Mechanizm akcji
HTX działa jako niekonkurencyjny antagonista nikotynowych receptorów acetylocholiny, które biorą udział w sygnalizacji neuronalnej. Jako niekonkurencyjny antagonista, HTX wiąże się z podjednostką nikotynowego receptora acetylocholiny. 3 To faktycznie zwiększa powinowactwo do agonisty acetylocholiny i stabilizuje odczulony receptor. To blokuje potencjały czynnościowe i spowalnia funkcje nerwowe. Wykazano, że histrionikotoksyna wiąże się kompetycyjnie z wieloma miejscowymi środkami znieczulającymi, takimi jak tetrakaina, a także z innymi niekonkurencyjnymi antagonistami receptorów z amin aromatycznych, co wskazuje, że związki prawdopodobnie mają wspólne miejsce wiązania; to miejsce interakcji znajduje się poza domeną transbłonową nikotynowego receptora acetylocholiny, chociaż dokładna interakcja pozostaje niescharakteryzowana. Chociaż histrionikotoksyna ma wspólne miejsce wiązania z innymi niekonkurencyjnymi antagonistami nikotynowego receptora acetylocholiny, udowodniono, że ma stosunkowo większe powinowactwo do odczulonych receptorów niż fencyklidyna, co wskazuje na dalszą, ale niescharakteryzowaną subtelność natury jej wiązania. Dodatkowo przeprowadzono badania wpływu histrionikotoksyny na potencjału płytki końcowej wykazały, że związek utrudnia propagację potencjału błony, ale ma charakterystyczne cechy hiperpolaryzacji błony. Wiązanie histrionikotoksyny jest szybko odwracalne, więc można ją łatwo usunąć z dotkniętych obszarów poprzez wielokrotne przemywanie lub in vivo poprzez naturalną dyfuzję ciała. Wykazano, że wysokie stężenia HTX mają antagonistyczne działanie na batrachotoksynę.
Toksyczność
Histrionikotoksyna jest stosunkowo nie tak toksyczna jak inne alkaloidy z zatrutych żab. Wstępne testy wykazały, że myszy mogą przeżyć dawkę 5 mg/kg histrionikotoksyny 283a i wyzdrowieć w ciągu 3 godzin bez trwałych skutków.
Zobacz też
Linki zewnętrzne
- Trucizna żaby - histrionikotoksyna w układzie okresowym filmów (University of Nottingham)