toksyna AB5 _
| Identyfikatory | |
|---|---|
| enterotoksyny (podjednostka fałdu B OB). | |
| Symbol | Enterotoksyna |
| InterPro | IPR008992 |
| SCOP2 | 2bos / ZAKRES / SUPFAM |
AB 5 to sześcioskładnikowe kompleksy białkowe wydzielane przez niektóre bakterie chorobotwórcze , o których wiadomo, że powodują choroby u ludzi, takie jak cholera , czerwonka i zespół hemolityczno-mocznicowy . Jeden składnik jest znany jako podjednostka A, a pozostałe pięć składników to podjednostki B. Wszystkie te toksyny mają podobną strukturę i mechanizm wchodzenia do docelowych komórek gospodarza. Podjednostka B jest odpowiedzialna za wiązanie z receptorami aby otworzyć drogę dla podjednostki A, aby dostać się do komórki. Podjednostka A jest wtedy w stanie wykorzystać swoją katalityczną do przejęcia regularnych funkcji komórki gospodarza.
Rodziny


Istnieją cztery główne rodziny toksyny AB5. Rodziny te charakteryzują się sekwencją ich podjednostki A (katalitycznej), jak również aktywnością katalityczną.
Toksyna cholery
Ta rodzina jest również znana jako Ct lub Ctx i obejmuje również termolabilną enterotoksynę , znaną jako LT. Wielu przypisuje odkrycie toksyny cholery dr Sambhu Nath De . Prowadził swoje badania w Kalkucie (obecnie Kalkuta ), dokonując swojego odkrycia w 1959 r., chociaż po raz pierwszy został oczyszczony przez Roberta Kocha w 1883 r. Toksyna cholery składa się z kompleksu białkowego, który jest wydzielany przez bakterię Vibrio cholerae . Niektóre objawy tej toksyny obejmują przewlekłą i rozpowszechnioną wodnistą biegunkę i odwodnienie, które w niektórych przypadkach prowadzi do śmierci.
Toksyna krztuścowa
Ta rodzina jest również znana jako Ptx i zawiera toksynę odpowiedzialną za krztusiec . Toksyna krztuścowa jest wydzielana przez Gram-ujemną bakterię Bordetella pertussis . Krztusiec jest bardzo zaraźliwy, a liczba zachorowań w Stanach Zjednoczonych powoli wzrasta pomimo szczepień. Objawy obejmują napadowy kaszel z krztuścem, a nawet wymiotami. Bakteria Bordetella pertussis została po raz pierwszy zidentyfikowana jako przyczyna krztuśca i wyizolowana przez Julesa Bordeta i Octave Gengou we Francji w 1900 roku. Mechanizm działania toksyny jest podobny do toksyny cholery.
Toksyna ArtAB z Salmonella enterica ma składniki podobne do tych występujących w dwóch różnych rodzinach: podjednostka ArtA () jest homologiczna z toksyną A krztuśca, podczas gdy podjednostka ArtB () jest homologiczna z podjednostką B, jak również z białkami występującymi w innych szczepach Salmonelli . Zgodnie z regułą kategoryzowania według A jest to toksyna z rodziny Ptx.
Toksyna Shiga
Toksyna Shiga, znana również jako Stx, jest toksyną wytwarzaną przez pałeczki Shigella dysenteriae i Escherichia coli (STEC). Żywność i napoje zanieczyszczone tymi bakteriami są źródłem infekcji i sposobu rozprzestrzeniania się tej toksyny. Objawy obejmują ból brzucha oraz wodnistą biegunkę. Ciężkie, zagrażające życiu przypadki charakteryzują się krwotocznym zapaleniem jelita grubego (HC). Odkrycie toksyny shiga przypisuje się dr Kiyoshi Shiga w 1898 roku.
Cytotoksyna subtilazy
Ta rodzina jest również znana jako SubAB i została odkryta w latach 90. Jest wytwarzany przez szczepy STEC, które nie mają miejsca zaniku enterocytów (LEE) i wiadomo, że powoduje zespół hemolityczno-mocznicowy (HUS). Nazywa się to cytotoksyną subtilazy, ponieważ jej sekwencja podjednostki A jest podobna do sekwencji proteazy serynowej podobnej do subtilazy w Bacillus anthracis . Niektóre objawy spowodowane przez tę toksynę to zmniejszenie płytek krwi lub małopłytkowość , zwiększenie liczby białych krwinek lub leukocytoza i uszkodzenie komórek nerek .
Podjednostka cytotoksyny A subtilazy (subA, ) jest proteazą, o której wiadomo, że rozszczepia wiążące białko immunoglobuliny (BiP), co prowadzi do stresu retikulum endoplazmatycznego i śmierci komórki. Podjednostki B (subB, ) wiążą się z kwasu N-glikoliloneuraminowego (Neu5Gc) na komórkach z wysokim powinowactwem. Wystarczy subB, aby spowodować wakuolizację komórek vero. Neu5GC nie jest wytwarzany przez ludzi, ale jest pozyskiwany ze źródeł żywności, takich jak czerwone mięso i produkty mleczne, które są również częstymi źródłami infekcji STEC, do wyściółki ludzkiego jelita.
Struktura
Kompletny kompleks toksyn AB5 zawiera sześć jednostek białkowych. Pięć jednostek ma podobną lub identyczną budowę i obejmuje podjednostkę B. Ostatnia jednostka białka jest unikalna i jest znana jako podjednostka A.
podjednostka
Podjednostka A toksyny AB5 jest częścią odpowiedzialną za katalizę określonych celów. W przypadku rodziny toksyn Shiga podjednostka A zawiera trypsynę , który po rozcięciu wydziela dwie podzielone domeny. Region ten nie został jeszcze potwierdzony dla innych rodzin toksyn AB5. Ogólnie rzecz biorąc, dwie domeny podjednostki A, nazwane A1 i A2, są połączone wiązaniem dwusiarczkowym . Domena A1 (około 22 kDa w toksynie cholery lub termolabilnych enterotoksynach) jest częścią toksyny odpowiedzialną za jej działanie toksyczne. Domena A2 (około 5 kDa w toksynie cholery lub termolabilnej enterotoksynie) zapewnia niekowalencyjne połączenie z podjednostką B przez centralny por podjednostki B. Łańcuch A1 toksyny cholery katalizuje przeniesienie ADP-rybozy z dinukleotydu nikotynoamidoadeninowego (NAD) do argininy lub innych związków guanidynowych poprzez wykorzystanie czynników rybozylacji ADP (ARF). Pod nieobecność argininy lub prostych związków guanidynowych, nukleozydazy NAD+ (NADaza) za pośrednictwem toksyny zachodzi przy użyciu wody jako nukleofila .
podjednostka B
Podjednostki B tworzą pięcioczłonowy lub pentameryczny pierścień, w którym jeden koniec podjednostki A wchodzi i jest utrzymywany. Ten pierścień podjednostki B jest również zdolny do wiązania się z receptorem , zwykle glikoproteina lub glikolipid, na powierzchni komórki gospodarza. Bez podjednostek B podjednostka A nie ma możliwości przyczepienia się do komórki ani wejścia do komórki, a zatem nie ma możliwości wywierania działania toksycznego. Toksyna cholery, toksyna shiga i toksyna SubAB mają podjednostki B, które składają się z pięciu identycznych składników białkowych, co oznacza, że ich podjednostki B są homopentamerami. Toksyna krztuśca jest inna, gdy jej pierścień pentameryczny składa się z czterech różnych składników białkowych, przy czym jeden ze składników jest powtarzany, tworząc heteropentamer.
Mechanizmy
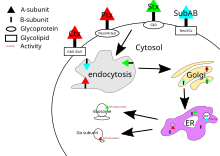
Toksyna cholery, toksyna krztuśca i toksyna shiga mają swoje cele w cytozolu komórki . Po tym, jak ich podjednostka B zwiąże się z receptorami na powierzchni komórki, toksyna jest otaczana przez komórkę i transportowana do wewnątrz przez endocytozę zależną od klatryny lub endocytozę niezależną od klatryny .
Dla toksyny cholery głównym receptorem glikolipidowym dla toksyny cholery jest gangliozyd GM1 . Po endocytozie do aparatu Golgiego toksyna jest kierowana do retikulum endoplazmatycznego . Aby podjednostka A dotarła do celu, wiązanie dwusiarczkowe między domenami A1 i A2 musi zostać zerwane. To pęknięcie jest katalizowane przez białkową izomerazę dwusiarczkową , która znajduje się w retikulum endoplazmatycznym. Po rozdzieleniu domena A1 rozwija się i jest przekierowywana z powrotem do cytozolu, gdzie ponownie się fałduje i katalizuje rybozylację ADP niektórych podjednostek alfa białka G. W ten sposób dalsze efekty szlaku transdukcji sygnału białka G są zakłócane przez aktywację cyklazy adenylanowej . Powoduje to wyższe stężenie cAMP w komórce, co zaburza regulację mechanizmów transportu jonów.
Toksyna krztuśca nie ma swoistego receptora i wiąże się z sialilowanymi glikoproteinami . Po endocytozie mechanizm toksyny krztuśca jest taki sam jak toksyny cholery.
Głównym receptorem dla toksyny shiga jest globotriaozyloceramid lub Gb3. Toksyna Shiga jest również wprowadzana do aparatu Golgiego, zanim zostanie skierowana do retikulum endoplazmatycznego w celu rozszczepienia wiązania dwusiarczkowego przez PDI. Podjednostka A toksyny Shiga jest następnie wprowadzana z powrotem do cytozolu i hamuje syntezę białek eukariotycznych dzięki swojej N-glikozydazy RNA poprzez rozszczepianie określonej zasady adeninowej na rybosomalnym RNA 28S , co ostatecznie powoduje śmierć komórki.
Cel SubAB znajduje się w retikulum endoplazmatycznym komórki i jest wprowadzany do komórki przez endocytozę, w której pośredniczy klatryna . Receptor glikanu dla SubAB zwykle kończy się kwasem N-glikoliloneuraminowym połączonym wiązaniem α2-3 (Neu5Gc). SubAB ma podjednostkę A, gdzie działa jako proteaza serynowa i rozszczepia Bip/GRP78 , białko opiekuńcze retikulum endoplazmatycznego . Rozszczepienie tego białka opiekuńczego powoduje stres komórkowy poprzez hamowanie białka, aw konsekwencji śmierć komórki.
Zastosowania medyczne
Lek na raka
Podjednostki B toksyn AB5 mają powinowactwo do wiązania glikanu , które wydają się posiadać niektóre rodzaje nowotworów, co czyni je łatwym celem. Jednym z przykładów jest StxB , który specyficznie wiąże się z CD77 (Gb3), który wykazuje ekspresję na powierzchni komórek nowotworowych, takich jak okrężnica, trzustka, sutek i wiele innych. Gdy StxB zaatakuje komórkę rakową, dostarcza podjednostkę A toksyny, która ostatecznie zabija komórkę rakową.
Jeszcze inną metodą jest użycie leków wywołujących stres ER, które zostały przetestowane na myszach w celu wykazania pozytywnych odpowiedzi synergistycznych. Osiąga się to poprzez fuzję naskórkowego czynnika wzrostu (EGF) z podjednostką A SubAB. Komórki rakowe, które wyrażają receptory dla EGF, doświadczą następnie toksyczności SubAB.
Szczepionki
Innym zastosowaniem toksyn AB5 jest użycie członków rodziny LT jako adiuwantów . To pozwala toksynie promować odpowiedzi immunologiczne, takie jak IgG2a, IgA i Th17 , aby zwalczać na przykład infekcję żołądka Helicobacter pylori , gdy podawana jest szczepionka .
Oprócz tego, że niektóre z tych toksyn AB5 są wykorzystywane do tworzenia szczepionek zapobiegających infekcjom bakteryjnym, są one również badane pod kątem działania jako koniugat w celu zapobiegania infekcjom wirusowym. Na przykład immunizacja ogólnoustrojowa wraz z podawaniem donosowym szczepionki skoniugowanej z wirusem i toksyną cholery wywołała odpowiedź przeciwciał swoistą dla wirusa i wykazała pewien stopień ochrony górnych dróg oddechowych przed wirusem Sendai .
Najnowsze obszary badań
Nowe postępy w biotechnologicznych metodach eksperymentalnych, takie jak wykorzystanie mikroskopii z oświetleniem płaszczyzny wiązki Bessela i cząsteczek czujnikowych opartych na FRET , mogą lepiej demonstrować dynamiczne struktury blaszek połączeniowych . W tych doświadczeniach można zastosować różne typy toksyn AB5 do wywołania szybkiego tworzenia tCDR w komórkach E.Coli. Odpowiedź można następnie zarejestrować za pomocą cAMP fluktuacje stężenia w komórkach sprzężonych ze złączem szczelinowym przy użyciu konstruktów czujników opartych na FRET. Badania sugerują, że CDR mogą być prawdopodobnie powiązane z szybką rearanżacją lipidów i białek w koneksynowych w blaszkach połączeń szczelinowych. Może to dodatkowo pomóc nam zrozumieć kaskadę sygnalizacyjną, która następuje po komórkowej utracie K + po wystawieniu na infekcję bakteryjną.
Zaobserwowano, że toksyna SubAB wykazuje specyficzność względem białka wiążącego, BiP . Ta cecha została wykorzystana do zbadania roli samego komórkowego BiP, wraz z degradacją związaną z retikulum endoplazmatycznym w zestresowanych HeLa .
Zobacz też
Linki zewnętrzne
- Bakteryjne toksyny AB5
- Held, Paweł. „Wprowadzenie do technologii transferu energii rezonansu fluorescencji (FRET) i jej zastosowania w biologii” . BioTek Instruments, Inc.