Toksyna wąglika
| Środkowa domena śmiertelnego czynnika toksyny wąglika | |||||||||
|---|---|---|---|---|---|---|---|---|---|
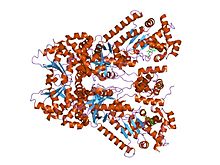 Rentgenowska struktura krystaliczna śmiertelnego czynnika wąglika związanego z drobnocząsteczkowym inhibitorem, bi-mfm3, 3-{5-[5-(4-chloro-fenylo)-furan-2-ylometylen]- Kwas 4-okso-2-tiokso-tiazolidyn-3-ylo}-propionowy.
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Anthrax-tox_M | ||||||||
| Pfam | PF09156 | ||||||||
| InterPro | IPR015239 | ||||||||
| SCOP2 | 1j7n / ZAKRES / SUPFAM | ||||||||
| Nadrodzina OPM | 35 | ||||||||
| |||||||||
| Domeny końcowe N i C śmiertelnego czynnika toksyny wąglika | |||||||||
|---|---|---|---|---|---|---|---|---|---|
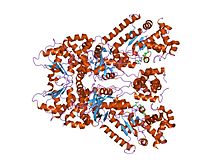 Struktura krystaliczna śmiertelnego czynnika wąglika skompleksowanego z tioacetylo-tyr-pro-met-amidem, chelatującym metal inhibitorem małocząsteczkowym peptydylu
| |||||||||
| Identyfikatory | |||||||||
| Symbol | ATLF | ||||||||
| Pfam | PF07737 | ||||||||
| InterPro | IPR014781 | ||||||||
| MEROPY | M34 | ||||||||
| SCOP2 | 1pwq / ZAKRES / SUPFAM | ||||||||
| |||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| podjednostek LF toksyny wąglika | |||||||||
| Symbol | Anthrax_toxA | ||||||||
| Pfam | PF03497 | ||||||||
| SCOP2 | 1jky / SCOPe / SUPFAM | ||||||||
| |||||||||

Toksyna wąglika to trójbiałkowa egzotoksyna wydzielana przez zjadliwe szczepy bakterii Bacillus anthracis — czynnik sprawczy wąglika . Toksyna została po raz pierwszy odkryta przez Harry'ego Smitha w 1954 r. Toksyna wąglika składa się z białka wiążącego komórki, znanego jako antygen ochronny (PA), oraz dwóch składników enzymatycznych, zwanych czynnikiem obrzękowym (EF) i czynnikiem letalnym (LF). Te trzy składniki białkowe działają razem, nadając im efekty fizjologiczne. Złożone kompleksy zawierające składniki toksyny poddawane są endocytozie . W endosomie enzymatyczne składniki toksyny przemieszczają się do cytoplazmy komórki docelowej. Gdy znajdą się w cytozolu, enzymatyczne składniki toksyny zakłócają różne funkcje komórek odpornościowych, a mianowicie sygnalizację komórkową i migrację komórek. Toksyna może nawet indukować lizę komórek, co obserwuje się w przypadku makrofagów . Toksyna wąglika pozwala bakteriom uniknąć układu odpornościowego , namnażać się i ostatecznie zabić żywiciela. Badania nad toksyną wąglika zapewniają również wgląd w generowanie zespołów makrocząsteczkowych oraz translokację białek , tworzenie porów, endocytozę i inne procesy biochemiczne .
Czynniki wirulencji Bacillus anthracis
Wąglik jest chorobą wywoływaną przez Bacillus anthracis , tworzącą przetrwalniki Gram -dodatnią bakterię o kształcie pałeczki (ryc. 1). Śmiertelność choroby jest spowodowana dwoma głównymi czynnikami wirulencji bakterii: (i) kwasu poliglutaminowego , która jest antyfagocytarna , oraz (ii) trójdzielną toksyną białkową, zwaną toksyną wąglika. Toksyna wąglika jest mieszaniną trzech białkowych : (i) antygenu ochronnego (PA), (ii) czynnika obrzęku (EF) oraz (iii) czynnika letalnego (LF).
Mechanizm akcji
Toksyna wąglika jest toksyną AB . Każde pojedyncze białko toksyny wąglika jest nietoksyczne. Objawy toksyczne nie są obserwowane, gdy białka te są wstrzykiwane pojedynczo zwierzętom laboratoryjnym. Jednoczesne wstrzyknięcie PA i EF powoduje obrzęk , a jednoczesne wstrzyknięcie PA i LF jest śmiertelne. Pierwsza kombinacja nazywana jest toksyną obrzękową, a druga to śmiertelna toksyna. Tak więc manifestacja objawów fizjologicznych wymaga PA w każdym przypadku.
Wymóg PA obserwowany w eksperymentach na modelach zwierzęcych pokazuje wspólny paradygmat dla toksyn bakteryjnych, zwany paradygmatem A / B . Składnik A jest aktywny enzymatycznie, a składnik B jest składnikiem wiążącym komórki. Toksyna wąglika ma postać A2B składnikami , , gdzie dwa enzymy , EF i LF, są A a PA jest składnikiem B. Zatem PA działa jak koń trojański , który przenosi EF i LF przez błonę plazmatyczną do cytozolu, gdzie mogą następnie katalizować reakcje, które zakłócają normalną fizjologię komórkową. [ potrzebne źródło ]
Składanie i translokacja toksyny wąglika
Składniki białkowe toksyny wąglika muszą łączyć się w kompleksy holotoksyn, aby funkcjonować. Aby LF i EF mogły funkcjonować wewnątrz komórki docelowej, muszą zlokalizować się w komórce i wejść do jej cytoplazmy. Poprzez szereg kroków PA może translokować EF i LF do komórki (ryc. 2). Proces ten rozpoczyna się, gdy forma PA o masie 83 kDa, zwana PA83, wiąże się z receptorem toksyny wąglika. Istnieją dwa znane homologiczne receptory, które wiążą się z PA83, zwane markerem śródbłonka nowotworu-8 ( TEM8 ) i białkiem morfogenezy naczyń włosowatych 2 ( CMG2 ). Następnie fragment 20 kDa (PA20) jest odcinany od końca aminowego PA83 przez endoproteazy błonowe z rodziny furin. Kiedy PA20 ulega dysocjacji, pozostała część PA związana z receptorem, zwana PA63, może złożyć się w heptameryczny lub oktameryczny oligomer w kształcie pierścienia . Ten oligomer w kształcie pierścienia jest często określany jako forma przedporowa (lub przedkanałowa) PA, ponieważ później na ścieżce stanie się porem (lub kanałem) translokazy. Powierzchnia oligomeru z przedporami, która została odsłonięta po uwolnieniu ugrupowania PA20, może następnie wiązać się z LF i EF. Formy heptameryczne i oktameryczne oligomeru PA mogą następnie wiązać się odpowiednio z maksymalnie trzema lub czterema cząsteczkami EF i/lub LF. Komórka następnie endocytozuje te złożone kompleksy i przenosi je do kwaśnego przedziału w komórce. Niskie pH występujące w endosomie powoduje, że kanał wstępny PA63 przekształca się w kanał kationoselektywny. EF i LF są przepuszczane przez kanał przez gradient pH, umożliwiając czynnikom enzymatycznym wejście do cytozolu .
Funkcja enzymatyczna LF i EF
Gdy znajdą się w cytosolu, EF i LF przeprowadzają następnie odpowiednie procesy powodujące uszkodzenia.
- EF działa jako cyklaza adenylanowa zależna od Ca 2+ i kalmoduliny , która znacznie zwiększa poziom cAMP w komórce. Ten wzrost cAMP zaburza homeostazę wody , poważnie zaburza równowagę wewnątrzkomórkowych szlaków sygnałowych i upośledza funkcję makrofagów, umożliwiając bakteriom dalsze unikanie układu odpornościowego.
- LF pomaga również bakteriom uniknąć układu odpornościowego poprzez zabijanie makrofagów. W tych komórkach LF działa jako endoproteaza zależna od Zn2 + , która odcina N-koniec kinaz białkowych aktywowanych mitogenem (MAPKK ) . To hamuje te kinazy, nie pozwalając im skutecznie wiązać się z ich substratami, co prowadzi do zmienionych szlaków sygnałowych i ostatecznie do apoptozy .
Tak więc synergistyczny efekt tych trzech białek prowadzi do śmierci komórkowej poprzez kaskadę zdarzeń, które umożliwiają białkom wejście do komórki i zakłócenie funkcji komórkowych.
Zależność struktura-funkcja toksyny zewnątrzkomórkowej
Mechanizm działania toksyny wąglika jest wynikiem struktury molekularnej trzech białek toksyn w połączeniu z biomolekułami komórki gospodarza. Interakcje molekularne są widoczne po przeprowadzeniu szczegółowej analizy struktur PA, EF, LF i receptorów komórkowych ( ANTXR1 i ANTXR2 ). Struktury cząsteczek toksyny (ryc. 3–5), receptora i kompleksów cząsteczek dostarczyły wglądu w synergiczne działania tych białek. Analizy miejsc wiązania i zmian konformacyjnych wzmocniły badania strukturalne, wyjaśniając funkcje każdej domeny PA, LF i EF, jak krótko przedstawiono w tabeli 1.
Strukturę PA określono jako pierwszą (ryc. 3). Ta struktura i struktura jej receptora komórkowego rzucają wiele światła na specyficzność rozpoznawania i wiązania. Ta specyficzność PA i receptora CMG2 (podobna do interginów typu I) wynika z interakcji poprzez miejsce adhezji zależne od jonów metali (MIDAS), rowek hydrofobowy i projekcję spinki do włosów β. Wszystko to przyczynia się do ścisłej interakcji, w której zakopana jest duża powierzchnia białka na CMG2 (i TEM8).

Petosa i in. rozwiązał strukturę heptameru PA63 przy 4,5 Å (0,45 nm). Struktura, którą rozwiązali, była niezwiązaną z błoną porą wstępną, konformacją heptameru, zanim kompleks rozszerzy beczkę β przez błonę plazmatyczną, aby przenieść LF i EF do cytozolu.
Heptameryzacja i tworzenie porów jest hamowane sterycznie przez fragment PA20, ale po usunięciu go z wierzchu monomeru szybko tworzy się por. Tworzenie heptameru nie powoduje większych zmian w konformacji każdego pojedynczego monomeru, ale łącząc się, ponad 15400 Ų (154 nm 2 ) powierzchni białka jest zakopane. Ta zakopana powierzchnia składa się głównie z polarnych lub naładowanych grup bocznych z domen 1 i 2.
PA tworzy również oktameryczną strukturę przedkanałową. Wykazano, że forma oktameryczna jest bardziej termostabilna niż postać heptameryczna, a zatem oktameryczny oligomer może utrzymywać się w osoczu gospodarza podczas infekcji wąglikiem.
Podczas oligomeryzacji PA63 cząsteczki EF i/lub LF szybko i jednocześnie wiążą się z kanałem wstępnym PA. Wiązanie to występuje, ponieważ po usunięciu domeny PA20 na domenie 1 PA63 zostaje odkryta duża powierzchnia hydrofobowa. Domena 1 zapewnia dużą powierzchnię, która oddziałuje z N-końcem EF i LF, która jest prawie całkowicie homologiczna dla pierwszych ~36 reszt i podobna trzeciorzędowa struktura dla pierwszych ~250 reszt. Badania regionu wiążącego LF i EF wykazały, że duża powierzchnia styka się z domeną 1 dwóch sąsiednich cząsteczek PA63 w konformacji heptameru. Ten duży obszar wiązania wyjaśnia, dlaczego poprzednie badania mogły wiązać tylko do trzech cząsteczek na heptamerze PA63. Struktura kokrystaliczna oktameru PA w kompleksie z N-końcowym LF ujawniła, że interakcja wiązania jest w rzeczywistości dwoma nieciągłymi miejscami. Jedno miejsce, określane jako podwitryna C-końcowa, przypomina klasyczny „gorący punkt” z przewidywanymi mostkami solnymi i interakcjami elektrostatycznymi. Drugie miejsce, określane jako podmiejsce zacisku alfa, to głęboka szczelina, która niespecyficznie wiąże N-końcową helisę alfa i krótką nić beta LF, prowadząc N-koniec substratu w kierunku światła kanału wstępnego PA. W ten sposób klamra alfa pomaga w translokacji białka, nieswoistym wiązaniu, a następnie rozwijaniu struktury drugorzędowej, gdy rozwija się z podłoża. Miejsce wiązania LF/EF jest obecnie wykorzystywane do dostarczania środków terapeutycznych za pośrednictwem białek fuzyjnych.
Po utworzeniu prepory i przyłączeniu LF i/lub EF, heptamer migruje do tratwy lipidowej, gdzie ulega szybkiej endocytozie. Endocytoza występuje w wyniku serii zdarzeń. Zaczyna się to, gdy CMG2 lub TEM8 jest palmitoilowany, co hamuje asocjację receptora z tratwami lipidowymi. Hamuje to endocytozę receptora przed rozszczepieniem PA83 i zanim LF lub EF będą mogły związać się z heptamerem. Ponowne połączenie receptora z w cholesterol i glikosfigolipidy ( rafty lipidowe ) następuje, gdy PA63 wiąże się z receptorem i heptameryzuje. Gdy receptor i PA powrócą do tratwy lipidowej, ligaza ubikwityny E3 Cb1 ubikwitynuje cytoplazmatyczny ogon receptora, sygnalizując receptorowi i związanym z nim białkom toksyny do endocytozy. Dynamina i Eps15 są wymagane do wystąpienia tej endocytozy, co wskazuje, że toksyna wąglika dostaje się do komórki poprzez szlak zależny od klatryny .
Jak omówiono, każda cząsteczka oddziałuje z kilkoma innymi w celu wywołania endocytozy toksyny wąglika. Po wejściu kompleks jest przenoszony do przedziału kwaśnego, gdzie heptamer, wciąż w konformacji przedporowej nieobejmującej błony, jest przygotowywany do translokacji EF i LF do cytozolu.
Zależność struktura-funkcja od pęcherzyka do cytozolu
Tworzenie się porów
Na pierwszy rzut oka, pierwszorzędowa sekwencja PA nie wygląda jak sekwencja białka przechodzącego przez błonę. Na wykresie hydrofobowości brakuje jakichkolwiek wzorów, które są wspólne dla możliwych domen obejmujących błonę. Struktury innych multimerycznych białek błonowych (takich jak toksyna błonicza ) dostarczają odpowiedzi na pytanie, w jaki sposób PA przenika przez błonę. Uważa się, że PA działa jak te multimeryczne białka błonowe, które tworzą beczki β wykonane z odcinków zarówno polarnych, jak i niepolarnych aminokwasów z każdego monomeru.
Spadek pH ułatwia tworzenie się porów beczki β. Aby uformować beczkę, gdy pH spada, domena 2 PA63 musi przejść największą zmianę konformacji. Po zbadaniu struktury domeny 2 (ryc. 7) można zauważyć, że domena ta zawiera motyw klucza greckiego (część złota na ryc. 7). Ogólny schemat motywu klucza greckiego pokazano na ryc. 8. Do klucza greckiego w domenie 2 dołączona jest duża nieuporządkowana pętla. Konieczność tej pętli w tworzeniu porów została wykazana poprzez zastosowanie mutagenezy i proteolizy pętli z chymotrypsyną. Dodatkowe pomiary elektrofizjologiczne substytucji cysteiny umieszczają aminokwasy tej pętli w świetle porów wstawionej błony. Nieuporządkowana pętla w domenie 2 ma również wzór naprzemiennych aminokwasów hydrofobowych i hydrofilowych, który jest wzorem zachowanym w częściach poryn obejmujących błonę. Jedynym problemem jest to, że pętla nie jest wystarczająco duża, aby objąć membranę w beczce β. To wstawienie błony mogło nastąpić tylko przy dodatkowych zmianach konformacyjnych. Duża zmiana konformacyjna ma miejsce, gdy rozwija się motyw klucza greckiego, tworząc szpilkę β, która wystaje w dół do membrany i tworzy beczkę β z pozostałymi 6 monomerami kompleksu (ryc. 9a i 9b). Końcowy por ma średnicę 12 Å (1,2 nm), co odpowiada wartości teoretycznej tego modelu.
Model ten wymagałby dużych zmian konformacyjnych w domenie 2 wraz z zerwaniem wielu wiązań wodorowych, gdy motyw greckiego klucza odrywa się od środka domeny. Petosa i in. zaproponował model tego, jak to się dzieje. Wstawienie kluczowych motywów greckich PA do membrany następuje, gdy heptamer jest zakwaszony. W przypadku sztucznych dwuwarstw ma to miejsce, gdy pH spada z 7,4 do 6,5, co sugeruje, że wyzwalacz wstawiania obejmuje miareczkowanie histydyn. To rzeczywiście pasuje do sekwencji PA, ponieważ domena 2 zawiera pewną liczbę histydyn (pokazanych jako gwiazdki na rycinie 9a). W nieuporządkowanej pętli znajdują się trzy reszty histydynowe, z których jedna leży z histydyną klucza greckiego w grupie polarnych aminokwasów. Ten klaster (w tym dwie histydyny, trzy argininy i jeden glutaminian) jest osadzony na górze motywu klucza greckiego, więc łatwo zauważyć, że protonowanie tych histydyn zakłóciłoby klaster. Ponadto inna histydyna znajduje się u podstawy motywu klucza greckiego wraz z szeregiem reszt hydrofobowych (na zielonym segmencie na ryc. 7 i 9a). Przy pH 7,4 ten segment jest uporządkowany, ale gdy kryształy rosną przy pH 6,0, staje się nieuporządkowany. Ta kolejność przejścia do nieporządku jest początkowym etapem wstawiania błony PA.
PA ulega endocytozie jako rozpuszczalny heptamer przyłączony do jego receptorów, przy czym LF lub EF jest przyłączony do heptameru jako ładunek. Pierwszym krokiem po endocytozie jest zakwaszenie pęcherzyka endocytotycznego. Zakwaszenie odgrywa dwie role w żywotności toksyny. Po pierwsze, pomaga rozluźnić ciasny uchwyt receptora CMG2 lub TEM8 na PA, ułatwiając tworzenie porów (różne receptory pozwalają na wstawienie przy nieco innym pH). Po drugie, spadek pH powoduje, że nieuporządkowana pętla i motyw greckiego klucza w domenie PA 2 wyginają się z przedporu heptameru i wsuwają się przez ścianę kwaśnego pęcherzyka, co prowadzi do powstawania porów (ryc. 7–9) .
Santelli i in. wyjaśnili więcej o procesie po określeniu struktury krystalicznej kompleksu PA/CMG2. Struktura tego kompleksu pokazuje wiązanie CMG2 zarówno przez domenę 2, jak i 4 PA. Ta interakcja pokazuje mniejszą swobodę rozwijania klucza greckiego. Dalsza analiza pokazuje, że siedem z dziewięciu histydyn w PA znajduje się na interfejsie domena 2/domena 4. Protonowanie tych histydyn powoduje, że domeny rozdzielają się na tyle, aby umożliwić greckiemu kluczowi wypadnięcie i pomóc w utworzeniu spinki do włosów β zaangażowanej w wstawianie. Ponadto, gdy PA wiąże się z CMG2, insercja nie występuje już przy pH 6,5, jak ma to miejsce w przypadku wstawienia do sztucznej błony. Zamiast tego wymaga pH 5,0 do wstawienia do naturalnych komórek. Ta różnica została wyjaśniona jako wynik kieszeni obok motywu MIDAS w CMG2. Ta kieszeń zawiera histydynę zakopaną na dnie, gdzie przyczepia się domena 2. Ta histydyna jest protonowana przy niższym pH i zwiększa stabilność PA. Ta dodatkowa stabilność uniemożliwia poruszanie się klucza greckiego, dopóki nie zostaną spełnione bardziej kwaśne warunki. Wszystkie te histydyny działają łącznie, aby zapobiec przedwczesnemu wstawieniu heptameru przed wystąpieniem endocytozy.
Santelli i współpracownicy (ryc. 10) zbudowali również hipotetyczną strukturę struktury PA / CMG2 z wstawioną błoną. Ten model pokazuje, że beczka β ma około 70 Å (7 nm) długości, z czego 30 Å (3 nm) rozciąga się na błonę, a szczelina 40 Å (4 nm) jest faktycznie wypełniona resztą zewnątrzkomórkowej części receptor CMG2 (~100 reszt). CMG2 zapewnia dodatkowe wsparcie dla porów.
Translokacja białek
Kilka ostatnich badań pokazuje, w jaki sposób pory PA63 umożliwiają EF i LF do cytoplazmy, gdy jej światło jest tak małe. Światło w porach PA63 ma tylko 15 Å (1,5 nm), czyli znacznie mniej niż średnica LF lub EF. Translokacja zachodzi poprzez serię zdarzeń, które rozpoczynają się w endosomie w miarę jego zakwaszania. LF i EF są wrażliwe na pH, a wraz ze spadkiem pH ich struktury tracą stabilność. Poniżej pH 6,0 (pH w endosomie), zarówno LF, jak i EF stają się nieuporządkowanymi stopionymi kuleczkami . Kiedy cząsteczka jest w tej konformacji, N-koniec jest uwalniany i wciągany do porów przez gradient protonów i dodatni potencjał transbłonowy. Pierścień siedmiu fenyloalaniny po stronie endosomu jamy ustnej (klamra fenyloalaniny) pomaga w rozwijaniu LF lub EF poprzez interakcję z hydrofobowymi resztami znajdującymi się w LF lub EF. Gradient protonów zaczyna następnie przeplatać białko przez pory. Mechanizm sznurowania jest napędzany przez nachylenie, ale wymaga zacisku fenyloalaniny do ruchu zapadkowego. Pierwsze 250 reszt EF i LF ma nieregularną, naprzemienną sekwencję reszt zasadowych, kwasowych i hydrofobowych. Wzajemne oddziaływanie między zaciskiem fenyloalaniny a stanem protonowania powoduje efekt zapadkowy, który napędza białko, dopóki wystarczająca ilość nie przejdzie do cytoplazmy, aby przeciągnąć resztę przez pory, gdy N-koniec ponownie się fałduje.
Linki zewnętrzne
- „Molekuła miesiąca” kwiecień 2012 r
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P15917 (czynnik letalny) w PDBe-KB .



