Toksyna cholery
Toksyna cholery (znana również jako choleragen i czasami w skrócie CTX , Ctx lub CT ) to multimeryczny kompleks białkowy AB5 wydzielany przez bakterię Vibrio cholerae . CTX jest odpowiedzialny za masywną, wodnistą biegunkę charakterystyczną dla cholerą . Jest członkiem termolabilnej rodziny enterotoksyn .
Historia
Toksyna cholery została odkryta w 1959 roku przez indyjskiego mikrobiologa Sambhu Nath De .
Struktura
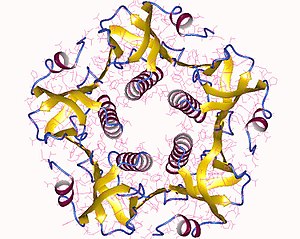
Kompletna toksyna jest heksamerem złożonym z jednej kopii podjednostki A (część A, enzymatyczna) i pięciu kopii podjednostki B (część B, wiążąca się z receptorem), oznaczonych jako AB5 . Podjednostka B wiąże się, podczas gdy podjednostka A aktywuje białko G, które aktywuje cyklazę adenylanową . Trójwymiarową strukturę toksyny określono za pomocą krystalografii rentgenowskiej przez Zhanga i in. w 1995.
Pięć podjednostek B – każda o masie 11 kDa , tworzy pięcioczłonowy pierścień. Podjednostka A, która ma masę 28 kDa, ma dwa ważne segmenty. Część A1 łańcucha (CTA1) jest kulistym enzymatycznym , który ADP-rybozyluje białka G , podczas gdy łańcuch A2 (CTA2) tworzy wydłużoną helisę alfa , która ściśle przylega do centralnych porów pierścienia podjednostki B.
Ta struktura jest podobna pod względem kształtu, mechanizmu i sekwencji do termolabilnej enterotoksyny wydzielanej przez niektóre szczepy bakterii Escherichia coli .
Patogeneza
Toksyna cholery działa według następującego mechanizmu: Po pierwsze, pierścień podjednostki B toksyny cholery wiąże się z gangliozydami GM1 na powierzchni komórek docelowych. Jeśli komórce brakuje GM1, toksyna najprawdopodobniej wiąże się z innymi typami glikanów , takimi jak Lewis Y i Lewis X , przyłączonymi do białek zamiast do lipidów. Po związaniu cały kompleks toksyny jest endocytozowany przez komórkę, a redukcja mostka dwusiarczkowego uwalnia łańcuch toksyny cholery A1 (CTA1). Endosom jest przenoszony do aparatu Golgiego , gdzie białko A1 jest rozpoznawane przez białko opiekuńcze retikulum endoplazmatycznego (ER) , białkową izomerazę dwusiarczkową . Łańcuch A1 jest następnie rozkładany i dostarczany do błony, gdzie Ero1 wyzwala uwalnianie białka A1 poprzez utlenianie kompleksu izomerazy dwusiarczkowej białka. Gdy białko A1 przemieszcza się z ER do cytoplazmy przez kanał Sec61 , ponownie fałduje się i unika dezaktywacji w wyniku ubikwitynacji .
CTA1 może wtedy swobodnie wiązać się z ludzkim białkiem partnerskim o nazwie ARF6 (czynnik rybozylacji ADP 6); wiązanie z Arf6 powoduje zmianę kształtu CTA1, co odsłania jego miejsce aktywne i umożliwia jego aktywność katalityczną. Fragment CTA1 katalizuje ADP-rybozylację białek podjednostki Gs alfa (Gαs ) przy użyciu NAD . ADP-rybozylacja powoduje, że podjednostka Gαs traci swoją katalityczną aktywność hydrolizy GTP do GDP + Pi , utrzymując w ten sposób Gαs w stanie aktywnym. Zwiększona aktywacja Gαs prowadzi do zwiększonej aktywności cyklazy adenylanowej , która zwiększa wewnątrzkomórkowe stężenie 3',5'-cyklicznego AMP (cAMP) ponad 100-krotnie w stosunku do normy i nadmiernie aktywuje cytozolową PKA . Te aktywne PKA następnie fosforylują kanału chlorkowego regulatora przewodnictwa przezbłonowego mukowiscydozy (CFTR) , co prowadzi do wypływu jonów chlorkowych za pośrednictwem ATP i prowadzi do wydzielania H 2 O , Na + , K + i HCO 3 − do jelita światło . Ponadto zmniejsza się wnikanie Na + , aw konsekwencji wnikanie wody do enterocytów . Połączone efekty powodują szybką utratę płynów z jelita, do 2 litrów na godzinę, co prowadzi do ciężkiego odwodnienia i innych czynników związanych z cholerą, w tym stolca z wodą ryżową .
Toksyna krztuścowa (również białko AB 5 ) wytwarzana przez Bordetella pertussis działa w podobny sposób, z wyjątkiem tego, że ADP-rybozyluje podjednostkę Gα i , czyniąc ją niezdolną do hamowania produkcji cAMP.
Pochodzenie
Gen kodujący toksynę cholery jest wprowadzany do V. cholerae przez poziomy transfer genów . Zjadliwe szczepy V. cholerae zawierają wirusa znanego jako bakteriofag CTXφ .
Aplikacje
Ponieważ podjednostka B wydaje się być stosunkowo nietoksyczna, naukowcy znaleźli dla niej szereg zastosowań w biologii komórkowej i molekularnej. Jest rutynowo używany jako znacznik neuronalny .
Traktowanie hodowanych nerwowych komórek macierzystych gryzoni toksyną cholery indukuje zmiany w lokalizacji czynnika transkrypcyjnego Hes3 i zwiększa ich liczbę.
Gangliozydy GM1 znajdują się w tratwach lipidowych na powierzchni komórki. Do identyfikacji tratw można zastosować kompleksy podjednostek B znakowane znacznikami fluorescencyjnymi lub następnie ukierunkowane przeciwciałami.
Szczepionka
Obecnie istnieją dwie szczepionki przeciwko cholerze: Dukoral i Shanchol. Obie szczepionki wykorzystują całe zabite V. cholerae , jednak Dukoral zawiera również rekombinowaną toksynę cholery β (rCTB). Niektóre badania sugerują, że włączenie rCTB może poprawić skuteczność szczepionki u małych dzieci (2-10 lat) i wydłużyć czas ochrony. Przeciwdziałają temu koszty ochrony i przechowywania rCTB przed degradacją.
Adiuwant szczepionkowy
Innym zastosowaniem podjednostki CTB może być adiuwant szczepionkowy do innych szczepionek. Wykazano, że sprzężenie CTB i antygenów poprawia odpowiedź szczepionki. Obecnie potencjał adiuwantowy CTB został wykazany na dużych modelach zwierzęcych, dlatego potrzebne są dalsze badania. Może to pozwolić na zastosowanie CTB jako adiuwanta w szczepieniach przeciwko wielu rodzajom chorób. Może to obejmować infekcje bakteryjne i wirusowe, alergie i cukrzycę. Warto zauważyć, że CTB indukuje humoralną odpowiedź immunologiczną błony śluzowej , dlatego potencjalnym celem są szczepionki przeciwko wirusom błony śluzowej, takim jak HIV.
Biologia membranowa
Tratwy lipidowe
Ponieważ wykazano, że toksyna cholery preferencyjnie wiąże się z gangliozydami GM1, tę cechę można wykorzystać do badań membranowych. Tratwy lipidowe są trudne do zbadania, ponieważ różnią się wielkością i długością życia, a także stanowią część niezwykle dynamicznego składnika komórek. Używając toksyny β cholery jako markera, możemy lepiej zrozumieć właściwości i funkcje tratw lipidowych.
Endocytoza
Endocytoza jest ogólnie podzielona na procesy zależne od klatryny i niezależne od klatryny, a toksyna cholery wykorzystuje oba szlaki. Wykazano, że toksyna cholery dostaje się do komórek poprzez endocytozę wieloma szlakami. Szlaki te obejmują kaweole , doły pokryte klatryną, nośniki niezależne od klatryny (CLIC) i szlak przedziałów endocytarnych wzbogaconych w GPI (GEEC), endocytozę za pośrednictwem ARF6 i szybką endocytozę za pośrednictwem endofiliny (FEME). To, w jaki sposób toksyna cholery wyzwala te szlaki endocytozy, nie jest w pełni zrozumiałe, ale fakt, że toksyna cholery wyzwala te szlaki, pokazuje użycie toksyny jako ważnego markera do badania tych mechanizmów.
Handel wsteczny
Jednym z najważniejszych aspektów toksyny cholery jest mechanizm ruchu wstecznego, który przenosi toksynę z błony komórkowej z powrotem do sieci trans-Golgiego i retikulum endoplazmatycznego. Ponieważ zarówno toksyna cholery, jak i gatunki GM1 mogą być znakowane znacznikami fluorescencyjnymi, można monitorować mechanizm ruchu wstecznego. Daje to możliwość monitorowania mechanizmu w czasie rzeczywistym. Może to otworzyć nowe odkrycia na temat działania transportu wewnątrzkomórkowego oraz sortowania białek i lipidów w szlaku endocytotycznym .
Zobacz też
Linki zewnętrzne
- De, Sambhu Nath. Enterotoksyczność wolnego od bakterii przesączu z hodowli Vibrio cholerae . Natura. 30 maja 1959. 183: 1533–4.
- McDowall, Jennifer (wrzesień 2005). „toksyna cholery” . Białko Miesiąca (POTM). Białkowy Bank Danych w Europie (PDBe). Zarchiwizowane od oryginału w dniu 27 kwietnia 2019 r.
- Goodsell, David (wrzesień 2005). „toksyna cholery” . Bank danych białek RCSB . Cząsteczka miesiąca (MOTM). Bank danych białek (PDB). doi : 10.2210/rcsb_pdb/mom_2005_9 . Zarchiwizowane od oryginału w dniu 25 października 2011 r.
- Cholera + toksyna w US National Library of Medicine Medical Subject Headings (MeSH)
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P01555 (podjednostka A enterotoksyny cholery) w PDBe-KB .
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P01556 (podjednostka B enterotoksyny cholery) w PDBe-KB .