neurotoksyna

Neurotoksyny to toksyny niszczące tkankę nerwową (powodujące neurotoksyczność ). Neurotoksyny to obszerna klasa egzogennych chemicznych urazów neurologicznych , które mogą niekorzystnie wpływać na funkcje zarówno rozwijającej się, jak i dojrzałej tkanki nerwowej. Termin ten może być również używany do klasyfikacji endogennych związki, które przy nieprawidłowym kontakcie mogą okazać się toksyczne neurologicznie. Chociaż neurotoksyny są często niszczące neurologicznie, ich zdolność do specyficznego celowania w komponenty nerwowe jest ważna w badaniu układów nerwowych. Typowe przykłady neurotoksyn to ołów , etanol (alkohol pitny), glutaminian , tlenek azotu , toksyna botulinowa (np. botoks), toksyna tężcowa i tetrodotoksyna . Niektóre substancje, takie jak tlenek azotu i glutaminian, są w rzeczywistości niezbędne do prawidłowego funkcjonowania organizmu i działają neurotoksycznie dopiero w nadmiernych stężeniach.
Neurotoksyny hamują kontrolę neuronów nad stężeniami jonów przez błonę komórkową lub komunikację między neuronami przez synapsę . Lokalna patologia ekspozycji na neurotoksyny często obejmuje ekscytotoksyczność lub apoptozę neuronów , ale może również obejmować uszkodzenie komórek glejowych . Makroskopowe objawy narażenia na neurotoksyny mogą obejmować rozległe uszkodzenia ośrodkowego układu nerwowego, takie jak niepełnosprawność intelektualna , uporczywa pamięć upośledzenie umysłowe, epilepsja i demencja . Ponadto często dochodzi do uszkodzenia obwodowego układu nerwowego, w którym pośredniczą neurotoksyny, takie jak neuropatia lub miopatia . Wykazano wsparcie dla wielu terapii mających na celu złagodzenie uszkodzeń, w których pośredniczą neurotoksyny, takich jak podawanie przeciwutleniaczy i antytoksyn .
Tło
Narażenie społeczeństwa na neurotoksyny nie jest niczym nowym, ponieważ cywilizacje były narażone na neurodestrukcyjne związki przez tysiące lat. Godnym uwagi przykładem jest możliwe znaczne narażenie na ołów w Cesarstwie Rzymskim , wynikające z rozwoju rozległych sieci wodociągowych i zwyczaju gotowania octu winnego w ołowianych patelniach w celu jego dosłodzenia, w procesie wytwarzania octanu ołowiu, znanego jako „cukier ołowiu”. Po części neurotoksyny były częścią ludzkości ze względu na delikatną i podatną naturę układu nerwowego, co czyni go bardzo podatnym na zakłócenia.
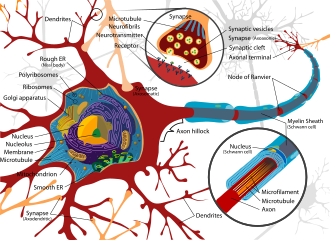
Tkanka nerwowa znajdująca się w mózgu , rdzeniu kręgowym i na obwodzie obejmuje niezwykle złożony system biologiczny, który w dużej mierze określa wiele unikalnych cech jednostek. Podobnie jak w przypadku każdego wysoce złożonego systemu, nawet niewielkie zakłócenia w jego otoczeniu mogą prowadzić do znacznych zakłóceń funkcjonalnych. Właściwości prowadzące do podatności tkanki nerwowej to duża powierzchnia neuronów, wysoka lipidów zatrzymujących toksyny lipofilowe, wysoka zawartość krwi przepływ do mózgu, wywołując zwiększoną efektywną ekspozycję na toksyny i utrzymywanie się neuronów przez całe życie jednostki, co prowadzi do narastania uszkodzeń. W rezultacie układ nerwowy ma szereg mechanizmów zaprojektowanych w celu ochrony przed atakami wewnętrznymi i zewnętrznymi, w tym barierą krew-mózg.
Bariera krew-mózg (BBB) jest jednym z krytycznych przykładów ochrony, która zapobiega przedostawaniu się toksyn i innych niepożądanych związków do mózgu. Ponieważ mózg wymaga dostarczania składników odżywczych i usuwania odpadów, jest on perfundowany przez przepływ krwi. Krew może jednak przenosić wiele spożytych toksyn, które mogłyby wywołać znaczną śmierć neuronów, gdyby dotarły do tkanki nerwowej. W ten sposób komórki ochronne zwane astrocytami otaczają naczynia włosowate w mózgu i absorbują składniki odżywcze z krwi, a następnie transportują je do neuronów, skutecznie izolując mózg od szeregu potencjalnych uszkodzeń chemicznych.
Bariera ta tworzy szczelną warstwę hydrofobową wokół naczyń włosowatych w mózgu, hamując transport dużych lub hydrofilowych związków. Oprócz BBB, splot naczyniówkowy zapewnia warstwę ochronną przed wchłanianiem toksyn w mózgu. Sploty naczyniówkowe to unaczynione warstwy tkanki znajdujące się w trzeciej, czwartej i bocznej komorze mózgu , które poprzez funkcję swoich komórek wyściółki są odpowiedzialne za syntezę płynu mózgowo-rdzeniowego (CSF). Co ważne, poprzez selektywne przechodzenie jonów i składników odżywczych oraz wychwytywanie metali ciężkich, takich jak ołów, sploty naczyniówkowe utrzymują ściśle regulowane środowisko, które obejmuje mózg i rdzeń kręgowy.
Będąc hydrofobowymi i małymi lub hamując funkcję astrocytów, niektóre związki, w tym niektóre neurotoksyny, są w stanie przeniknąć do mózgu i wywołać znaczne uszkodzenia. W dzisiejszych czasach naukowcami i lekarzami stanęło wyzwanie identyfikacji i leczenia neurotoksyn, co zaowocowało rosnącym zainteresowaniem zarówno badaniami neurotoksykologicznymi, jak i badaniami klinicznymi. Chociaż neurotoksykologia kliniczna jest w dużej mierze rozwijającą się dziedziną, poczyniono rozległe postępy w identyfikacji wielu neurotoksyn środowiskowych, co doprowadziło do klasyfikacji od 750 do 1000 znanych potencjalnie neurotoksycznych związków. Ze względu na krytyczne znaczenie znajdowania neurotoksyn w typowych środowiskach, opracowano specjalne protokoły Agencja Ochrony Środowiska Stanów Zjednoczonych (EPA) do testowania i określania neurotoksycznych skutków związków (USEPA 1998). Ponadto wzrosło użycie systemów in vitro , ponieważ zapewniają one znaczną poprawę w porównaniu z bardziej powszechnymi systemami in vivo systemy z przeszłości. Przykłady ulepszeń obejmują łatwe do opanowania, jednolite środowiska i eliminację zanieczyszczających skutków metabolizmu ogólnoustrojowego. Systemy in vitro stwarzają jednak problemy, ponieważ trudno było właściwie odtworzyć złożoność układu nerwowego, taką jak interakcje między wspierającymi astrocytami i neuronami w tworzeniu BBB. Aby jeszcze bardziej skomplikować proces określania neurotoksyn podczas testowania in vitro, neurotoksyczności i cytotoksyczności może być trudne, ponieważ bezpośrednie wystawienie neuronów na związki może nie być możliwe in vivo, ponieważ jest to in vitro. Dodatkowo odpowiedź nt komórek na chemikalia może nie odzwierciedlać dokładnie rozróżnienia między neurotoksynami i cytotoksynami, ponieważ w odpowiedzi na którekolwiek z nich mogą wystąpić objawy, takie jak stres oksydacyjny lub modyfikacje szkieletu .
Aby zaradzić tej komplikacji, ostatnio zaproponowano wyrostki neurytów (aksonalne lub dendrytyczne) w odpowiedzi na zastosowane związki jako dokładniejsze rozróżnienie między prawdziwymi neurotoksynami a cytotoksynami w środowisku testowym in vitro. Jednak ze względu na znaczne nieścisłości związane z tym procesem, zdobywanie szerokiego poparcia jest powolne. Ponadto mechanizmy biochemiczne stały się szerzej stosowane w testach neurotoksyn, tak że związki można badać pod kątem wystarczającej zdolności do indukowania interferencji mechanizmów komórkowych, takich jak hamowanie acetylocholinoesterazy pojemność fosforanów organicznych (w tym DDT i gaz sarin ). Chociaż metody określania neurotoksyczności nadal wymagają znacznego rozwoju, identyfikacja szkodliwych związków i objawów narażenia na toksyny uległa znacznej poprawie.
Zastosowania w neuronauce
Chociaż różnią się właściwościami chemicznymi i funkcjami, neurotoksyny mają wspólną właściwość polegającą na tym, że działają poprzez pewien mechanizm prowadzący do zakłócenia lub zniszczenia niezbędnych składników w układzie nerwowym . Neurotoksyny jednak z samej swojej konstrukcji mogą być bardzo przydatne w dziedzinie neuronauki . Ponieważ układ nerwowy większości organizmów jest zarówno bardzo złożony, jak i niezbędny do przetrwania, w naturalny sposób stał się celem ataków zarówno drapieżników, jak i ofiar. Jako organizmy jadowite często wykorzystują swoje neurotoksyny do bardzo szybkiego ujarzmienia drapieżnika lub ofiary, toksyny ewoluowały, aby stać się wysoce specyficzne dla ich kanałów docelowych, tak że toksyna nie wiąże się łatwo z innymi celami (patrz toksyny kanału jonowego ). Jako takie, neurotoksyny dostarczają skutecznych środków, dzięki którym pewne elementy układu nerwowego mogą być dokładnie i skutecznie ukierunkowane. Wczesny przykład celowania opartego na neurotoksynach wykorzystywał znakowaną radioaktywnie tetrodotoksynę do oznaczania kanałów sodowych i uzyskiwania precyzyjnych pomiarów ich stężenia wzdłuż błon nerwowych . Podobnie, poprzez izolację niektórych aktywności kanałów, neurotoksyny umożliwiły ulepszenie oryginalnego neuronu Hodgkina-Huxleya, w którym wysunięto teorię, że pojedyncze ogólne kanały sodowe i potasowe mogą odpowiadać za większość funkcji tkanki nerwowej. Na podstawie tego podstawowego zrozumienia użycie typowych związków, takich jak tetrodotoksyna, tetraetyloamoniowy i bungarotoksyny , doprowadziło do znacznie głębszego zrozumienia różnych sposobów, w jakie mogą zachowywać się poszczególne neurony.
Mechanizmy działania
Ponieważ neurotoksyny są związkami, które niekorzystnie wpływają na układ nerwowy, wiele mechanizmów, poprzez które działają, polega na hamowaniu procesów komórkowych neuronów. Te zahamowane procesy mogą wahać się od mechanizmów depolaryzacji błony do komunikacji między neuronami . Hamując zdolność neuronów do wykonywania oczekiwanych funkcji wewnątrzkomórkowych lub przekazywania sygnału do sąsiedniej komórki, neurotoksyny mogą indukować zatrzymanie ogólnoustrojowego układu nerwowego, tak jak w przypadku toksyny botulinowej lub nawet śmierć tkanki nerwowej. Czas wymagany do wystąpienia objawów po ekspozycji na neurotoksynę może się różnić w zależności od różnych toksyn i jest rzędu godzin w przypadku toksyny botulinowej i lat w przypadku ołowiu.
| Klasyfikacja neurotoksyn | neurotoksyny |
|---|---|
| Inhibitory kanałów Na | tetrodotoksyna |
| Inhibitory kanału K | tetraetyloamoniowy |
| Inhibitory kanału Cl | chlorotoksyna , |
| Inhibitory kanału Ca | konotoksyna |
| Inhibitory uwalniania pęcherzyków synaptycznych | toksyna botulinowa , |
| Inhibitory bariery krew-mózg | aluminium , |
| Inhibitory/antagoniści receptorów | Bungarotoksyna , |
| Agoniści receptorów |
Anatoksyna-a ,
JWH-018 , |
| Interferencja cytoszkieletu | amoniak , |
| Cytotoksyczność za pośrednictwem Ca | Ołów |
| Wiele efektów |
etanol , N-heksan , |
| Neurotoksyny selektywne względem receptora | MPP + |
| Endogenne źródła neurotoksyn | tlenek azotu , |
Inhibitory
Kanał sodowy
tetrodotoksyna

Tetrodotoksyna (TTX) jest trucizną wytwarzaną przez organizmy należące do rzędu Tetraodontiformes , który obejmuje rozdymkę , samogłów i jeżozwierz . W rybach rozdymkowatych TTX znajduje się w wątrobie , gonadach , jelitach i skórze . TTX może być śmiertelny w przypadku spożycia i stał się powszechną formą zatrucia w wielu krajach. Częstymi objawami zażywania TTX są parestezje (często ograniczone do ust i kończyn ), osłabienie mięśni, nudności i wymioty , które często pojawiają się w ciągu 30 minut od spożycia . Podstawowym mechanizmem toksyczności TTX jest hamowanie funkcji kanału sodowego, co zmniejsza funkcjonalną zdolność komunikacji neuronów. To hamowanie w dużej mierze wpływa na wrażliwy podzbiór kanałów sodowych, znanych jako wrażliwe na TTX (TTX-s), które są również w dużej mierze odpowiedzialne za prąd sodowy, który napędza fazę depolaryzacji potencjałów czynnościowych neuronów .
Oporny na TTX (TTX-r) to kolejna forma kanału sodowego, która ma ograniczoną wrażliwość na TTX i występuje głównie w aksonach o małej średnicy, takich jak te znajdujące się w neuronach nocycepcji . Spożycie znacznej ilości TTX wiąże kanały sodowe w neuronach i zmniejsza przepuszczalność ich błon dla sodu. Skutkuje to zwiększeniem skutecznego progu wymaganych sygnałów pobudzających do indukcji potencjału czynnościowego w neuronie postsynaptycznym. Efektem tego podwyższonego progu sygnalizacyjnego jest zmniejszona pobudliwość neuronów postsynaptycznych , a następnie utrata funkcji motorycznych i czuciowych, która może prowadzić do paraliżu i śmierci. Chociaż wspomagana wentylacja może zwiększyć szansę przeżycia po ekspozycji na TTX, obecnie nie ma antytoksyny. Zastosowanie inhibitora acetylocholinoesterazy, neostygminy lub muskarynowego antagonisty acetylocholiny , atropiny (która hamuje aktywność przywspółczulną), może jednak zwiększyć aktywność nerwów współczulnych na tyle, aby zwiększyć szanse przeżycia po ekspozycji na TTX.
Kanał potasowy
tetraetyloamoniowy
Tetraetyloamoniowy (TEA) jest związkiem, który, podobnie jak wiele neurotoksyn, został po raz pierwszy zidentyfikowany na podstawie swojego szkodliwego działania na układ nerwowy i wykazano, że ma zdolność hamowania funkcji nerwów ruchowych, a tym samym skurczu mięśni w sposób podobny do do kurary. Dodatkowo, poprzez przewlekłe podawanie TEA, indukowana byłaby atrofia mięśni. Później ustalono, że TEA działa in vivo głównie poprzez swoją zdolność do hamowania obu kanałów potasowych odpowiedzialnych za opóźniony prostownik widoczny w potencjale czynnościowym oraz pewna populacja kanałów potasowych zależnych od wapnia. To właśnie ta zdolność do hamowania przepływu potasu w neuronach uczyniła TEA jednym z najważniejszych narzędzi w neuronauce. Wysunięto hipotezę, że zdolność TEA do hamowania kanałów potasowych wywodzi się z podobnej do jonów potasu struktury wypełniającej przestrzeń. Co sprawia, że TEA jest bardzo przydatna dla neuronaukowców jest jego specyficzna zdolność do eliminowania aktywności kanału potasowego, umożliwiając w ten sposób badanie udziału innych kanałów jonowych w odpowiedzi neuronów, takich jak kanały sodowe bramkowane napięciem. Oprócz wielu zastosowań w badaniach neurologicznych, wykazano, że TEA działa jako skuteczne leczenie choroby Parkinsona dzięki zdolności do ograniczania postępu choroby.
Kanał chlorkowy
Chlorotoksyna
Chlorotoksyna (Cltx) jest substancją czynną znajdującą się w jadzie skorpiona i jest przede wszystkim toksyczna ze względu na swoją zdolność do hamowania przewodnictwa kanałów chlorkowych . Spożycie śmiercionośnych ilości Cltx powoduje paraliż w wyniku przerwania kanału jonowego. Wykazano, że Cltx, podobnie jak toksyna botulinowa, ma znaczącą wartość terapeutyczną. Dowody wykazały, że Cltx może hamować zdolność glejaków do infiltracji zdrowej tkanki nerwowej w mózgu, znacznie zmniejszając potencjalne inwazyjne szkody powodowane przez guzy.
Kanał wapniowy
konotoksyna
Konotoksyny reprezentują kategorię trucizn wytwarzanych przez szyszki morskie i są zdolne do hamowania aktywności wielu kanałów jonowych, takich jak kanały wapniowe, sodowe lub potasowe. W wielu przypadkach toksyny uwalniane przez różne rodzaje stożków obejmują szereg różnych rodzajów konotoksyn, które mogą być specyficzne dla różnych kanałów jonowych, tworząc w ten sposób jad zdolny do rozległego przerwania funkcji nerwów. Jedna z unikalnych form konotoksyn, ω-konotoksyna ( ω-CgTx ) jest wysoce specyficzny dla kanałów Ca i wykazał przydatność w izolowaniu ich z systemu. Ponieważ przepływ wapnia jest niezbędny do prawidłowej pobudliwości komórki, każde znaczące zahamowanie może uniemożliwić dużą ilość funkcjonalności. Co istotne, ω-CgTx jest zdolny do długotrwałego wiązania i hamowania zależnych od napięcia kanałów wapniowych znajdujących się w błonach neuronów, ale nie w komórkach mięśniowych.
Uwalnianie pęcherzyków synaptycznych
Toksyna botulinowa
Toksyna botulinowa (BTX) to grupa neurotoksyn składająca się z ośmiu odrębnych związków określanych jako BTX-A,B,C,D,E,F,G,H, które są wytwarzane przez bakterie Clostridium botulinum i prowadzą do porażenia mięśni . Szczególnie unikalną cechą BTX jest jego stosunkowo powszechne zastosowanie terapeutyczne w leczeniu dystonii i zaburzeń spastyczności , a także w wywoływaniu zaniku mięśni , mimo że jest najbardziej trującą znaną substancją. BTX działa obwodowo, hamując acetylocholiny (ACh) w złączu nerwowo-mięśniowym poprzez degradację białek SNARE wymaganych do fuzji pęcherzyka z błoną ACh . Ponieważ toksyna jest wysoce aktywna biologicznie, szacunkowa dawka 1 μg/kg masy ciała jest wystarczająca do wywołania niewystarczającej objętości oddechowej i wynikającej z tego śmierci przez uduszenie . Ze względu na wysoką toksyczność antytoksyny BTX były aktywnym obszarem badań. Wykazano, że kapsaicyna (substancja czynna odpowiedzialna za rumieńce w papryczkach chili ) może wiązać się z receptorem TRPV1 występującym na neuronach cholinergicznych i hamują toksyczne działanie BTX.
Toksyna tężcowa
Neurotoksyna tężcowa (TeNT) jest związkiem, który funkcjonalnie zmniejsza transmisje hamujące w układzie nerwowym, powodując tężyczkę mięśniową. TeNT jest podobny do BTX iw rzeczywistości jest bardzo podobny pod względem struktury i pochodzenia; obie należą do tej samej kategorii neurotoksyn Clostridium . Podobnie jak BTX, TeNT hamuje komunikację między neuronami poprzez uwalnianie pęcherzykowego neuroprzekaźnika (NT). Jedną z zauważalnych różnic między tymi dwoma związkami jest to, że podczas gdy BTX hamuje skurcze mięśni , TeNT je indukuje. Chociaż obie toksyny hamują uwalnianie pęcherzyków w synapsach neuronów, przyczyną tej odmiennej manifestacji jest to, że BTX działa głównie w obwodowym układzie nerwowym (PNS), podczas gdy TeNT jest w dużej mierze aktywny w ośrodkowy układ nerwowy (OUN). Jest to wynikiem migracji TeNT przez neurony ruchowe do neuronów hamujących rdzenia kręgowego po przejściu przez endocytozę . Powoduje to utratę funkcji neuronów hamujących w OUN, co skutkuje układowymi skurczami mięśni . Podobnie jak w przypadku śmiertelnej dawki BTX, TeNT prowadzi do paraliżu i późniejszego uduszenia .
Bariera krew-mózg
Aluminium
neurotoksyczne zachowanie glinu występuje po wejściu do układu krążenia , gdzie może migrować do mózgu i hamować niektóre kluczowe funkcje bariery krew-mózg (BBB). Utrata funkcji BBB może spowodować znaczne uszkodzenie neuronów w OUN, ponieważ bariera chroniąca mózg przed innymi toksynami znajdującymi się we krwi nie będzie już zdolna do takiego działania. Chociaż metal jest neurotoksyczny, efekty są zwykle ograniczone do pacjentów niezdolnych do usuwania nadmiaru jonów z krwi, takich jak osoby doświadczające niewydolność nerek . Pacjenci doświadczający zatrucia glinem mogą wykazywać objawy , takie jak zaburzenia uczenia się i zmniejszona koordynacja ruchowa . Ponadto wiadomo, że ogólnoustrojowe poziomy glinu zwiększają się wraz z wiekiem i wykazano, że korelują z chorobą Alzheimera , co sugeruje, że jest to neurotoksyczny związek przyczynowy tej choroby. Pomimo znanej toksyczności w postaci jonowej, badania dotyczące potencjalnej toksyczności stosowania aluminium w opakowaniach i urządzeniach do gotowania są podzielone.
Rtęć
Rtęć jest zdolna do wywoływania uszkodzeń OUN poprzez migrację do mózgu poprzez przekroczenie BBB. Rtęć występuje w wielu różnych związkach, chociaż metylortęć (MeHg + ), dimetylortęć i dietylortęć to jedyne formy znacząco neurotoksyczne. Dietylortęć i dimetylortęć są uważane za jedne z najsilniejszych neurotoksyn, jakie kiedykolwiek odkryto. MeHg + jest zwykle nabywana poprzez spożywanie owoców morza , ponieważ ma tendencję do koncentracji w organizmach znajdujących się wysoko w łańcuchu pokarmowym. Wiadomo, że jon rtęci hamuje transport aminokwasów (AA) i glutaminianu (Glu), potencjalnie prowadząc do efektów ekscytotoksycznych.
Agoniści i antagoniści receptorów
Anatoksyna-a
| Wideo zewnętrzne | |
|---|---|
|
Very Fast Death Factor University of Nottingham |
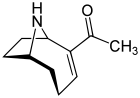
Badania nad anatoksyną- a , znaną również jako „czynnik bardzo szybkiej śmierci”, rozpoczęto w 1961 roku po śmierci krów, które piły jezioro zawierające zakwit glonów w Saskatchewan w Kanadzie. Jest to cyjanotoksyna wytwarzana przez co najmniej cztery różne rodzaje cyjanobakterii i została opisana w Ameryce Północnej, Europie, Afryce, Azji i Nowej Zelandii.
Toksyczne działanie anatoksyny – postępuje bardzo szybko, ponieważ działa bezpośrednio na komórki nerwowe ( neurony ). Postępujące objawy ekspozycji na anatoksynę to utrata koordynacji, drgawki , konwulsje i szybka śmierć w wyniku porażenia oddechowego . Tkanki nerwowe, które komunikują się z mięśniami, zawierają receptor zwany nikotynowym receptorem acetylocholiny . Pobudzenie tych receptorów powoduje skurcz mięśni . Anatoksyna- a Cząsteczka ma kształt dopasowany do tego receptora iw ten sposób naśladuje naturalny neuroprzekaźnik normalnie używany przez receptor, acetylocholinę . Po wywołaniu skurczu anatoksyna- a nie pozwala neuronom powrócić do stanu spoczynku, ponieważ nie jest rozkładana przez cholinoesterazę , która normalnie pełni tę funkcję. W rezultacie komórki mięśniowe kurczą się na stałe, komunikacja między mózgiem a mięśniami zostaje zakłócona, a oddech zatrzymuje się.
Kiedy po raz pierwszy została odkryta, toksyna została nazwana czynnikiem bardzo szybkiej śmierci (VFDF), ponieważ po wstrzyknięciu do jamy ciała myszy wywoływała drżenie, paraliż i śmierć w ciągu kilku minut. W 1977 roku określono strukturę VFDF jako drugorzędowej, bicyklicznej aminy alkaloidu i przemianowano go na anatoksynę- a . Strukturalnie przypomina kokainę. Nadal istnieje zainteresowanie anatoksyną- a ze względu na niebezpieczeństwa, jakie stwarza dla wód rekreacyjnych i pitnych, oraz ponieważ jest to szczególnie przydatna cząsteczka do badania receptorów acetylocholiny w układzie nerwowym. Śmiertelność toksyny oznacza, że ma ona wysoki potencjał militarny jako broń toksyczna.
Bungarotoksyna
Bungarotoksyna jest związkiem o znanej interakcji z nikotynowymi receptorami acetylocholiny (nAChR), które tworzą rodzinę kanałów jonowych , których aktywność wyzwalana jest przez wiązanie neuroprzekaźników. Bungarotoksyna jest wytwarzana w wielu różnych postaciach, chociaż jedną z powszechnie stosowanych form jest długołańcuchowa forma alfa, α-bungarotoksyna , która jest izolowana z kraitowego węża . Chociaż połknięta jest niezwykle toksyczna, α-bungarotoksyna okazała się bardzo użyteczna w neuronauce, ponieważ jest szczególnie biegła w izolowaniu nAChR ze względu na wysokie powinowactwo do receptorów. Ponieważ istnieje wiele postaci bungarotoksyny, istnieją różne formy nAChR, z którymi będą się wiązać, a α-bungarotoksyna jest szczególnie specyficzna dla α7-nAChR . Ten α7-nAChR działa, aby umożliwić jon wapnia napływ do komórek, a zatem zablokowanie przez spożytą bungarotoksynę wywoła szkodliwe skutki, ponieważ sygnalizacja ACh zostanie zahamowana. Podobnie zastosowanie α-bungarotoksyny może być bardzo przydatne w neurobiologii, jeśli pożądane jest zablokowanie przepływu wapnia w celu wyizolowania efektów innych kanałów. Ponadto różne formy bungarotoksyny mogą być przydatne do badania zahamowanych nAChR i wynikającego z nich przepływu jonów wapnia w różnych układach organizmu. Na przykład α-bungarotoksyna jest specyficzna dla nAChR występujących w mięśniach, a κ-bungarotoksyna jest specyficzna dla nAChR występujących w neuronach.
karamboksyna
Caramboxin (CBX) to toksyna występująca w owocach gwiaździstych ( Averrhoa carambola) . Osoby z niektórymi rodzajami chorób nerek są podatne na niekorzystne skutki neurologiczne, w tym zatrucie, drgawki, a nawet śmierć po zjedzeniu owocu gwiaździstego lub wypiciu soku z tego owocu. Caramboxin to nowa niepeptydowa toksyna aminokwasowa, która stymuluje receptory glutaminianu w neuronach. Karamboksyna jest agonistą glutaminergicznych receptorów jonotropowych NMDA i AMPA o silnych właściwościach pobudzających, konwulsyjnych i neurodegeneracyjnych.
Kurara
Termin „ kurara ” jest niejednoznaczny, ponieważ był używany do opisania wielu trucizn, które w czasie nazywania były rozumiane inaczej niż obecnie. W przeszłości charakterystyka oznaczała trucizny używane przez plemiona południowoamerykańskie na strzałach lub rzutkach , chociaż dojrzała, aby określić specyficzną kategoryzację trucizn, które działają na połączenie nerwowo-mięśniowe hamować sygnalizację, a tym samym wywołać rozluźnienie mięśni. Kategoria neurotoksyn zawiera wiele różnych trucizn, chociaż wszystkie zostały pierwotnie oczyszczone z roślin pochodzących z Ameryki Południowej. Efektem, z którym zwykle wiąże się wstrzyknięcie trucizny kurary, jest porażenie mięśni i wynikająca z tego śmierć. Kurara działa w szczególności poprzez hamowanie nikotynowych receptorów acetylocholiny w połączeniu nerwowo-mięśniowym . Zwykle te kanały receptorowe umożliwiają jonom sodu wnikanie do komórek mięśniowych w celu zainicjowania potencjału czynnościowego, który prowadzi do skurczu mięśni. Blokując receptory, neurotoksyna jest zdolna do znacznego zmniejszenia sygnalizacji połączeń nerwowo-mięśniowych, co zaowocowało jej stosowaniem przez anestezjologów do wywoływania rozluźnienia mięśni.
Interferencja cytoszkieletu
Amoniak
amoniaku jest często postrzegana przez dwie drogi podania, albo przez spożycie, albo przez dolegliwości endogenne, takie jak niewydolność wątroby . Jednym godnym uwagi przypadkiem, w którym powszechna jest toksyczność amoniaku , jest reakcja na marskość wątroby , która powoduje encefalopatię wątrobową i może powodować obrzęk mózgu (Haussingera 2006). Ten obrzęk mózgu może być wynikiem przebudowy komórek nerwowych. Wykazano, że w wyniku zwiększonego stężenia, aktywność amoniaku in vivo indukuje pęcznienie astrocytów w mózgu poprzez zwiększoną produkcję cGMP (cyklicznego monofosforanu guanozyny) w komórkach, co prowadzi do modyfikacji cytoszkieletu, w których pośredniczy kinaza białkowa G (PKG). Wynikowym skutkiem tej toksyczności może być zmniejszenie metabolizmu energetycznego i funkcji mózgu. Co ważne, toksyczne działanie amoniaku na przebudowę astrocytów można zmniejszyć poprzez podawanie L-karnityny . Wydaje się, że w tej przebudowie astrocytów pośredniczy mitochondriów wywołana amoniakiem . Ta przemiana mitochondrialna jest bezpośrednim skutkiem glutaminy, związku, który powstaje z amoniaku in vivo. Podawanie przeciwutleniaczy lub inhibitora glutaminazy może zmniejszyć tę przemianę mitochondrialną, a potencjalnie także przebudowę astrocytów.
Arsen
Arsen jest neurotoksyną powszechnie występującą w obszarach narażonych na spływy rolne , w kopalniach i hutach (Martinez-Finley 2011). Jednym ze skutków przyjmowania arsenu podczas rozwoju układu nerwowego jest zahamowanie neurytów , które może wystąpić zarówno w PUN, jak i OUN. To zahamowanie wzrostu neurytów może często prowadzić do defektów migracji neuronów i znacznych zmian morfologicznych neuronów podczas rozwoju ) często prowadząc do defektów cewy nerwowej w noworodki . Jako metabolit arsenu, arsenin powstaje po spożyciu arsenu i wykazuje znaczną toksyczność dla neuronów w ciągu około 24 godzin od narażenia. Mechanizm tej cytotoksyczności działa poprzez indukowany arseninem wzrost wewnątrzkomórkowych poziomów jonów wapnia w neuronach, co może następnie zmniejszyć potencjał transbłonowy mitochondriów, który aktywuje kaspazy , wywołując śmierć komórki. Inną znaną funkcją arseninu jest jego destrukcyjny charakter wobec cytoszkieletu poprzez hamowanie neurofilamentu transport. Jest to szczególnie destrukcyjne, ponieważ neurofilamenty są wykorzystywane w podstawowej strukturze i wsparciu komórek. litu okazało się jednak obiecujące w przywracaniu części utraconej ruchliwości neurofilamentów. Ponadto, podobnie jak w przypadku innych metod leczenia neurotoksynami, podawanie pewnych przeciwutleniaczy okazało się obiecujące w zmniejszaniu neurotoksyczności przyjmowanego arsenu.
Cytotoksyczność zależna od wapnia
Ołów
Ołów jest silną neurotoksyną, której toksyczność jest znana od co najmniej tysięcy lat. Chociaż efekty neurotoksyczne dla ołowiu występują zarówno u dorosłych , jak i małych dzieci , rozwijający się mózg jest szczególnie podatny na uszkodzenia wywołane przez ołów, skutki, które mogą obejmować apoptozę i ekscytotoksyczność. Podstawowym mechanizmem, dzięki któremu ołów może powodować szkody, jest jego zdolność do transportu przez pompy ATPazy wapnia przez BBB, umożliwiając bezpośredni kontakt z delikatnymi komórkami w ośrodkowym układzie nerwowym. Neurotoksyczność wynika ze zdolności ołowiu do działania w sposób podobny do jonów wapnia, ponieważ skoncentrowany ołów prowadzi do wychwytu wapnia przez komórki, co zaburza homeostazę komórkową i indukuje apoptozę. To właśnie ten wewnątrzkomórkowy wzrost wapnia aktywuje kinazę białkową C (PKC), co objawia się deficytami uczenia się u dzieci w wyniku wczesnej ekspozycji na ołów. Oprócz indukowania apoptozy, ołów hamuje sygnalizację między neuronami poprzez zakłócenie uwalniania neuroprzekaźników za pośrednictwem wapnia.
Neurotoksyny o wielu efektach
Etanol

, że jako neurotoksyna etanol powoduje uszkodzenie układu nerwowego i wpływa na organizm na różne sposoby. Wśród znanych skutków narażenia na etanol są zarówno przejściowe, jak i trwałe konsekwencje. Niektóre z trwałych efektów obejmują długoterminową zmniejszoną neurogenezę w hipokampie , powszechną atrofię mózgu i indukowany stan zapalny w mózgu. Warto zauważyć, że chroniczne przyjmowanie etanolu dodatkowo indukuje reorganizację składników błony komórkowej, prowadząc do powstania dwuwarstwy lipidowej charakteryzującej się zwiększonym stężeniem błony komórkowej cholesterol i tłuszcze nasycone . Jest to ważne, ponieważ transport neuroprzekaźników może zostać zakłócony poprzez hamowanie transportu pęcherzykowego, co skutkuje zmniejszeniem funkcji sieci neuronowej. Jednym ze znaczących przykładów zmniejszonej komunikacji między neuronami jest zdolność etanolu do hamowania receptorów NMDA w hipokampie, co skutkuje zmniejszonym długotrwałym wzmocnieniem (LTP) i akwizycją pamięci. Wykazano, że NMDA odgrywa ważną rolę w LTP, aw konsekwencji w tworzeniu pamięci. Jednak przy przewlekłym przyjmowaniu etanolu podatność tych receptorów NMDA na indukowanie LTP wzrasta w mezolimbicznych neuronów dopaminowych w sposób zależny od inozytolu 1,4,5-trifosforanu (IP3). Ta reorganizacja może prowadzić do cytotoksyczności neuronalnej zarówno poprzez hiperaktywację neuronów postsynaptycznych, jak i poprzez indukowane uzależnienie od ciągłego spożywania etanolu. Dodatkowo wykazano, że etanol bezpośrednio zmniejsza wewnątrzkomórkową akumulację jonów wapnia poprzez hamowanie aktywności receptora NMDA, a tym samym zmniejsza zdolność do występowania LTP.
Oprócz neurotoksycznego działania etanolu na dojrzałe organizmy, przewlekłe spożywanie może wywołać poważne wady rozwojowe. Dowody po raz pierwszy wykazano w 1973 r. na związek między chronicznym przyjmowaniem etanolu przez matki a wadami u ich potomstwa. Praca ta była odpowiedzialna za stworzenie klasyfikacji płodowego zespołu alkoholowego , choroby charakteryzującej się powszechnymi aberracjami morfogenezy , takimi jak wady budowy twarzoczaszki , rozwoju kończyn i układu sercowo-naczyniowego . Wielkość neurotoksyczności etanolu u płodów Wykazano, że alkoholowy zespół płodowy jest zależny od poziomu przeciwutleniaczy w mózgu, takich jak witamina E. Ponieważ mózg płodu jest stosunkowo delikatny i podatny na indukowane stresy, poważne szkodliwe skutki narażenia na alkohol można zaobserwować w ważnych obszarach, takich jak hipokamp i móżdżek . Nasilenie tych skutków jest bezpośrednio zależne od ilości i częstotliwości spożywania etanolu przez matkę oraz stadium rozwoju płodu. Wiadomo, że ekspozycja na etanol powoduje obniżony poziom przeciwutleniaczy, dysfunkcję mitochondriów (Chu 2007), a następnie śmierć neuronów, najwyraźniej w wyniku zwiększonego wytwarzania reaktywnych form utleniania (ROS). Jest to prawdopodobny mechanizm, ponieważ w mózgu płodu występuje zmniejszona obecność enzymów antyoksydacyjnych, takich jak katalaza i peroksydaza . W celu wsparcia tego mechanizmu, podawanie wysokich poziomów diety witamina E powoduje zmniejszenie lub wyeliminowanie wywołanych etanolem neurotoksycznych skutków u płodów.
n-Heksan
n- Heksan to neurotoksyna, która w ostatnich latach była odpowiedzialna za zatrucie kilku pracowników chińskich fabryk elektroniki.
Neurotoksyny selektywne względem receptora
MPP +
MPP + , toksyczny metabolit MPTP, jest selektywną neurotoksyną, która zakłóca fosforylację oksydacyjną w mitochondriach poprzez hamowanie kompleksu I , co prowadzi do wyczerpania ATP i późniejszej śmierci komórki. Dzieje się tak prawie wyłącznie w neuronach dopaminergicznych istoty czarnej , co skutkuje trwałym parkinsonizmem u narażonych osób 2-3 dni po podaniu.
Endogenne źródła neurotoksyn
W przeciwieństwie do większości powszechnych źródeł neurotoksyn, które są nabywane przez organizm poprzez spożycie, endogenne neurotoksyny zarówno pochodzą z in vivo, jak i wywierają swoje działanie . Ponadto, chociaż większość jadów i egzogennych neurotoksyn rzadko posiada użyteczne właściwości in vivo, endogenne neurotoksyny są powszechnie wykorzystywane przez organizm w użyteczny i zdrowy sposób, tak jak tlenek azotu, który jest używany w komunikacji komórkowej. Często tylko wtedy, gdy te endogenne związki stają się silnie skoncentrowane, prowadzą do niebezpiecznych skutków.
Tlenek azotu
Chociaż tlenek azotu (NO) jest powszechnie wykorzystywany przez układ nerwowy w komunikacji i sygnalizacji między neuronami, może być aktywny w mechanizmach prowadzących do niedokrwienia mózgu (Iadecola 1998). Neurotoksyczność NO opiera się na jego znaczeniu w ekscytotoksyczności glutaminianu, ponieważ NO jest generowany w sposób zależny od wapnia w odpowiedzi na aktywację NMDA za pośrednictwem glutaminianu, która występuje z podwyższoną szybkością w ekscytotoksyczności glutaminianu. Chociaż NO ułatwia zwiększony przepływ krwi do potencjalnie niedokrwiennych obszarów mózgu, jest również zdolny do zwiększania stresu oksydacyjnego , indukując uszkodzenie DNA i apoptozę. Tak więc zwiększona obecność NO w niedokrwionym obszarze OUN może powodować znacznie toksyczne efekty.
glutaminian
Glutaminian , podobnie jak tlenek azotu, jest endogennie wytwarzanym związkiem wykorzystywanym przez neurony do prawidłowego funkcjonowania, występującym w niewielkich stężeniach w istocie szarej OUN. Jednym z najbardziej godnych uwagi zastosowań endogennego glutaminianu jest jego działanie jako pobudzającego neuroprzekaźnika. Jednak skoncentrowany glutaminian staje się toksyczny dla otaczających neuronów. Toksyczność ta może być zarówno wynikiem bezpośredniej śmierci glutaminianu na neurony, jak i wynikiem indukowanego napływu wapnia do neuronów prowadzącego do obrzęku i martwicy. Wykazano wsparcie dla tych mechanizmów odgrywających znaczącą rolę w chorobach i powikłaniach, takich jak Choroba Huntingtona , padaczka i udar .
Zobacz też
Notatki
- Adams, Michael E.; Olivera, Baldomero M. (1994). „Neurotoksyny: przegląd nowej technologii badawczej”. Trendy w neuronaukach . 17 (4): 151–55. doi : 10.1016/0166-2236(94)90092-2 . PMID 7517594 . S2CID 3984106 .
- Arnon, Stephen S.; Schechter, Robert; Inglesby, Thomas V.; Henderson, Donald A.; Bartlett, John G.; Ascher, Michael S.; Eitzen, Edward; Dobra, Anna D.; Hauer, Hieronim; Layton, Marcelle; Lillibridge, Scott; Osterholm, Michael T.; O'Toole, Tara; Parker, Gerald; Perl, Trish M.; Russell, Philip K.; Swerdlow, David L.; Tonat, Kevin (2001). „Toksyna botulinowa jako broń biologiczna”. Dziennik Amerykańskiego Stowarzyszenia Medycznego . 285 (8): 1059–069. doi : 10.1001/jama.285.8.1059 . PMID 11209178 .
- Aschner, M.; Aschner, J. (1990). „Neurotoksyczność rtęci: mechanizmy transportu przez barierę krew-mózg”. Recenzje neuronauki i biobehawioralne . 14 (2): 169–76. doi : 10.1016/s0149-7634(05)80217-9 . PMID 2190116 . S2CID 8777931 .
- Banki, William A .; Kastin, Abba J. (1989). „Neurotoksyczność wywołana aluminium: zmiany w funkcji błony na barierze krew-mózg”. Recenzje neuronauki i biobehawioralne . 13 (1): 47–53. doi : 10.1016/s0149-7634(89)80051-x . PMID 2671833 . S2CID 46507895 .
- Baum-Baicker, Cynthia (1985). „Korzyści zdrowotne wynikające z umiarkowanego spożycia alkoholu: przegląd literatury”. Uzależnienie od narkotyków i alkoholu . 15 (3): 207–27. doi : 10.1016/0376-8716(85)90001-8 . PMID 4028954 .
- Beckman, JS (1990). „Pozorne wytwarzanie rodników hydroksylowych przez nadtlenoazotyn: implikacje dla uszkodzenia śródbłonka przez tlenek azotu i nadtlenek” . Obrady Narodowej Akademii Nauk . 87 (4): 1620–624. Bibcode : 1990PNAS...87.1620B . doi : 10.1073/pnas.87.4.1620 . PMC 53527 . PMID 2154753 .
- Bergamini, Carlo M.; Gambetti, Stefani; Dondi, Alessia; Cervellati, Carlo (2004). „Tlen, reaktywne formy tlenu i uszkodzenia tkanek”. Obecny projekt farmaceutyczny . 10 (14): 1611–626. doi : 10.2174/1381612043384664 . PMID 15134560 .
-
Bernier Brian E., Whitaker Leslie R., Morikawa Hitoshi (2011). „Poprzednie doświadczenie z etanolem zwiększa plastyczność synaptyczną receptorów NMDA w brzusznej części nakrywki” . Journal of Neuroscience . 31 (14): 5305–212. doi : 10.1523/JNEUROSCI.5282-10.2011 . PMC 3086894 . PMID 21471355 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - Bisset, Norman G (1992). „Wojna i polowanie na trucizny Nowego Świata. Część 1. Uwagi dotyczące wczesnej historii kurary”. Journal of Ethnopharmacology . 36 (1): 1–26. doi : 10.1016/0378-8741(92)90056-w . PMID 1501489 .
- Blanco, Ana M.; Valles, Soraya L.; Pascual, Maria; Guerri, Consuelo (2005). „Zaangażowanie sygnalizacji receptora IL-1 TLR4/typu I w indukcję mediatorów stanu zapalnego i śmierć komórek wywołaną przez etanol w hodowanych astrocytach” . The Journal of Immunology . 175 (10): 6893–899. doi : 10.4049/jimmunol.175.10.6893 . PMID 16272348 .
- Bleich, S (2003). „Hiperhomocysteinemia jako nowy czynnik ryzyka kurczenia się mózgu u pacjentów z alkoholizmem”. Listy neurologiczne . 335 (3): 179–82. doi : 10.1016/s0304-3940(02)01194-1 . PMID 12531462 . S2CID 33032529 .
- Bonfoco E (1995). „Apoptoza i martwica: dwa odrębne zdarzenia wywołane odpowiednio łagodnymi i intensywnymi zniewagami za pomocą N-metylo-D-asparaginianu lub tlenku azotu / nadtlenku w kulturach komórek korowych” . Obrady Narodowej Akademii Nauk . 92 (16): 7162–166. Bibcode : 1995PNAS...92.7162B . doi : 10.1073/pnas.92.16.7162 . PMC41299 . _ PMID 7638161 .
- Bradbury, MW; Deane, R (1993). „Przepuszczalność bariery krew-mózg dla ołowiu. [Recenzja]”. Neurotoksykologia . 14 (2–3): 131–6. PMID 8247388 .
- Brender, J.; Suarez, L.; Felkner, M.; Gilani, Z.; Stinchcomb, D.; Moody, K.; Henry, J.; Hendricks, K. (2006). „Narażenie matki na arsen, kadm, ołów i rtęć oraz wady cewy nerwowej u potomstwa”. Badania środowiskowe . 101 (1): 132–39. Bibcode : 2006ER....101..132B . doi : 10.1016/j.envres.2005.08.003 . PMID 16171797 .
- Bressler, J; Kim, KA; Chakraborti, T; Goldstein, G (1999). „Mechanizmy molekularne neurotoksyczności ołowiu. [Recenzja]”. Neurochem Res . 24 (4): 595–600. doi : 10.1023/A:1022596115897 . PMID 10227691 . S2CID 3017703 .
- Brocardo, Patricia S.; Gil-Mohapel, Joana; Christie, Brian R. (2011). „Rola stresu oksydacyjnego w spektrum alkoholowych zaburzeń płodowych”. Recenzje badań mózgu . 67 (1–2): 209–25. doi : 10.1016/j.brainresrev.2011.02.001 . PMID 21315761 . S2CID 1213492 .
- Brookes, N (1988). „Specyficzność i odwracalność hamowania przez HgCl transportu glutaminianu w kulturach astrocytów”. Dziennik neurochemii . 50 (4): 1117–122. doi : 10.1111/j.1471-4159.1988.tb10581.x . PMID 2894409 . S2CID 27522735 .
- Buzańska L.; Zabłocka B.; Dybel, A.; Domańska-Janik, K.; Albrecht, J. (2000). „Opóźniona indukcja apoptozy przez amoniak w komórkach glejaka C6”. Neurochemia Międzynarodowy . 37 (2–3): 287–97. doi : 10.1016/s0197-0186(00)00030-9 . PMID 10812214 . S2CID 33351533 .
- Carmichael WW, Biggs DF, Gorham PR (1975). „Toksykologia i działanie farmakologiczne toksyny Anabaena flos-aquae”. nauka . 187 (4176): 542–544. Bibcode : 1975Sci...187..542C . doi : 10.1126/science.803708 . PMID 803708 .
- Carmichael WW, Gorham PR (1978). „Anatoksyny z klonów Anabaena flos-aquae wyizolowanych z jezior zachodniej Kanady”. Rękawica. Piekielny. Vereina. Limnol . 21 : 285–295.
- Chan, HM (2011) „Rtęć w rybach: zagrożenia dla zdrowia człowieka”. Encyklopedia zdrowia środowiskowego : 697–704.
- Choi, D (1988). „Neurotoksyczność zależna od wapnia: związek z określonymi typami kanałów i rola w uszkodzeniach niedokrwiennych”. Trendy w neuronaukach . 11 (10): 465–69. doi : 10.1016/0166-2236(88)90200-7 . PMID 2469166 . S2CID 36909560 .
- Choi, DW; Rothman SM (1990). „Rola neurotoksyczności glutaminianu w niedotlenieniowo-niedokrwiennej śmierci neuronów”. Roczny przegląd neurologii . 13 (1): 171–82. doi : 10.1146/annurev.neuro.13.1.171 . PMID 1970230 .
- Choi, Dennis W (1987). „Jonowa zależność od neurotoksyczności glutaminianu” . Journal of Neuroscience . 7 (2): 369–79. doi : 10.1523/JNEUROSCI.07-02-00369.1987 . PMC 6568907 . PMID 2880938 .
- Choi, Dennis W.; Maulucci-Gedde, Małgorzata; Kriegstein, Arnold R. (1987). „Neurotoksyczność glutaminianu w hodowli komórek korowych” . Journal of Neuroscience . 7 (2): 357–68. doi : 10.1523/JNEUROSCI.07-02-00357.1987 . PMC 6568898 . PMID 2880937 .
- Chu, Jennifer; Tong, Ming; Monte, Suzanne M. (2007). „Przewlekła ekspozycja na etanol powoduje dysfunkcję mitochondriów i stres oksydacyjny w niedojrzałych neuronach ośrodkowego układu nerwowego”. Acta Neuropatologica . 113 (6): 659–73. doi : 10.1007/s00401-007-0199-4 . PMID 17431646 . S2CID 25418731 .
- Clancy, Barbara; Finlay, Barbara L.; Darlington, Richard B.; Anand, KJS (2007). „Ektrapolacja rozwoju mózgu z gatunków eksperymentalnych na ludzi” . Neurotoksykologia . 28 (5): 931–37. doi : 10.1016/j.neuro.2007.01.014 . PMC 2077812 . PMID 17368774 .
- Costa, Lucio G., Gennaro Giordano i Marina Guizzetti (2011) Neurotoksykologia in vitro: metody i protokoły. Nowy Jork: Humana.
- Coyle, Józef T.; Schwarcz, Robert (1976). „Uszkodzenie neuronów prążkowia kwasem kainowym stanowi model pląsawicy Huntingtona”. Natura . 246 (5574): 244–46. Bibcode : 1976Natur.263..244C . doi : 10.1038/263244a0 . PMID 8731 . S2CID 4271762 .
- Cruz, Lourdes J.; Olivera, Baldomero M. (1987). „Antagoniści kanału wapniowego ω-konotoksyna definiuje nowe miejsce o wysokim powinowactwie”. Journal of Biological Chemistry . 14 (261): 6230–233.
- Davis, S.; Rzeźnik, SP; Morris, R. (1992). „Antagonista receptora NMDA D-2-amino-5fosfonopentanian (D-AP5) upośledza uczenie się przestrzenne i LTP in vivo przy stężeniach wewnątrzmózgowych porównywalnych do tych, które blokują LTP in vitro” . Journal of Neuroscience . 12 (1): 21–34. doi : 10.1523/JNEUROSCI.12-01-00021.1992 . PMC 6575679 . PMID 1345945 .
- Dawson, VL (1991). „Tlenek azotu pośredniczy w neurotoksyczności glutaminianu w pierwotnych kulturach korowych” . Obrady Narodowej Akademii Nauk . 88 (14): 6368–371. Bibcode : 1991PNAS...88.6368D . doi : 10.1073/pnas.88.14.6368 . PMC 52084 . PMID 1648740 .
- Debin, John A., John E. Maggio i Gary R. Strichartz (1993) „Oczyszczanie i charakteryzacja chlorotoksyny, ligandu kanału chlorkowego z jadu skorpiona”. Amerykańskie Towarzystwo Fizjologiczne , s. 361–69.
- DeFuria, Jason; Shea, Thomas B. (2007). „Arsen hamuje transport neurofilamentów i indukuje akumulację perikarylową fosforylowanych neurofilamentów: role JNK i GSK-3β”. Badania mózgu . 1181 : 74–82. doi : 10.1016/j.brainres.2007.04.019 . PMID 17961518 . S2CID 37068398 .
- Defuria, Jason (2006) "Środowiskowa neurotoksyna Arsen upośledza dynamikę neurofilamentów przez nadmierną aktywację kinazy końcowej C-JUN: potencjalna rola w stwardnieniu zanikowym bocznym." UMI , s. 1–16.
- Deng Wenbin, Poretz Ronald D (2003). „Oligodendroglia w neurotoksyczności rozwojowej”. Neurotoksykologia . 24 (2): 161–78. doi : 10.1016/s0161-813x(02)00196-1 . PMID 12606289 .
- Deshane, Jessy; Garner, Craig C.; Sontheimer, Harald (2003). „Chlorotoksyna hamuje inwazję komórek glejaka przez metaloproteinazę macierzy-2” . Journal of Biological Chemistry . 278 (6): 4135–144. doi : 10.1074/jbc.m205662200 . PMID 12454020 .
- Devlin JP, Edwards OE, Gorham PR, Hunter NR, Pike RK, Stavric B (1977). „Anatoksyna-a, toksyczny alkaloid z Anabaena flos-aquae NRC-44h” . Móc. J. Chem . 55 (8): 1367–1371. doi : 10.1139/v77-189 . Zarchiwizowane od oryginału w dniu 2012-07-09.
- Dikranian, K (2001). „Apoptoza w przodomózgowiu ssaków in vivo” . Neurobiologia chorób . 8 (3): 359–79. doi : 10.1006/nbdi.2001.0411 . PMID 11447994 . S2CID 21965033 .
- Dixit A, Dhaked RK, Alam SI, Singh L (2005). „Potencjał militarny biologicznych neurotoksyn”. Recenzje toksyn . 24 (2): 175–207. doi : 10.1081/TXR-200057850 . S2CID 85651107 .
- Dobbs, Michael R (2009) Neurotoksykologia kliniczna. Filadelfia: Saunders-Elsevier.
- Dutertre, S.; Lewis, R. (2006). „Wgląd w toksyny w nikotynowe receptory acetylocholiny”. Farmakologia biochemiczna . 72 (6): 661–70. doi : 10.1016/j.bcp.2006.03.027 . PMID 16716265 .
- Garcia-Rodriguez, C.; Geren, IN; Lou, J.; Konrad F.; Forsyth, C.; Wen, W.; Chakraborti, S.; Zao, H.; Manzanarez, G.; Smith, TJ; Brązowy, J.; Tepp, WH; Liu, N.; Wijesuriya, S.; Tomic, MT; Johnson, EA; Smith, Luizjana; Znaki, JD (2011). „Response Re:„ Neutralizujące ludzkie przeciwciała monoklonalne wiążące wiele serotypów neurotoksyny botulinowej ”Garcia-Rodriguez i in., PEDS, 2011;24:321–331” . Projektowanie i wybór inżynierii białek . 24 (9): 633–34. doi : 10.1093/białko/gzr012 .
- Garthwaite, John; Charles, Sarah L.; Szachy-Williams, Russel (1988). „Uwalnianie czynnika relaksującego pochodzącego z endotelimu po aktywacji receptorów NMDA sugeruje rolę przekaźnika międzykomórkowego w mózgu”. Natura . 336 (24): 385–88. Bibcode : 1988Natur.336..385G . doi : 10.1038/336385a0 . PMID 2904125 . S2CID 4361381 .
- Gartlon, J.; Kinsner, A.; Balprice, A.; Coecke, S.; Clothier, R. (2006). „Ocena proponowanej strategii testów in vitro z wykorzystaniem neuronalnych i nieneuronalnych systemów komórkowych do wykrywania neurotoksyczności”. Toksykologia in vitro . 20 (8): 1569–581. doi : 10.1016/j.tiv.2006.07.009 . PMID 16959468 .
- Gil-Mohapel, Joana; Boehme, Fanny; Kainer, Lea; Christie, Brian R. (2010). „Utrata komórek hipokampu i neurogeneza po ekspozycji płodu na alkohol: spostrzeżenia z różnych modeli gryzoni”. Recenzje badań mózgu . 64 (2): 283–303. doi : 10.1016/j.brainresrev.2010.04.011 . PMID 20471420 . S2CID 10159395 .
- Haghdoost-Jazdi, Haszem; Faraji, Ayda; Fraidouni, Negin; Movahedi, Mohadeseh; Hadibeygi, Elham; Vaezi, Fatemeh (2011). „Znaczące efekty 4-aminopirydyny i tetraetyloamonu w leczeniu choroby Parkinsona wywołanej 6-hydroksydopaminą”. Behawioralne badania mózgu . 223 (1): 70–74. doi : 10.1016/j.bbr.2011.04.021 . PMID 21540059 . S2CID 7100177 .
- Harry, GJ; Billingsley, Melvin; Bruinink, Arendd; Campbell, Iain L.; Classen, Werner; Dorman, David C.; Galli, Corrado; Ray, Dawid; Smith, Robert A.; Tilson, Hugh A. (1998). „Techniki in vitro do oceny neurotoksyczności” . Perspektywy zdrowia środowiskowego . 106 (Dodatek 1): 131–58. doi : 10.2307/3433917 . JSTOR 3433917 . PMC 1533280 . PMID 9539010 .
- Häussinger, Dieter (2006). „Obrzęk mózgu niskiego stopnia i patogeneza encefalopatii wątrobowej w marskości wątroby” . Hepatologia . 43 (6): 1187–190. doi : 10.1002/hep.21235 . PMID 16729329 .
- Hensley, K. (1994). „Model agregacji β-amyloidu i neurotoksyczności oparty na wytwarzaniu wolnych rodników przez peptyd: znaczenie dla choroby Alzheimera” . Obrady Narodowej Akademii Nauk . 91 (8): 3270–274. Bibcode : 1994PNAS...91.3270H . doi : 10.1073/pnas.91.8.3270 . PMC43558 . _ PMID 8159737 .
- Herbert, MR (2006) „Autyzm i genomika środowiskowa”. NeuroToksykologia , s. 671–84. Sieć.
- Hodge, A. Trevor (2002) Rzymskie akwedukty i zaopatrzenie w wodę . Londyn: Duckworth.
- Jak, C (2003). „Zatrucie tetrodotoksyną” . Amerykański Dziennik Medycyny Ratunkowej . 21 (1): 51–54. doi : 10.1053/ajem.2003.50008 . PMID 12563582 .
- Odcień, Bernard; Buckingham, Steven D.; Buckingham, Dawid; Sattelle, David B. (2007). „Działania neurotoksyn węża na cholinergiczną synapsę nikotynową owadów”. Neurobiologia bezkręgowców . 7 (3): 173–78. doi : 10.1007/s10158-007-0053-3 . PMID 17710455 . S2CID 31599093 .
- Iadecola Constantino (1997). „Jasne i ciemne strony tlenku azotu w niedokrwiennym uszkodzeniu mózgu”. Trendy w neuronaukach . 20 (3): 132–39. doi : 10.1016/s0166-2236(96)10074-6 . PMID 9061868 . S2CID 45011034 .
- Jakub, Reed B.; McDougal, Owen M. (2010). „Nadrodzina M konotoksyn: przegląd” . Komórkowe i molekularne nauki przyrodnicze . 67 (1): 17–27. doi : 10.1007/s00018-009-0125-0 . PMC 3741454 . PMID 19705062 .
- Jevtovic-Todorovic, Vesna; Hartman, Richard E.; Izumi, Yukitoshi; Benshoff, Mikołaj D.; Dikranian, Krikor; Zorumski, Charles F.; Olney, John W.; Woźniak, David F. (2003). „Wczesna ekspozycja na powszechne środki znieczulające powoduje powszechną neurodegenerację w rozwijającym się mózgu szczura i trwałe deficyty uczenia się” . Journal of Neuroscience . 23 (3): 876–82. doi : 10.1523/JNEUROSCI.23-03-00876.2003 . PMC 6741934 . PMID 12574416 .
- Jones, K. (1973). „Wzorzec wad rozwojowych u potomstwa matek przewlekle alkoholików”. Lancet . 301 (7815): 1267–271. doi : 10.1016/s0140-6736(73)91291-9 . PMID 4126070 .
- Kiernan, Matthew C.; Isbister, Geoffrey K.; Cindy; Lin, S.-Y.; Burke, Dawid; Bostock, Hugh (2005). „Ostra neurotoksyczność wywołana tetrodotoksyną po spożyciu ryb rozdymkowatych”. Roczniki neurologii . 57 (3): 339–48. doi : 10.1002/ana.20395 . PMID 15732107 . S2CID 40455149 .
- Król, Steven W.; Cząber, John; Wills, Michael R.; Gitelman, HJ (1981). „Biochemia kliniczna aluminium”. Krytyczne recenzje w klinicznych naukach laboratoryjnych . 14 (1): 1–20. doi : 10.3109/10408368109105861 . PMID 7016437 .
- Konopacka, Agnieszka; Konopacki, Filip A.; Albrecht, Jan (2009). „Kinaza białkowa G bierze udział w obrzęku astrocytów wywołanym amoniakiem”. Dziennik neurochemii . 109 : 246–51. doi : 10.1111/j.1471-4159.2009.05802.x . PMID 19393034 . S2CID 42719321 .
- Lafon-Cazal, Mireille; Pietri, Sylwia; Culcasi, Marcel; Bockaert, Joel (1993). „Produkcja nadtlenków i neurotoksyczność zależna od NMDA”. Natura . 364 (6437): 535–37. Bibcode : 1993Natur.364..535L . doi : 10.1038/364535a0 . PMID 7687749 . S2CID 4246917 .
- Lasley, SM; Zielony, MC; Gilbert, ME (1999). „Wpływ okresu ekspozycji na uwalnianie glutaminianu hipokampa i GABA in vivo u szczurów przewlekle narażonych na ołów”. Neurotoksykologia . 20 (4): 619–29. PMID 10499360 .
- Lau, Floryda; Wong, CK; Tak, SH (1995). „Zatrucie ryb rozdymkowatych” . Dziennik medycyny ratunkowej . 12 (3): 214–15. doi : 10.1136/emj.12.3.214 . PMC 1342486 . PMID 8581253 .
- Lewendon, G.; Kinra, S.; Nelder, R.; Cronin, T. (2001). „Czy dzieci z problemami rozwojowymi i behawioralnymi powinny być rutynowo badane pod kątem ołowiu?” . Archives of Disease in Childhood . 85 (4): 286–88. doi : 10.1136/adc.85.4.286 . PMC 1718950 . PMID 11567935 .
- Lidski Teodor I (2003). „Neurotoksyczność ołowiu u dzieci: podstawowe mechanizmy i korelaty kliniczne” . Mózg . 126 (1): 5–19. doi : 10.1093/mózg/awg014 . PMID 12477693 .
- Liu, Kuang-Kai; Chen, Mei-Fang; Chen, Po-Yi; Lee, Tony JF .; Cheng, Chia Liang; Chang, Chia Ching; Ho, Yen-Peng; Jui-I, Chao (2008). „Wiązanie alfa-bungarotoksyny z komórką docelową w rozwijającym się układzie wzrokowym przez karboksylowany nanodiament” . Nanotechnologia . 19 (20): 205102. Bibcode : 2008Nanot..19t5102L . doi : 10.1088/0957-4484/19/20/205102 . PMID 21825732 . S2CID 1260143 .
- Liu, Yuan; McDermott, Suzanne; Lawson, Andrew; Aelion, C. Marjorie (2010). „Związek między upośledzeniem umysłowym a opóźnieniami rozwojowymi u dzieci a poziomami arsenu, rtęci i ołowiu w próbkach gleby pobranych w pobliżu miejsca zamieszkania ich matki w czasie ciąży” . Międzynarodowy Dziennik Higieny i Zdrowia Środowiskowego . 213 (2): 116–23. doi : 10.1016/j.ijheh.2009.12.004 . PMC 2836425 . Identyfikator PMID 20045663 .
- Lorenzo, A. (1994). „Neurotoksyczność β-amyloidu wymaga tworzenia włókienek i jest hamowana przez czerwień Kongo” . Obrady Narodowej Akademii Nauk . 91 (25): 12243–2247. Bibcode : 1994PNAS...9112243L . doi : 10.1073/pnas.91.25.12243 . PMC45413 . _ PMID 7991613 .
- Lotti, Marcello i Angelo Moretto (1989) „Opóźniona polineuropatia wywołana fosforoorganicznymi”. Recenzje toksykologiczne, 24 (1) (2005): 37–49.
- Martinez-Finley, Ebany J.; Goggin, Samantha L.; Labrecque, Matthew T.; Allan, Andrea M. (2011). „Zmniejszona ekspresja genów MAPK / ERK u potomstwa narażonego na działanie arsenu w okresie okołoporodowym, wywołana niedoborami receptora glukokortykoidowego” . Neurotoksykologia i teratologia . 33 (5): 530–37. doi : 10.1016/j.ntt.2011.07.003 . PMC 3183307 . PMID 21784148 .
- Martini, Frederic, Michael J. Timmons i Robert B. Tallitsch (2009) Anatomia człowieka. San Francisco: Pearson/Benjamin Cummings.
- Matsuoka, Masato; Igisu, Hideki; Kohriyama, Kazuaki; Inoue, Naohide (1991). „Tłumienie neurotoksyczności amoniaku przez L-karnitynę”. Badania mózgu . 567 (2): 328–31. doi : 10.1016/0006-8993(91)90814-c . PMID 1817738 . S2CID 10250413 .
- McCleskey, EW (1987). „Omega-konotoksyna: bezpośrednia i trwała blokada określonych typów kanałów wapniowych w neuronach, ale nie w mięśniach” . Obrady Narodowej Akademii Nauk . 84 (12): 4327–331. Bibcode : 1987PNAS...84.4327M . doi : 10.1073/pnas.84.12.4327 . PMC 305078 . PMID 2438698 .
- Meldrum, B.; Garthwaite, J. (1990). „Pobudzająca neurotoksyczność aminokwasów i choroba neurodegeneracyjna”. Trendy w naukach farmaceutycznych . 11 (9): 379–87. doi : 10.1016/0165-6147(90)90184-a . PMID 2238094 .
- Metcalf, James S.; Codd, Geoffrey A. (2009). „Cyjanobakterie, neurotoksyny i zasoby wodne: czy istnieją implikacje dla chorób neurodegeneracyjnych u ludzi?”. Stwardnienie Zanikowe Boczne . 10 : 74–78. doi : 10.3109/17482960903272942 . PMID 19929737 . S2CID 41880444 .
- Mitchell, J. Jean; Paiva, Michael; Barrow Heaton, Marieta (1999). „Przeciwutleniacze, witamina E i β-karoten chronią przed neurotoksycznością wywołaną etanolem w embrionalnych hodowlach hipokampa szczura”. Alkohol . 17 (2): 163–68. doi : 10.1016/s0741-8329(98)00051-2 . PMID 10064385 .
- Moore RE (1977). „Toksyny z niebiesko-zielonych alg”. Bionauka . 27 (12): 797–802. doi : 10.2307/1297756 . JSTOR 1297756 .
- Montecucco C (1986). „Jak toksyny tężcowe i botulinowe wiążą się z błonami neuronalnymi?”. Trendy w naukach biochemicznych . 11 (8): 314–17. doi : 10.1016/0968-0004(86)90282-3 .
- Morris, Stephanie A., David W. Eaves, Aleksander R. Smith i Kimberly Nixon (2009) „Alkoholowe hamowanie neurogenezy: mechanizm neurodegeneracji hipokampa w modelu nadużywania alkoholu przez młodzież”. Hipokamp: nie dotyczy.
- Nadlera; Victor, J.; Perry, Bruce W.; Cotman, Carl W. (1978). „Dokomorowy kwas kainowy preferencyjnie niszczy komórki piramidalne hipokampa”. Natura . 271 (5646): 676–77. Bibcode : 1978Natur.271..676N . doi : 10.1038/271676a0 . PMID 625338 . S2CID 4267990 .
- Narodowe Centrum Oceny Środowiskowej (2006) „Przeglądy toksykologiczne toksyn sinicowych: Anatoksyna-a” NCEA-C-1743
- Norenberg, MD; Rao, KV Rama; Jayakumar, AR (2004). „Neurotoksyczność amoniaku i przejście przepuszczalności mitochondriów”. Journal of Bioenergetics and Biomembranes . 36 (4): 303–07. doi : 10.1023/b:jobb.0000041758.20071.19 . PMID 15377862 . S2CID 39221153 .
- Olivera, Baldomero M.; Cruz, Lourdes J.; De Santos, Wiktoria; LeCheminant, Garth; Gryf, Dawid; Zeikus, Regina; McIntosh, J. Michael; Galyean, Robert; Varga, Janos (1987). „Neuronalni antagoniści kanału wapniowego. Rozróżnianie podtypów kanału wapniowego przy użyciu .omega.-konotoksyny z jadu Conus Magus”. Biochemia . 26 (8): 2086–090. doi : 10.1021/bi00382a004 . PMID 2441741 .
- Olney, John W (2002). „Nowe spostrzeżenia i nowe problemy w neurotoksykologii rozwojowej”. Neurotoksykologia . 23 (6): 659–68. doi : 10.1016/s0161-813x(01)00092-4 . PMID 12520755 .
- Pirazzini, Marco, Ornella Rossetto, Paolo Bolognese, Clifford C. Shone i Cesare Montecucco (2011) „Podwójne zakotwiczenie do błony i nienaruszone międzyłańcuchowe wiązanie dwusiarczkowe są wymagane do wejścia neurotoksyn tężcowych i botulinowych do neuronów wywołanych niskim PH. " Mikrobiologia komórkowa: Nie. Drukuj.
- Rabe, Ausma; He Lee, Księżyc; Szek, Judy; Wiśniewski, Henryk M. (1982). „Deficyt uczenia się u niedojrzałych królików ze zmianami neurofibrylarnymi wywołanymi aluminium”. Neurologia Eksperymentalna . 76 (2): 441–46. doi : 10.1016/0014-4886(82)90220-5 . PMID 6896495 . S2CID 7495252 .
- Rocha, RA; Gimeno-Alcaniz, JV; Martín-Ibanez, Raymond; Kanały, JM; Vélez, D.; Devesa, V. (2011). „Arszenik i fluorek indukują apoptozę neuronalnych komórek progenitorowych”. Listy toksykologiczne . 203 (3): 237–44. doi : 10.1016/j.toxlet.2011.03.023 . PMID 21439358 .
- Roed, A (1989). „Wpływ tetraetyloamoniaku podczas stymulacji skurczowej i tężcowej przygotowania przepony nerwu przeponowego u szczura”. Neurofarmakologia . 28 (6): 585–92. doi : 10.1016/0028-3908(89)90137-8 . PMID 2547180 . S2CID 1916154 .
- Rothman, S.; Thurston, J.; Hauhart, R. (1987). „Opóźniona neurotoksyczność pobudzających aminokwasów in vitro”. Neuronauka . 22 (2): 471–80. doi : 10.1016/0306-4522(87)90347-2 . PMID 3670595 . S2CID 6038419 .
- Schlesinger, Edward B. (1946). „Kurara Przegląd jego efektów terapeutycznych i ich podstaw fizjologicznych”. Amerykański Dziennik Medycyny . 1 (5): 518–30. doi : 10.1016/0002-9343(46)90073-3 . PMID 21001466 .
- Siebler, M.; Koller, H.; Schmalenbach, C.; Muller, H. (1988). „Prądy chlorku aktywowanego GABA w hodowanych neuronach hipokampa szczura i regionu przegrody mogą być hamowane przez kurarę i atropinę”. Listy neurologiczne . 93 (2–3): 220–24. doi : 10.1016/0304-3940(88)90085-7 . PMID 2468110 . S2CID 10645685 .
- Simpson, LL (1986). „Farmakologia molekularna toksyny botulinowej i toksyny tężcowej”. Roczny przegląd farmakologii i toksykologii . 26 (1): 427–53. doi : 10.1146/annurev.pharmtox.26.1.427 . PMID 3521461 .
- Soroceanu, Liliana; Gillespie, Yancey; Khazaeli, MB; Sontheimer, Harold (1998). „Zastosowanie chlorotoksyny do celowania w pierwotne guzy mózgu”. Badania nad rakiem . 58 (21): 4871–879. PMID 9809993 .
- Spencer PS, Schaumburg HH, Ludolph AC (red.) (2000) Experimental and Clinical Neurotoxicology. Oxford University Press, Oxford, s. 1310.
- Stanfield, Peter R. (1983). „Jony tetraetyloamoniowe i przepuszczalność potasu komórek pobudliwych”. Recenzje fizjologii, biochemii i farmakologii . 97 : 1–49. doi : 10.1007/bfb0035345 . ISBN 978-3-540-11701-8 . PMID 6306751 .
- Stewart I, Seawright AA, Shaw GR (2008). „Zatrucie sinicami u zwierząt gospodarskich, dzikich ssaków i ptaków - przegląd” (PDF) . Cyjanobakteryjne szkodliwe zakwity alg: stan nauki i potrzeby badawcze . Postępy w medycynie eksperymentalnej i biologii . 619 : 613–637. doi : 10.1007/978-0-387-75865-7_28 . ISBN 978-0-387-75864-0 . PMID 18461786 .
- Taffe, MA; Kotzebue, RW; Crean, RD; Crawford, EF; Edwards, S.; Mandyam, CD (2010). „Z okładki: długotrwała redukcja neurogenezy hipokampa przez spożycie alkoholu u nastoletnich naczelnych” . Obrady Narodowej Akademii Nauk . 107 (24): 11104–1109. Bibcode : 2010PNAS..10711104T . doi : 10.1073/pnas.0912810107 . PMC 2890755 . Identyfikator PMID 20534463 .
- Takadera, Tsuneo; Suzuki, Risa; Mohri, Tetsuro (1990). „Ochrona neuronów korowych przez etanol przed neurotoksycznością wywołaną przez N-metylo-d-asparaginian jest związana z blokowaniem napływu wapnia”. Badania mózgu . 537 (1–2): 109–14. doi : 10.1016/0006-8993(90)90346-d . PMID 1982237 . S2CID 22160700 .
- Thyagarajan, B.; Krywicka, N.; Potian, JG; Hognason, K.; Garcia, CC; McArdle, JJ (2009). „Kapsaicyna chroni połączenia nerwowo-mięśniowe myszy przed neuroparalitycznym działaniem neurotoksyny botulinowej A”. Journal of Pharmacology and Experimental Therapeutics . 331 (2): 361–71. doi : 10.1124/jpet.109.156901 . PMC 2775269 . PMID 19654265 .
- Tymianski, Michał; Charlton, Milton P.; Carlen, Peter L.; Tator, Charles H. (2003). „Specyficzność źródła wczesnej neurotoksyczności wapnia w hodowanych embrionalnych neuronach rdzeniowych” . Journal of Neuroscience . 13 (5): 2095–104. doi : 10.1523/JNEUROSCI.13-05-02085.1993 . PMC 6576557 . PMID 8097530 .
- Cetlin, VI; Hucho, F. (2004). „Toksyny węży i ślimaków działające na nikotynowe receptory acetylocholiny: podstawowe aspekty i zastosowania medyczne” . Listy FEBS . 557 (1–3): 9–13. doi : 10.1016/s0014-5793(03)01454-6 . PMID 14741333 .
- USEPA (Agencja Ochrony Środowiska Stanów Zjednoczonych) (1998) Wytyczne dotyczące badań wpływu na zdrowie. OPPTS 870.6200. Bateria do badania neurotoksyczności. Waszyngton DC, USEPA.
- Vahidnia, A., GB Van Der Voet i FA De Wolff (2007) „Przegląd neurotoksyczności arsenu”. Toksykologia ludzka i eksperymentalna, 26 (10): 823–32.
- Walton, J. (2006). „Aluminium w neuronach hipokampa u ludzi z chorobą Alzheimera”. Neurotoksykologia . 27 (3): 385–94. doi : 10.1016/j.neuro.2005.11.007 . PMID 16458972 .
- Widmaier, Eric P., Hershel Raff, Kevin T. Strang i Arthur J. Vander (2008) Vander's Human Physiology: the Mechanisms of Body Function. Boston: Szkolnictwo wyższe McGraw-Hill.
- Williamson, Lura C.; Halpern, Jane L.; Montecucco, Cesare; Brązowy, JE; Neale, Elaine A. (1996). „Neurotoksyny Clostridium i proteoliza substratu w nienaruszonych neuronach” . Journal of Biological Chemistry . 271 (13): 7694–699. doi : 10.1074/jbc.271.13.7694 . PMID 8631808 .
- Drewno SA; Rasmussen JP; Holandia PT; Campbell R.; Crowe ALM (2007). „Pierwszy raport o cyjanotoksynie Anatoxin-A z Aphanizomenon issatschenkoi (sinice)” . Dziennik Fykologii . 43 (2): 356–365. doi : 10.1111/j.1529-8817.2007.00318.x . S2CID 84284928 .
- Yamada, Kiyofumi; Tanaka, Tomoko; Han, Daiken; Senzaki, Kouji; Kameyama, Tsutomu; Nabeshima, Toshitaka (1999). „Ochronne działanie idebenonu i α-tokoferolu na deficyty uczenia się i pamięci wywołane przez β-amyloid (1–42) u szczurów: wpływ stresu oksydacyjnego na neurotoksyczność indukowaną β-amyloidem in vivo” . Europejski Dziennik Neurologii . 11 (1): 83–90. doi : 10.1046/j.1460-9568.1999.00408.x . PMID 9987013 . S2CID 84408095 .
- Jan; Du, Shi; Chen, Xi; Fu, Jin; Chen, Ming; Zhu, Huaijie; Roher, Alex; Slattery, Tymoteusz; Zhao, Lei; Nagashima, Mariko; Morser, Jan; Migheli, Antonio; Nawrot, Piotr; Stern, Dawid; Marie Schmidt, Ann (1996). „RAGE i neurotoksyczność peptydu amyloidu-β w chorobie Alzheimera”. Natura . 382 (6593): 685–91. Bibcode : 1996Natur.382..685Y . doi : 10.1038/382685a0 . PMID 8751438 . S2CID 4372023 .
- Yang, X (2007) Występowanie neurotoksyny cyjanobakteryjnej, anatoksyny-a, w wodach stanu Nowy Jork ProQuest. ISBN 978-0-549-35451-2 .
- Zhang, J.; Dawson, V.; Dawson, T.; Snyder, S. (1994). „Aktywacja tlenku azotu syntetazy poli (ADP-rybozy) w neurotoksyczności”. nauka . 263 (5147): 687–89. Bibcode : 1994Sci...263..687Z . doi : 10.1126/science.8080500 . PMID 8080500 .
Dalsza lektura
- Książka Fakty o mózgu w The Society for Neuroscience
- Neuroscience Texts na University of Texas Medical School
- Neurotoksykologia in vitro: wprowadzenie w Springerlink
- Biologia receptora NMDA w NCBI
- Postępy w neurologii uzależnień, wydanie 2 w NCBI
Linki zewnętrzne
- Agencja Ochrony Środowiska w Agencji Ochrony Środowiska Stanów Zjednoczonych
- Alkohol i alkoholizm w Oxford Medical Journals
- Neurotoksykologia w Elsevier Journals
- Instytut Neurotoksyn w Instytucie Neurotoksyn
- [1] Neurotoksyny] w Toxipedia