Alkaloid

Alkaloidy to klasa zasadowych , naturalnie występujących związków organicznych , które zawierają co najmniej jeden atom azotu . Ta grupa obejmuje również niektóre pokrewne związki o właściwościach obojętnych, a nawet słabo kwaśnych . Niektóre syntetyczne związki o podobnej budowie można również nazwać alkaloidami. Oprócz węgla , wodoru i azotu alkaloidy mogą również zawierać tlen , siarkę i rzadziej inne pierwiastki, takie jak chlor , brom i fosfor .
Alkaloidy są wytwarzane przez wiele różnych organizmów, w tym bakterie , grzyby , rośliny i zwierzęta . Można je oczyścić z surowych ekstraktów tych organizmów przez ekstrakcję kwasowo-zasadową lub ekstrakcję rozpuszczalnikami, a następnie chromatografię kolumnową na żelu krzemionkowym . Alkaloidy mają szeroki zakres działań farmakologicznych , w tym przeciwmalaryczne ( np. chinina ), przeciwastmatyczne ( np. efedryna ), przeciwnowotworowe ( np . homoharringtonina ) , cholinomimetyczne ( np. galantamina ), rozszerzające naczynia krwionośne ( np. winkamina ), antyarytmiczne ( np. chinidyna ), przeciwbólowe ( np. morfina ) , przeciwbakteryjne ( np. chelerytryna ) i przeciwhiperglikemiczne ( np. piperyna ). [ nieudana weryfikacja ] Wiele z nich znalazło zastosowanie w tradycyjnej lub nowoczesnej medycynie lub jako punkt wyjścia do odkrywania leków . Inne alkaloidy wykazują działanie psychotropowe ( np. psylocyna ) i pobudzające ( np. kokaina , kofeina , nikotyna , teobromina ) i były używane w rytuałach enteogennych lub jako narkotyki rekreacyjne . Alkaloidy też mogą być toksyczne ( np. atropina , tubokuraryna ). Chociaż alkaloidy działają na różnorodne układy metaboliczne u ludzi i innych zwierząt, prawie jednolicie wywołują gorzki smak .
Granica między alkaloidami a innymi naturalnymi związkami zawierającymi azot nie jest wyraźna. Związki takie jak peptydy aminokwasowe , białka , nukleotydy , kwasy nukleinowe , aminy i antybiotyki zwykle nie są nazywane alkaloidami. Naturalne związki zawierające azot w egzocyklicznej ( meskalina , serotonina , dopamina itp.) są zazwyczaj klasyfikowane jako aminy , a nie jako alkaloidy. Jednak niektórzy autorzy uważają alkaloidy za szczególny przypadek amin.
Nazewnictwo
Nazwa „alkaloidy” ( niem . Alkaloide ) została wprowadzona w 1819 r. Przez niemieckiego chemika Carla Friedricha Wilhelma Meißnera i wywodzi się od późnołacińskiego korzenia zasady i greckiego przyrostka -οειδής - („podobny”). Jednak termin ten wszedł do szerokiego użytku dopiero po opublikowaniu artykułu przeglądowego Oscara Jacobsena w słowniku chemicznym Alberta Ladenburga w latach osiemdziesiątych XIX wieku.
Nie ma unikalnej metody nazywania alkaloidów. Wiele nazw indywidualnych jest tworzonych przez dodanie przyrostka „ine” do nazwy gatunku lub rodzaju. Na przykład atropina jest izolowana z rośliny Atropa belladonna ; strychnina pozyskiwana jest z nasion drzewa strychniny ( Strychnos nux-vomica L.). Tam, gdzie z jednej rośliny ekstrahuje się kilka alkaloidów, ich nazwy są często rozróżniane na podstawie odmian sufiksu: „idyna”, „anina”, „alina”, „inina” itp. Istnieje również co najmniej 86 alkaloidów, których nazwy zawierają korzeń „vin "ponieważ są pozyskiwane z Vinca , takich jak Vinca rosea ( Charanthus roseus ); są to tak zwane alkaloidy barwinka .
Historia

Rośliny zawierające alkaloidy były wykorzystywane przez ludzi od czasów starożytnych do celów terapeutycznych i rekreacyjnych. Na przykład rośliny lecznicze były znane w Mezopotamii od około 2000 roku pne. Odyseja Homera odnosiła się do daru podarowanego Helenie przez królową egipską, narkotyku przynoszącego zapomnienie . Uważa się, że prezent był narkotykiem zawierającym opium. Chińska książka o roślinach doniczkowych napisana w I – III wieku pne wspomina o medycznym zastosowaniu efedryny i maku lekarskiego . Również koki były używane przez rdzennych mieszkańców Ameryki Południowej od czasów starożytnych.
Wyciągi z roślin zawierające toksyczne alkaloidy, takie jak akonityna i tubokuraryna , były używane od starożytności do zatruwania strzał.
Badania alkaloidów rozpoczęto w XIX wieku. W 1804 roku niemiecki chemik Friedrich Sertürner wyizolował z opium „zasadę nasenną” (łac. principium somniferum ), którą nazwał „morfium”, odnosząc się do Morfeusza , greckiego boga snów; w języku niemieckim i niektórych innych językach środkowoeuropejskich nadal jest to nazwa leku. Termin „morfina”, używany w języku angielskim i francuskim, został nadany przez francuskiego fizyka Josepha Louisa Gay-Lussaca .
Znaczący wkład w chemię alkaloidów we wczesnych latach jej rozwoju wnieśli francuscy badacze Pierre Joseph Pelletier i Joseph Bienaimé Caventou , którzy odkryli chininę (1820) i strychninę (1818). W tym czasie odkryto kilka innych alkaloidów, w tym ksantynę (1817), atropinę (1819), kofeinę (1820), koniinę (1827), nikotynę (1828), kolchicynę (1833), sparteinę (1851) i kokainę (1860). . Rozwój chemii alkaloidów przyspieszyło pojawienie się spektroskopowych i chromatograficznych w XX wieku, tak że do 2008 roku zidentyfikowano ponad 12 000 alkaloidów.
Pierwszej pełnej syntezy alkaloidu dokonał w 1886 roku niemiecki chemik Albert Ladenburg . Wytworzył koniinę w reakcji 2-metylopirydyny z aldehydem octowym i redukcji powstałej 2-propenylopirydyny sodem.

Klasyfikacje
W porównaniu z większością innych klas związków naturalnych, alkaloidy charakteryzują się dużą różnorodnością strukturalną. Nie ma jednolitej klasyfikacji. Początkowo, gdy brakowało wiedzy o budowie chemicznej, opierano się na klasyfikacji botanicznej roślin źródłowych. Ta klasyfikacja jest obecnie uważana za przestarzałą.
Nowsze klasyfikacje opierają się na podobieństwie szkieletu węglowego ( np . indolo- , izochinolino- i pirydynopodobnego ) lub prekursora biochemicznego ( ornityna , lizyna , tyrozyna , tryptofan itp.). Wymagają jednak kompromisów w przypadkach granicznych; na przykład nikotyna zawiera fragment pirydyny z nikotynamidu i część pirolidyny z ornityny, a zatem można ją przypisać do obu klas.
Alkaloidy są często podzielone na następujące główne grupy:
- „Prawdziwe alkaloidy” zawierają azot w heterocyklu i pochodzą z aminokwasów . Ich charakterystycznymi przykładami są atropina , nikotyna i morfina . Do tej grupy należą również niektóre alkaloidy, które poza heterocyklem azotowym zawierają terpen ( np . evonina) lub fragmenty peptydowe ( np. ergotamina ). Alkaloidy piperydynowe, koniina i koniceina, można uznać za prawdziwe alkaloidy (a nie pseudoalkaloidy: patrz poniżej), chociaż nie pochodzą one z aminokwasów.
- „Protoalkaloidy”, które zawierają azot (ale nie heterocykl azotowy) i również pochodzą z aminokwasów. Przykłady obejmują meskalinę , adrenalinę i efedrynę .
- Alkaloidy poliaminowe – pochodne putrescyny , spermidyny i sperminy .
- Alkaloidy peptydowe i cyklopeptydowe.
- Pseudoalkaloidy – związki podobne do alkaloidów, które nie pochodzą z aminokwasów. Do tej grupy należą terpenowe i steroidopodobne , a także alkaloidy purynowe , takie jak kofeina , teobromina , teakryna i teofilina . Niektórzy autorzy zaliczają do pseudoalkaloidów takie związki jak efedryna i katynon . Te pochodzą z aminokwasu fenyloalaniny , ale pozyskują swój atom azotu nie z aminokwasu, ale poprzez transaminację .
Niektóre alkaloidy nie mają szkieletu węglowego charakterystycznego dla ich grupy. Tak więc galantamina i homoaporfiny nie zawierają fragmentu izochinoliny , ale generalnie są przypisywane alkaloidom izochinolinowym.
Główne klasy alkaloidów monomerycznych wymieniono w poniższej tabeli:
| Klasa | Główne grupy | Główne etapy syntezy | Przykłady |
|---|---|---|---|
| Alkaloidy z heterocyklami azotu (prawdziwe alkaloidy) | |||
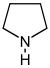
| Pochodne pirolidyny | ornityna lub arginina → putrescyna → N-metyloputrescyna → N-metylo-Δ 1 -pirolina | Cuscohygrine , hygrine , higroline, stachhydrine | |
| Pochodne tropanu |
Grupa atropinowa Podstawienie w pozycjach 3, 6 lub 7 |
ornityna lub arginina → putrescyna → N-metyloputrescyna → N-metylo-Δ 1 -pirolina | Atropina , skopolamina , hioscyjamina |
|
Grupa kokainowa Podstawienie w pozycjach 2 i 3 |
Kokaina , ekgonina | ||
| Pochodne pirolizydyny | Nieestry | U roślin: ornityna lub arginina → putrescyna → homospermidyna → retronecyna | Retronecyna , heliotrydyna, laburnina |
| Złożone estry kwasów monokarboksylowych | Indycyna, lindelofina, sarracyna | ||
| Diestry makrocykliczne | Platyfilina, trichodesmina | ||
| 1-aminopirolizydyny ( loliny ) | U grzybów : L -prolina + L -homoseryna → N- (3-amino-3-karboksypropylo)prolina → norlolina | Lolina, N -formylolina, N -acetylolina | |
| Pochodne piperydyny | Lizyna → kadaweryna → Δ 1 -piperydyna | Sedamina, lobelina, anaferyna, piperyna | |
| Kwas oktanowy → koniceina → koniina | Konina , konecja | ||
| Pochodne chinolizydyny | Grupa Lupinina | Lizyna → kadaweryna → Δ 1 -piperydyna | łubin , nufarydyna |
| grupa cytyzynowa | Cytyzyna | ||
| grupa spartańska | sparteina , lupanina, anahigryna | ||
| Grupa Matryna . | Matryna, oksymatryna, allomatrydyna | ||
| Grupa Ormosaniny | ormosanina, pipetantyna | ||
| Pochodne indolizydyny | Lizyna → δ-semialdehyd kwasu α-aminoadypinowego → kwas pipekolowy → 1 indolizydynon | Swainsonina , kastanospermina | |
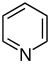
| Pochodne pirydyny | Proste pochodne pirydyny | Kwas nikotynowy → kwas dihydronikotynowy → 1,2-dihydropirydyna | Trygonelina , rycynina , arekolina |
| Wielopierścieniowe niekondensujące pochodne pirydyny | Nikotyna , nornikotyna , anabazyna , anatabina | ||
| Wielopierścieniowe skondensowane pochodne pirydyny | aktynidyna , gentianina , pedikulina | ||
| Seskwiterpenowe pochodne pirydyny | kwas nikotynowy , izoleucyna | Evonine, hipokrateina, tryptonina | |
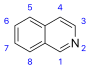
| izochinoliny i pokrewne alkaloidy | Proste pochodne izochinoliny | Tyrozyna lub fenyloalanina → dopamina lub tyramina (dla alkaloidów Amarillis) | Salsolina , Lofoceryna |
| Pochodne 1- i 3-izochinolin | N-metylokorydaldyna, noroksyhydrastynina | ||
| Pochodne 1- i 4-fenylotetrahydroizochinoliny | Kryptostylina | ||
| Pochodne 5-naftil-izochinoliny | Ancistrokladyna | ||
| Pochodne 1- i 2-benzylo-izochinolin | Papaweryna , Laudanozyna , Sendaweryna | ||
| Grupa Kulinarna | Cularine, Jagonina | ||
| Pawiny i izopawiny | argemonina, amurenzyna | ||
| Benzopirokoliny | Kryptaustolina | ||
| Protoberberyny | Berberyna , kanadyna , ofiokarpina, mekambrydyna, korydalina | ||
| Ftalidisochinoliny | Hydrastyna , narkotyna (Noscapine) | ||
| Spirobenzyloizochinoliny | Fumarycyna | ||
| Alkaloidy Ipecacuanha | Emetyna, protoemetyna, ipekozyd | ||
| Benzofenantrydyny | Sanguinaryna, oksynitydyna, korynoloksina | ||
| Aporfiny | Glaucyna , korydyna, liriodenina | ||
| Proaporfiny | Pronucyferyna, glaziowina | ||
| Homoaporfiny | Kreysiginina, multifloramina | ||
| Homoproaporfiny | Bulbokodyna | ||
| Morfiny | Morfina , kodeina , tebaina , sinomenina | ||
| homomorfiny | Kreysiginina, androcymbina | ||
| Tropoloizochinoliny | Imerubryna | ||
| Azofluoranteny | Rufescyna, imelutyna | ||
| Alkaloidy amarylisowe | Likoryna , ambelina, tazetyna, galantamina , montanina | ||
| Alkaloidy erytryny | Erysodyna, erytroidyna | ||
| Pochodne fenantrenu | aterosperminina | ||
| Protopiny | Protopina , oksomuramina, korykawidyna | ||
| Arystolaktam | Doriflawina | ||
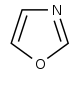
| Pochodne oksazolu | Tyrozyna → tyramina | Annulolina, halfordinol, texaline, texamine | |
| Pochodne izoksazolu | Kwas ibotenowy → Muscymol | kwas ibotenowy, muscymol | |
| Pochodne tiazolu | 5-fosforan 1-deoksy-D-ksylulozy (DOXP), tyrozyna , cysteina | Nostocyklamid, tiostrepton | |
| Pochodne chinazoliny | Pochodne 3,4-dihydro-4-chinazolonu | Kwas antranilowy lub fenyloalanina lub ornityna | febryfugina |
| Pochodne 1,4-dihydro-4-chinazolonu | Glikoryna, arboryna, glikozamina | ||
| Pochodne pirolidyny i piperydyny chinazoliny | Wazycyna (peganina) | ||
| Pochodne akrydyny | Kwas antranilowy | Rutakrydon, akronicyna | |
| Pochodne chinoliny | Proste pochodne chinolinowych pochodnych 2–chinolonów i 4-chinolonów | Kwas antranilowy → 3-karboksychinolina | Kusparyna, echinopsyna, ewokarpina |
| Trójcykliczne terpenoidy | Flindersine | ||
| Pochodne furanochinoliny | Dictamnine, fagarine, skimianine | ||
| chininy | Tryptofan → tryptamina → strictosidine (z sekologaniną ) → korinanteal → cinhoninon | Chinina , chinidyna , cynchonina , cynhonidyna | |
| Pochodne indolu | Nieizoprenowe alkaloidy indolowe | ||
| Proste pochodne indolu | Tryptofan → tryptamina lub 5-hydroksytryptofan | Serotonina , psylocybina , dimetylotryptamina (DMT), bufotenina | |
| Proste pochodne β-karboliny | Harman, harmina , harmalina , eleagnina | ||
| Alkaloidy piroloindolowe | Fizostygmina (eseryna), eteramina, fizowenina, eptastygmina | ||
| Półterpenoidowe alkaloidy indolowe | |||
| Alkaloidy sporyszu | Tryptofan → chanoklawina → agroklawina → elimoklawina → kwas paspalowy → kwas lizergowy | Ergotamina , ergobazyna, ergozyna | |
| Alkaloidy indolowe monoterpenoidowe | |||
| Alkaloidy typu Corynanthe | Tryptofan → tryptamina → strictozydyna (z sekologaniną ) | Ajmalicine, sarpagina, vobasine, ajmaline , johimbina , rezerpina , mitragynina , grupa strychnina i ( Strychnine brucine , aquamycine, vomicine) | |
| Alkaloidy typu Iboga | Ibogamina , ibogaina , woakangina | ||
| Alkaloidy typu Aspidosperma | Winkamina , alkaloidy barwinka , winkotyna, aspidospermina | ||
| Pochodne imidazolu | Bezpośrednio z histydyny | Histamina , pilokarpina, pilozyna, stevensyna | |
| Pochodne purynowe | Ksantozyna (powstała w biosyntezie puryn) → 7 metyloksantozyna → 7-metyloksantyna → teobromina → kofeina | Kofeina , teobromina , teofilina , saksytoksyna | |
| Alkaloidy z azotem w łańcuchu bocznym (protoalkaloidy) | |||
| Pochodne β- fenyloetyloaminy | tyrozyna lub fenyloalanina → dioksyfenilalanina → dopamina → adrenalina i meskalina tyrozyna → tyramina fenyloalanina → 1-fenylopropano-1,2-dion → katynon → efedryna i pseudoefedryna | Tyramina , efedryna , pseudoefedryna , meskalina , katynon , katecholaminy ( adrenalina , noradrenalina , dopamina ) | |
| Alkaloidy kolchicyny | Tyrozyna lub fenyloalanina → dopamina → jesień alina → kolchicyna | Kolchicyna , kolchamina | |
| muskaryna | Kwas glutaminowy → kwas 3-ketoglutaminowy → muskaryna (z kwasem pirogronowym ) | Muskaryna , allomukaryn, epimuskaryna, epiallomuskaryna | |
| benzyloamina | Fenyloalanina z waliną , leucyną lub izoleucyną | kapsaicyna , dihydrokapsaicyna , nordihydrokapsaicyna, wanililoamina | |
| Alkaloidy poliaminowe | |||
| Pochodne putrescyny | ornityna → putrescyna → spermidyna → spermina | Paucyna | |
| Pochodne spermidyny | Lunarine, kodonokarpina | ||
| Pochodne spermy | Werbascenina, afelandryna | ||
| Alkaloidy peptydowe (cyklopeptydowe). | |||
| Alkaloidy peptydowe o cyklu 13-członowym | Typ nummularny C | Z różnych aminokwasów | Nummularine C, Nummularine S |
| typu ziziphine | Ziziphine A, sativanine H | ||
| Alkaloidy peptydowe o cyklu 14-członowym | Typ frangulanowy | Frangulanine, scutianine J | |
| Skucjanina typu A | Skucjanina A | ||
| Typ całkowity | Całkowite, dyskarynowe D | ||
| Amfibia typu F | Amfibina F, spinanina A | ||
| Amfibina typu B | Amfibina B, Lotyzyna C | ||
| Alkaloidy peptydowe o 15-członowym cyklu | Mukronina typu A | Mukronina A | |
| Pseudoalkaloidy ( terpeny i steroidy ) | |||
| diterpeny | Rodzaj likoktoniny | Kwas mewalonowy → pirofosforan izopentenylu → pirofosforan geranylu | Akonityna , delfinina |
| Alkaloidy steroidowe | Cholesterol , arginina | Solanidyna , cyklopamina , batrachotoksyna | |
Nieruchomości

Większość alkaloidów zawiera tlen w swojej strukturze molekularnej; związki te są zwykle bezbarwnymi kryształami w warunkach otoczenia. Beztlenowe alkaloidy, takie jak nikotyna lub koniina , są zazwyczaj lotnymi, bezbarwnymi, oleistymi cieczami. Niektóre alkaloidy są kolorowe, jak berberyna (żółty) i sangwinaryna (pomarańczowy).
Większość alkaloidów to słabe zasady, ale niektóre, takie jak teobromina i teofilina , są amfoteryczne . Wiele alkaloidów słabo rozpuszcza się w wodzie, ale łatwo rozpuszcza się w rozpuszczalnikach organicznych , takich jak eter dietylowy , chloroform lub 1,2-dichloroetan . Kofeina , kokaina , kodeina i nikotyna są słabo rozpuszczalne w wodzie (o rozpuszczalności ≥1 g/l), podczas gdy inne, w tym morfina i johimbina , są bardzo słabo rozpuszczalne w wodzie (0,1–1 g/l). Alkaloidy i kwasy tworzą sole o różnej mocy. Sole te są zwykle dobrze rozpuszczalne w wodzie i etanolu oraz słabo rozpuszczalne w większości rozpuszczalników organicznych. Wyjątki obejmują skopolaminy , który jest rozpuszczalny w rozpuszczalnikach organicznych oraz rozpuszczalny w wodzie siarczan chininy.
Większość alkaloidów ma gorzki smak lub jest trująca po spożyciu. Wydaje się, że produkcja alkaloidów w roślinach ewoluowała w odpowiedzi na żerowanie zwierząt roślinożernych; jednak niektóre zwierzęta rozwinęły zdolność detoksykacji alkaloidów. Niektóre alkaloidy mogą powodować wady rozwojowe u potomstwa zwierząt, które spożywają alkaloidy, ale nie mogą ich odtruwać. Jednym z przykładów jest alkaloid cyklopamina , wytwarzany w liściach lilii kukurydzianej . W latach pięćdziesiątych do 25% jagniąt urodzonych przez owce wypasane na lilii kukurydzianej miało poważne deformacje twarzy. Obejmowały one od zdeformowanych szczęk do cyklopii (patrz zdjęcie). Po dziesięcioleciach badań, w latach 80. związek odpowiedzialny za te deformacje został zidentyfikowany jako alkaloid 11-deoksyjerwina, później przemianowany na cyklopaminę.
Dystrybucja w przyrodzie
Alkaloidy są wytwarzane przez różne organizmy żywe, zwłaszcza rośliny wyższe – około 10 do 25% z nich zawiera alkaloidy. Dlatego w przeszłości termin „alkaloid” był kojarzony z roślinami.
Zawartość alkaloidów w roślinach mieści się zwykle w granicach kilku procent i jest niejednorodna w tkankach roślinnych. W zależności od rodzaju rośliny, maksymalne stężenie obserwuje się w liściach (np. lulek czarny ), owocach lub nasionach ( drzewo Strychnine ), korzeniu ( Rauvolfia serpentina ) lub korze ( cinchona ). Ponadto różne tkanki tej samej rośliny mogą zawierać różne alkaloidy.
Oprócz roślin, alkaloidy znajdują się w niektórych typach grzybów , takich jak psylocybina w owocnikach rodzaju Psilocybe , oraz w zwierzętach, takich jak bufotenina w skórze niektórych ropuch i wielu owadów, zwłaszcza mrówek. Wiele organizmów morskich zawiera również alkaloidy. Niektóre aminy , takie jak adrenalina i serotonina , które odgrywają ważną rolę u zwierząt wyższych, są podobne w swojej budowie i biosyntezie do alkaloidów i czasami nazywane są alkaloidami.
Ekstrakcja
Ze względu na różnorodność strukturalną alkaloidów nie ma jednej metody ich pozyskiwania z surowców naturalnych. Większość metod wykorzystuje właściwość większości alkaloidów do rozpuszczania się w rozpuszczalnikach organicznych, ale nie w wodzie, oraz przeciwną tendencję ich soli.
Większość roślin zawiera kilka alkaloidów. Ich mieszanina jest najpierw ekstrahowana, a następnie rozdzielane są poszczególne alkaloidy. Rośliny są dokładnie mielone przed ekstrakcją. Większość alkaloidów występuje w surowych roślinach w postaci soli kwasów organicznych. Wyekstrahowane alkaloidy mogą pozostać solami lub zamienić się w zasady. Ekstrakcję zasad uzyskuje się poprzez obróbkę surowca roztworami alkalicznymi i ekstrakcję zasad alkaloidowych rozpuszczalnikami organicznymi, takimi jak 1,2-dichloroetan, chloroform, eter dietylowy czy benzen. Następnie zanieczyszczenia są rozpuszczane przez słabe kwasy; to przekształca zasady alkaloidów w sole, które są wypłukiwane wodą. Jeśli to konieczne, wodny roztwór soli alkaloidów ponownie alkalizuje się i traktuje rozpuszczalnikiem organicznym. Proces powtarza się aż do uzyskania pożądanej czystości.
W kwaśnej ekstrakcji surowiec roślinny jest przetwarzany za pomocą słabo kwaśnego roztworu ( np . kwasu octowego w wodzie, etanolu lub metanolu). Następnie dodaje się zasadę w celu przekształcenia alkaloidów w formy zasadowe, które są ekstrahowane rozpuszczalnikiem organicznym (jeśli ekstrakcję przeprowadzono alkoholem, najpierw ją usuwa się, a pozostałą część rozpuszcza się w wodzie). Roztwór oczyszcza się jak opisano powyżej.
Alkaloidy są oddzielane od ich mieszaniny na podstawie ich różnej rozpuszczalności w niektórych rozpuszczalnikach i różnej reaktywności z niektórymi odczynnikami lub przez destylację .
owadów zidentyfikowano wiele alkaloidów , wśród których badacze zwrócili większą uwagę na alkaloidy jadu mrówek ognistych , znane jako solenopsyny . Te alkaloidy owadów można skutecznie ekstrahować przez zanurzenie żywych mrówek ognistych w rozpuszczalniku lub przez odwirowanie żywych mrówek, a następnie oczyszczenie metodą chromatografii na żelu krzemionkowym. Śledzenie i dawkowanie wyekstrahowanych alkaloidów solenopsyny zostało opisane jako możliwe na podstawie ich piku absorbancji około 232 nanometrów.
Biosynteza
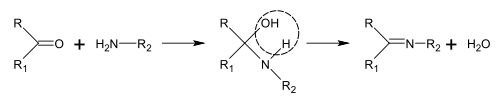
Biologicznymi prekursorami większości alkaloidów są aminokwasy , takie jak ornityna , lizyna , fenyloalanina , tyrozyna , tryptofan , histydyna , kwas asparaginowy i kwas antranilowy . Kwas nikotynowy można syntetyzować z tryptofanu lub kwasu asparaginowego. Sposoby biosyntezy alkaloidów są zbyt liczne i niełatwo je sklasyfikować. Istnieje jednak kilka typowych reakcji związanych z biosyntezą różnych klas alkaloidów, w tym synteza zasad Schiffa i reakcja Mannicha .
Synteza zasad Schiffa
Zasady Schiffa można otrzymać w reakcji amin z ketonami lub aldehydami. Reakcje te są powszechną metodą wytwarzania wiązań C=N.
W biosyntezie alkaloidów takie reakcje mogą zachodzić w cząsteczce, na przykład w syntezie piperydyny:
Reakcja Mannicha
Integralnym składnikiem reakcji Mannicha, oprócz aminy i związku karbonylowego , jest karboanion , który pełni rolę nukleofila w addycji nukleofilowej do jonu powstałego w reakcji aminy i karbonylu.
Reakcja Mannicha może przebiegać zarówno międzycząsteczkowo, jak i wewnątrzcząsteczkowo:
Alkaloidy dimerowe
Oprócz opisanych powyżej alkaloidów monomerycznych istnieją również alkaloidy dimeryczne , a nawet trimeryczne i tetrameryczne powstałe w wyniku kondensacji dwóch, trzech i czterech alkaloidów monomerycznych. Alkaloidy dimeryczne są zwykle tworzone z monomerów tego samego typu poprzez następujące mechanizmy:
- Reakcja Mannicha , w wyniku której powstaje np . woamina
- Reakcja Michaela (villalstonine)
- Kondensacja aldehydów z aminami (toksyferyna)
- Utleniający dodatek fenoli (daurycyna, tubokuraryna)
- Laktonizacja (karpaina).
Istnieją również alkaloidy dimeryczne utworzone z dwóch różnych monomerów, takie jak alkaloidy barwinka winblastyna i winkrystyna, które powstają w wyniku sprzęgania katarantyny i windoliny . Nowszy półsyntetyczny chemioterapeutyk winorelbina jest stosowany w leczeniu niedrobnokomórkowego raka płuca . Jest to kolejna pochodna dimeru windoliny i katarantyny i jest syntetyzowana z anhydrowinblastyny , zaczynając od leurozyny lub samych monomerów.
Rola biologiczna
Alkaloidy należą do najważniejszych i najlepiej poznanych metabolitów wtórnych , czyli substancji biogennych, które nie biorą bezpośredniego udziału w prawidłowym wzroście , rozwoju ani reprodukcji organizmu. Zamiast tego generalnie pośredniczą w interakcjach ekologicznych , które mogą przynieść organizmowi selektywną korzyść poprzez zwiększenie jego przeżywalności lub płodności . W niektórych przypadkach ich funkcja, jeśli w ogóle, pozostaje niejasna. Wczesna hipoteza, że alkaloidy są końcowymi produktami metabolizmu azotu u roślin, podobnie jak mocznik i kwas moczowy u ssaków, została obalona przez odkrycie, że ich stężenie raczej waha się niż stale wzrasta.
Większość znanych funkcji alkaloidów jest związana z ochroną. Na przykład alkaloid aporfinowy liriodenina wytwarzany przez tulipanowiec chroni go przed grzybami pasożytniczymi. Ponadto obecność alkaloidów w roślinie uniemożliwia zjadanie jej przez owady i strunowce . Jednak niektóre zwierzęta są przystosowane do alkaloidów, a nawet wykorzystują je we własnym metabolizmie. Substancje pokrewne alkaloidom, takie jak serotonina , dopamina i histamina , są ważnymi neuroprzekaźnikami u zwierząt. Wiadomo również, że alkaloidy regulują wzrost roślin. Jednym z przykładów organizmu, który wykorzystuje alkaloidy do ochrony, jest Utetheisa ornatrix , bardziej znana jako ćma ozdobna. Alkaloidy pirolizydynowe sprawiają, że te larwy i dorosłe ćmy są niesmaczne dla wielu ich naturalnych wrogów, takich jak chrząszcze coccinelid, siatkówki zielone, owadożerne pluskwiaki i owadożerne nietoperze. Inny przykład wykorzystania alkaloidów występuje w trującej cykucie ( Agonopterix alstroemeriana). Ta ćma żywi się wysoce toksyczną i bogatą w alkaloidy trującą cykutą ( Conium maculatum ) w stadium larwalnym. A. alstroemeriana może podwójnie skorzystać z toksyczności naturalnie występujących alkaloidów, zarówno poprzez niesmaczność gatunku dla drapieżników, jak i dzięki zdolności A. alstroemeriana do rozpoznawania Conium maculatum jako właściwego miejsca składania jaj. Wykazano, że alkaloid jadu mrówki ognistej , znany jako solenopsyna , chroni królowe inwazyjnych mrówek ognistych podczas zakładania nowych gniazd, odgrywając w ten sposób główną rolę w rozprzestrzenianiu się tego gatunku mrówek szkodników na całym świecie.
Aplikacje
W medycynie
Medyczne zastosowanie roślin zawierających alkaloidy ma długą historię, dlatego kiedy w XIX wieku wyizolowano pierwsze alkaloidy, natychmiast znalazły one zastosowanie w praktyce klinicznej. Wiele alkaloidów jest nadal używanych w medycynie, zwykle w postaci szeroko stosowanych soli, w tym:
Wiele leków syntetycznych i półsyntetycznych to strukturalne modyfikacje alkaloidów, które zostały zaprojektowane w celu wzmocnienia lub zmiany podstawowego działania leku i zmniejszenia niepożądanych skutków ubocznych. Na przykład nalokson , antagonista receptora opioidowego , jest pochodną tebainy , która jest obecna w opium .
W rolnictwie
Przed opracowaniem szerokiej gamy syntetycznych pestycydów o stosunkowo niskiej toksyczności niektóre alkaloidy, takie jak sole nikotyny i anabazyny , były stosowane jako środki owadobójcze . Ograniczeniem ich stosowania była ich wysoka toksyczność dla ludzi.
Stosować jako leki psychoaktywne
Preparaty roślinne zawierające alkaloidy i ich ekstrakty, a później czyste alkaloidy, od dawna stosowane są jako substancje psychoaktywne . Kokaina , kofeina i katynon działają pobudzająco na ośrodkowy układ nerwowy . Meskalina i wiele alkaloidów indolowych (takich jak psilocybina , dimetylotryptamina i ibogaina ) mają działanie halucynogenne . Morfina i kodeina to silne narkotyczne środki przeciwbólowe.
Istnieją alkaloidy, które same w sobie nie wykazują silnego działania psychoaktywnego, ale są prekursorami półsyntetycznych środków psychoaktywnych. Na przykład efedryna i pseudoefedryna są wykorzystywane do produkcji metakatynonu i metamfetaminy . Tebaina jest stosowana w syntezie wielu środków przeciwbólowych, takich jak oksykodon .
Zobacz też
Notatki wyjaśniające
Cytaty
Literatura ogólna i cytowana
- Aniszewski, Tadeusz (2007). Alkaloidy: tajemnice życia . Amsterdam: Elsevier . ISBN 978-0-444-52736-3 .
- Begley, Tadhg P. (2009). Encyklopedia biologii chemicznej . ChemBioChem . Tom. 10. Wiley. s. 1569–1570. doi : 10.1002/cbic.200900262 . ISBN 978-0-471-75477-0 .
- Brossi, Arnold (1989). Alkaloidy: chemia i farmakologia . Prasa akademicka.
- Dewick, Paul M. (2002). Naturalne produkty lecznicze: podejście biosyntetyczne (wyd. Drugie). Wileya. ISBN 978-0-471-49640-3 .
- Fattorusso, E.; Taglialatela-Scafati, O. (2008). Nowoczesne alkaloidy: struktura, izolacja, synteza i biologia . Wiley-VCH. ISBN 978-3-527-31521-5 .
- Grinkiewicz NI; Safronich LN, wyd. (1983). Analiza chemiczna roślin leczniczych (w języku rosyjskim). Moskwa: Wyszaja Szkoła.
- Hesja, Manfred (2002). Alkaloidy: przekleństwo natury czy błogosławieństwo? . Wiley-VCH. ISBN 978-3-906390-24-6 .
- Knunyants, Illinois (1988). Encyklopedia chemiczna . Encyklopedia radziecka.
- Orechow, AP (1955). Alkaloidy chemiczne (Acad. 2nd ed.). Moskwa.
- Plemenkov, VV (2001). Wprowadzenie do chemii związków naturalnych . Kazań.
- Saxton, JE (1971). Alkaloidy: Specjalistyczny raport okresowy . Londyn: Towarzystwo Chemiczne.
- Veselovskaya, NB; Kowalenko, AE (2000). Narkotyki . Moskwa: Triada-X.
- Mrugnięcie, M (2009). „Sposób działania i toksykologia toksyn roślinnych i roślin trujących”. Rękawica. Julius Kühn-Inst . 421 : 93–112x.
Linki zewnętrzne
-
 Media związane z alkaloidami w Wikimedia Commons
Media związane z alkaloidami w Wikimedia Commons -
 Cytaty związane z alkaloidem w Wikicytatach
Cytaty związane z alkaloidem w Wikicytatach