Steryd

Steroid to biologicznie aktywny związek organiczny z czterema pierścieniami ułożonymi w określonej konfiguracji molekularnej . Steroidy pełnią dwie główne funkcje biologiczne: jako ważne składniki błon komórkowych , które zmieniają płynność błony ; oraz jako cząsteczki sygnałowe . Setki sterydów występują w roślinach , zwierzętach i grzybach . Wszystkie sterydy są wytwarzane w komórkach ze steroli lanosterolu ( opisthokonts ) lub cykloartenol (rośliny). Lanosterol i cykloartenol pochodzą z cyklizacji triterpenowego skwalenu .
Struktura rdzenia sterydowego składa się zwykle z siedemnastu atomów węgla , połączonych w cztery „ skondensowane ” pierścienie: trzy sześcioczłonowe pierścienie cykloheksanowe (pierścienie A, B i C na pierwszej ilustracji) i jeden pięcioczłonowy pierścień cyklopentanowy (pierścień D) . Steroidy różnią się grupami funkcyjnymi przyłączonymi do tego czteropierścieniowego rdzenia i stopniem utlenienia pierścieni. Sterole to formy steroidów z grupą hydroksylową w pozycji trzeciej i szkieletem pochodnym cholestan . Sterydy można również modyfikować bardziej radykalnie, na przykład poprzez zmianę struktury pierścienia, na przykład przecięcie jednego z pierścieni. Pierścień tnący B wytwarza sekosteroidy , z których jednym jest witamina D 3 .
Przykłady obejmują sterydy anaboliczne , cholesterol lipidowy , hormony płciowe estradiol i testosteron oraz lek przeciwzapalny deksametazon .
Nomenklatura


Gonan , znany również jako steran lub cyklopentanoperhydrofenantren, najprostszy steroid i jądro wszystkich steroidów i steroli, składa się z siedemnastu atomów węgla w wiązaniach węgiel-węgiel tworzących cztery skondensowane pierścienie w trójwymiarowym kształcie . Trzy cykloheksanu (A, B i C na pierwszej ilustracji) tworzą szkielet perhydro pochodnej fenantrenu . Pierścień D ma cyklopentanu . Kiedy dwie grupy metylowe i osiem łańcuchów bocznych węgla (przy C-17, jak pokazano dla cholesterolu) są obecne, mówi się, że steroid ma szkielet cholestanowy. Dwie powszechne formy stereoizomeryczne 5α i 5β steroidów istnieją z powodu różnic po stronie w dużej mierze płaskiego układu pierścieniowego, do której przyłączony jest atom wodoru (H) przy węglu-5, co powoduje zmianę konformacji pierścienia A steroidu. Izomeryzacja na łańcuchu bocznym C-21 prowadzi do powstania równoległej serii związków, zwanych izosteroidami.
Przykładami struktur steroidowych są:
Testosteron , główny męski hormon płciowy i steryd anaboliczny
Kwas cholowy , kwas żółciowy , często występujący kwas karboksylowy i dodatkowe grupy hydroksylowe
Deksametazon , syntetyczny lek kortykosteroidowy
Lanosterol , biosyntetyczny prekursor sterydów zwierzęcych. Liczba atomów węgla (30) wskazuje na jego triterpenoidową .
Progesteron , hormon steroidowy zaangażowany w kobiecy cykl menstruacyjny, ciążę i embriogenezę
Medrogestone , syntetyczny lek o działaniu podobnym do progesteronu
β-sitosterol , roślina lub fitosterol , z w pełni rozgałęzionym węglowodorowym łańcuchem bocznym przy C-17 i grupą hydroksylową przy C-3
Oprócz rozerwania pierścienia (rozszczepienia), rozszerzenia i skurczu (rozszczepienia i ponownego zamknięcia do większych lub mniejszych pierścieni) - wszystkich odmian struktury wiązania węgiel-węgiel - sterydy mogą się również różnić:
- w zamówieniach obligacji w pierścieniach,
- w liczbie grup metylowych przyłączonych do pierścienia (i, jeśli są obecne, na widocznym łańcuchu bocznym przy C17),
- w grupach funkcyjnych przyłączonych do pierścieni i łańcucha bocznego oraz
- w konfiguracji grup przyłączonych do pierścieni i łańcucha.
Na przykład sterole , takie jak cholesterol i lanosterol, mają grupę hydroksylową przyłączoną w pozycji C-3, podczas gdy testosteron i progesteron mają grupę karbonylową (podstawnik okso) w pozycji C-3; spośród nich lanosterol ma dwie grupy metylowe przy C-4, a cholesterol (z podwójnym wiązaniem od C-5 do C-6) różni się od testosteronu i progesteronu (które mają podwójne wiązanie od C-4 do C-5).

Cholesterol , prototypowy sterol zwierzęcy. Ten strukturalny biosyntezy lipidów i kluczowych steroidów .
|

5α- cholestan , powszechny rdzeń steroidowy
|
Rozmieszczenie i funkcja gatunków
U eukariontów steroidy znajdują się w grzybach, zwierzętach i roślinach.
Sterydy grzybicze
Steroidy grzybowe obejmują ergosterole , które biorą udział w utrzymaniu integralności błony komórkowej grzybów. Różne leki przeciwgrzybicze , takie jak amfoterycyna B i azolowe leki przeciwgrzybicze , wykorzystują te informacje do zabijania grzybów chorobotwórczych . Grzyby mogą zmieniać zawartość ergosterolu (np. poprzez mutacje powodujące utratę funkcji w enzymach ERG3 lub ERG6 , indukujące wyczerpanie ergosterolu lub mutacje zmniejszające zawartość ergosterolu), aby rozwinąć oporność na leki ukierunkowane na ergosterol.
Ergosterol jest analogiczny do cholesterolu znajdującego się w błonach komórkowych zwierząt (w tym ludzi) lub fitosteroli znajdujących się w błonach komórkowych roślin. Wszystkie grzyby zawierają duże ilości ergosterolu, rzędu kilkudziesięciu do kilkuset miligramów na 100 gramów suchej masy. Tlen jest niezbędny do syntezy ergosterolu u grzybów.
witaminy D w grzybach odpowiada ergosterol ; ergosterol jest chemicznie przekształcany w prowitaminę D2 pod wpływem światła ultrafioletowego . Prowitamina D2 spontanicznie tworzy witaminę D2. Jednak nie wszystkie grzyby wykorzystują ergosterol w swoich błonach komórkowych; na przykład patogenny gatunek grzyba Pneumocystis jirovecii nie, co ma ważne implikacje kliniczne (biorąc pod uwagę mechanizm działania wielu leków przeciwgrzybiczych). Używając grzyba Saccharomyces cerevisiae jako przykładu, inne główne steroidy obejmują ergosta-5,7,22,24(28)-tetraen-3β-ol, zymosterolu i lanosterolu . S. cerevisiae wykorzystuje w swojej błonie komórkowej 5,6-dihydroergosterol zamiast ergosterolu.
Sterydy zwierzęce
Steroidy zwierzęce obejmują związki pochodzenia kręgowców i owadów , te ostatnie obejmują ekdysteroidy , takie jak ekdysteron (kontrolujący linienie u niektórych gatunków). Przykłady kręgowców obejmują hormony steroidowe i cholesterol; ten ostatni jest strukturalnym składnikiem błon komórkowych , który pomaga określić płynność błon komórkowych i jest głównym składnikiem blaszki miażdżycowej (zaangażowanej w miażdżycę tętnic ). Hormony steroidowe obejmują:
- Hormony płciowe , które wpływają na różnice między płciami i wspomagają rozmnażanie . Należą do nich androgeny , estrogeny i progestageny .
- Kortykosteroidy , w tym większość syntetycznych leków steroidowych, z klasami produktów naturalnych : glikokortykosteroidy (które regulują wiele aspektów metabolizmu i funkcji odpornościowych ) oraz mineralokortykoidy (które pomagają utrzymać objętość krwi i kontrolować wydalanie elektrolitów przez nerki )
- Sterydy anaboliczne , naturalne i syntetyczne, które wchodzą w interakcję z receptorami androgenowymi w celu zwiększenia syntezy mięśni i kości. W powszechnym użyciu termin „steroidy” często odnosi się do sterydów anabolicznych.
Sterydy roślinne
alkaloidy steroidowe występujące w Solanaceae i Melanthiaceae (zwłaszcza z rodzaju Veratrum ), glikozydy nasercowe , fitosterole i brassinosteroidy (które obejmują kilka hormonów roślinnych).
Prokarionty
U prokariontów istnieją szlaki biosyntezy dla tetracyklicznego szkieletu steroidowego (np. u mykobakterii ) – gdzie przypuszcza się, że pochodzi on od eukariontów – oraz bardziej powszechnego pentacyklicznego triterpinoidowego szkieletu hopanoidowego .
typy
Według funkcji
Główne klasy hormonów steroidowych , z wybitnymi członkami i przykładami powiązanych funkcji, to: [ potrzebne źródło ]
-
Kortykosteroidy :
-
Glukokortykoidy :
- Kortyzol , glukokortykoid , którego funkcje obejmują immunosupresję
-
Mineralokortykoidy :
- Aldosteron , mineralokortykoid , który pomaga regulować ciśnienie krwi poprzez równowagę wodno-elektrolitową
-
Glukokortykoidy :
-
Sterydy płciowe :
-
Progestageny :
- Progesteron , który reguluje cykliczne zmiany w endometrium macicy i podtrzymuje ciążę
-
Androgeny :
- Testosteron , który przyczynia się do rozwoju i utrzymania męskich drugorzędowych cech płciowych
-
Estrogeny :
- Estradiol , który przyczynia się do rozwoju i utrzymania żeńskich drugorzędowych cech płciowych
-
Progestageny :
Dodatkowe klasy sterydów obejmują:
- Neurosteroidy , takie jak DHEA i allopregnanolon
- Kwasy żółciowe, takie jak kwas taurocholowy
- Aminosteroidowe środki blokujące przewodnictwo nerwowo-mięśniowe (głównie syntetyczne), takie jak bromek pankuronium
- Antyandrogeny steroidowe (głównie syntetyczne), takie jak octan cyproteronu
- Inhibitory steroidogenezy (głównie egzogenne), takie jak alfatradiol
- Sterole błonowe, takie jak cholesterol , ergosterol i różne fitosterole
- Toksyny, takie jak saponiny steroidowe i kardenolidy / glikozydy nasercowe
Jak również następujące klasy sekosteroidów (steroidy z otwartym pierścieniem):
- witaminy D, takie jak ergokalcyferol , cholekalcyferol i kalcytriol
Według struktury
Nienaruszony system pierścieni
Steroidy można klasyfikować na podstawie ich składu chemicznego. Jeden przykład tego, jak MeSH wykonuje tę klasyfikację, jest dostępny w katalogu Wikipedii MeSH. Przykłady tej klasyfikacji obejmują:

| Klasa | Przykład | Liczba atomów węgla |
|---|---|---|
| Cholestany | cholesterol | 27 |
| cholany | Kwas cholowy | 24 |
| Ciąża | progesteron | 21 |
| Androstany | testosteron | 19 |
| Estrany | estradiol | 18 |
W biologii powszechnie nazywa się powyższe klasy steroidów liczbą atomów węgla obecnych w odniesieniu do hormonów: C 18 - steroidy dla estranów (głównie estrogenów), C 19 - steroidy dla androstanów (głównie androgenów) i C 21 -sterydy dla kobiet w ciąży (głównie kortykosteroidy). Klasyfikacja „ 17-ketosteroid ” ma również znaczenie w medycynie.
Gonan (jądro steroidowe) jest macierzystą 17-węglową tetracykliczną cząsteczką węglowodoru bez alkilowych łańcuchów bocznych.
Rozszczepione, skurczone i rozszerzone pierścienie
Sekosteroidy (łac. seco , „do cięcia”) to podklasa związków steroidowych powstałych, biosyntetycznie lub koncepcyjnie, w wyniku rozszczepienia (rozszczepienia) macierzystych pierścieni steroidowych (zwykle jednego z czterech). Główne podklasy sekosteroidów są zdefiniowane przez atomy węgla steroidów, w których nastąpiło to rozszczepienie. Na przykład, prototypowy sekosteroidowy cholekalcyferol , witamina D3 ( pokazana), należy do podklasy 9,10-sekosteroidów i pochodzi z rozszczepienia atomów węgla C-9 i C-10 pierścienia B steroidu; 5,6-sekosteroidy i 13,14-steroidy są podobne.
Norsteroidy ( nor- , L. norma ; „normalne” w chemii, wskazujące na usuwanie węgla) i homosteroidy (homo-, greckie homos ; „taki sam”, co wskazuje na dodanie węgla) to strukturalne podklasy steroidów utworzone z etapów biosyntezy. Pierwsza obejmuje enzymatyczne rozszerzania-kurczenia pierścienia , a druga jest realizowana ( biomimetycznie ) lub ( częściej) przez zamknięcie pierścieni acyklicznych prekursorów z większą (lub mniejszą) atomami pierścienia niż macierzysty szkielet steroidowy.
Kombinacje tych zmian pierścienia są znane w przyrodzie. Na przykład owce , które pasą się na lilii kukurydzianej , spożywają cyklopaminę (pokazaną) i weratraminę , dwie z podrodziny steroidów, w których pierścienie C i D są odpowiednio kurczone i rozszerzane poprzez biosyntetyczną migrację pierwotnego atomu C-13. Spożycie tych C-nor-D-homosteroidów powoduje wady wrodzone u jagniąt: cyklopię z cyklopaminy i deformację nóg z weratraminy. Kolejny homosteroid C-nor-D (nakiterpiozyna) jest wydalany przez Okinawę gąbki sinicowe . np. Terpios hoshinota , co prowadzi do śmiertelności koralowców z powodu choroby czarnych koralowców. Steroidy typu nakiterpiozyny są aktywne przeciwko szlakowi sygnałowemu obejmującemu wygładzone i hedgehog , szlak, który jest nadaktywny w wielu nowotworach. [ potrzebne źródło ]
Znaczenie biologiczne
Steroidy i ich metabolity często działają jako cząsteczki sygnałowe (najbardziej godnymi uwagi przykładami są hormony steroidowe), a steroidy i fosfolipidy są składnikami błon komórkowych . Steroidy, takie jak cholesterol, zmniejszają płynność błony . Podobnie jak lipidy , sterydy są wysoce skoncentrowanymi magazynami energii. Jednak nie są one typowymi źródłami energii; u ssaków są normalnie metabolizowane i wydalane.
Sterydy odgrywają kluczową rolę w wielu zaburzeniach, w tym w nowotworach złośliwych, takich jak rak prostaty , gdzie produkcja steroidów wewnątrz i na zewnątrz guza sprzyja agresywności komórek nowotworowych.
Biosynteza i metabolizm
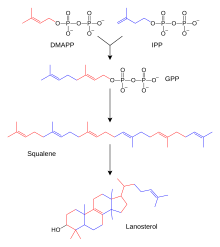
Setki steroidów występujących u zwierząt, grzybów i roślin są zbudowane z lanosterolu (u zwierząt i grzybów, patrz przykłady powyżej) lub cykloartenolu (u innych eukariontów). Zarówno lanosterol, jak i cykloartenol pochodzą z cyklizacji triterpenoidowego skwalenu . Lanosterol i cykloartenol są czasami nazywane protosterolami, ponieważ służą jako związki wyjściowe dla wszystkich innych sterydów.
Biosynteza sterydów to szlak anaboliczny , który wytwarza sterydy z prostych prekursorów. U zwierząt obserwuje się unikalny szlak biosyntezy (w porównaniu z wieloma innymi organizmami ), co czyni ten szlak powszechnym celem dla antybiotyków i innych leków przeciwinfekcyjnych. Metabolizm steroidów u ludzi jest również celem leków obniżających poziom cholesterolu, takich jak statyny . U ludzi i innych zwierząt biosynteza steroidów odbywa się na szlaku mewalonianu, który wykorzystuje acetylo-CoA jako budulec difosforanu dimetyloallilu (DMAPP) i difosforan izopentenylu (IPP). [ potrzebne lepsze źródło ]
W kolejnych etapach DMAPP i IPP sprzęgają się, tworząc difosforan farnezylu (FPP), który dalej sprzęga się ze sobą, tworząc liniowy skwalen triterpenoidowy. Biosynteza skwalenu jest katalizowana przez syntazę skwalenu , która należy do rodziny syntaz skwalenu/fitoenu . Późniejsza epoksydacja i cyklizacja skwalenu generują lanosterol, który jest punktem wyjścia do dodatkowych modyfikacji w inne steroidy (steroidogeneza). U innych eukariotów produktem cyklizacji epoksydowanego skwalenu (oksydoskwalenu) jest cykloartenol.
Szlak mewalonianu
Szlak mewalonianu (zwany także szlakiem reduktazy HMG-CoA) zaczyna się od acetylo-CoA , a kończy difosforanem dimetyloallilu (DMAPP) i difosforanem izopentenylu (IPP).
DMAPP i IPP przekazują jednostki izoprenowe , które są składane i modyfikowane w celu utworzenia terpenów i izoprenoidów (duża klasa lipidów, która obejmuje karotenoidy i tworzą największą klasę naturalnych produktów roślinnych . Tutaj jednostki izoprenowe są łączone w celu wytworzenia skwalenu i fałdowania w zestaw pierścieni, aby wytworzyć lanosterol.Lanosterol można następnie przekształcić w inne steroidy, takie jak cholesterol i ergosterol .
Dwie klasy leków celują w szlak mewalonianu : statyny (takie jak rozuwastatyna ), które są stosowane w celu obniżenia podwyższonego poziomu cholesterolu , oraz bisfosfoniany (takie jak zoledronian ), które są stosowane w leczeniu wielu chorób zwyrodnieniowych kości.
steroidogeneza

Steroidogeneza to proces biologiczny, w którym steroidy są generowane z cholesterolu i przekształcane w inne steroidy. Szlaki steroidogenezy różnią się w zależności od gatunku . Główne klasy hormonów steroidowych, jak wspomniano powyżej (wraz z ich głównymi członkami i funkcjami), to progestageny , kortykosteroidy ( kortykoidy), androgeny i estrogeny . [ potrzebne źródło ] Ludzka steroidogeneza tych klas występuje w wielu miejscach:
- Progestageny są prekursorami wszystkich innych ludzkich sterydów, a wszystkie ludzkie tkanki produkujące sterydy muszą najpierw przekształcić cholesterol w pregnenolon . Ta konwersja jest etapem ograniczającym szybkość syntezy steroidów, który zachodzi wewnątrz mitochondrium odpowiedniej tkanki. [ potrzebne lepsze źródło ]
- Kortyzol, kortykosteron, aldosteron i testosteron są wytwarzane w korze nadnerczy . [ potrzebne źródło ]
- Estradiol, estron i progesteron są wytwarzane głównie w jajnikach , estriol w łożysku podczas ciąży, a testosteron głównie w jądrach (niektóre testosteron jest również wytwarzany w korze nadnerczy). [ potrzebne źródło ]
- Estradiol jest przekształcany z testosteronu bezpośrednio (u mężczyzn) lub drogą pierwotną DHEA - androstendion - estron i wtórnie przez testosteron (u kobiet). [ potrzebne źródło ]
- Wykazano, że komórki zrębowe wytwarzają steroidy w odpowiedzi na sygnalizację wytwarzaną przez komórki raka prostaty pozbawione androgenów . [ potrzebne inne źródło ] [ potrzebne lepsze źródło ]
- Niektóre neurony i glej w ośrodkowym układzie nerwowym (OUN) wyrażają enzymy wymagane do lokalnej syntezy pregnenolonu, progesteronu, DHEA i DHEAS, de novo lub ze źródeł obwodowych. [ potrzebne źródło ]
| Seks | Hormon płciowy | Faza reprodukcyjna |
Szybkość produkcji krwi |
Szybkość wydzielania gonad |
Szybkość klirensu metabolicznego |
Zakres referencyjny (stężenia w surowicy) | |
|---|---|---|---|---|---|---|---|
| Jednostki SI | Jednostki spoza układu SI | ||||||
| Mężczyźni | Androstendion |
–
|
2,8 mg/dzień | 1,6 mg/dzień | 2200 l/dzień | 2,8–7,3 nmol/l | 80–210 ng/dl |
| Testosteron |
–
|
6,5 mg/dzień | 6,2 mg/dzień | 950 l/dzień | 6,9–34,7 nmol/l | 200–1000 ng/dl | |
| estron |
–
|
150 μg/dzień | 110 μg/dzień | 2050 l/dzień | 37–250 pmol / l | 10–70 pg/ml | |
| estradiol |
–
|
60 μg/dzień | 50 μg/dzień | 1600 l/dzień | <37–210 pmol/l | 10–57 pg/ml | |
| Siarczan estronu |
–
|
80 μg/dzień | Nieistotny | 167 l/dzień | 600–2500 pmol / l | 200–900 pg/ml | |
| Kobiety | Androstendion |
–
|
3,2 mg/dzień | 2,8 mg/dzień | 2000 l/dzień | 3,1–12,2 nmol/l | 89–350 ng/dl |
| testosteron |
–
|
190 μg/dzień | 60 μg/dzień | 500 l/dzień | 0,7–2,8 nmol/l | 20–81 ng/dl | |
| estron | Faza folikularna | 110 μg/dzień | 80 μg/dzień | 2200 l/dzień | 110–400 pmol / l | 30–110 pg/ml | |
| Faza lutealna | 260 μg/dzień | 150 μg/dzień | 2200 l/dzień | 310–660 pmol / l | 80–180 pg/ml | ||
| Po menopauzie | 40 μg/dzień | Nieistotny | 1610 l/dzień | 22–230 pmol / l | 6–60 pg/ml | ||
| estradiol | Faza folikularna | 90 μg/dzień | 80 μg/dzień | 1200 l/dzień | <37–360 pmol/l | 10–98 pg/ml | |
| Faza lutealna | 250 μg/dzień | 240 μg/dzień | 1200 l/dzień | 699-1250 pmol / l | 190–341 pg/ml | ||
| Po menopauzie | 6 μg/dzień | Nieistotny | 910 l/dzień | <37–140 pmol/l | 10–38 pg/ml | ||
| Siarczan estronu | Faza folikularna | 100 μg/dzień | Nieistotny | 146 l/dzień | 700–3600 pmol / l | 250–1300 pg/ml | |
| Faza lutealna | 180 μg/dzień | Nieistotny | 146 l/dzień | 1100–7300 pmol / l | 400–2600 pg/ml | ||
| progesteron | Faza folikularna | 2 mg/dzień | 1,7 mg/dzień | 2100 l/dzień | 0,3–3 nmol/l | 0,1–0,9 ng/ml | |
| Faza lutealna | 25 mg/dzień | 24 mg/dzień | 2100 l/dzień | 19–45 nmol/l | 6–14 ng/ml | ||
|
Notatki i źródła
Uwagi: „ Stężenie steroidu w krążeniu zależy od szybkości, z jaką jest on wydzielany z gruczołów, tempa metabolizmu prekursorów lub prehormonów do steroidu oraz tempa, z jakim jest on pobierany przez tkanki i metabolizowany. Szybkość wydzielania steroidu odnosi się do całkowitego wydzielania związku z gruczołu w jednostce czasu. Szybkość wydzielania oceniano, pobierając próbki wydzieliny żylnej z gruczołu w czasie i odejmując stężenie hormonu w krwi tętniczej i obwodowej. Szybkość klirensu metabolicznego steroidu definiuje się jako objętość krwi, która została całkowicie oczyszczona z hormonu w jednostce czasu. Tempo produkcji hormonu steroidowego odnosi się do wejścia związku do krwi ze wszystkich możliwych źródeł, w tym wydzielania z gruczołów i konwersji prohormonów do steroidu będącego przedmiotem zainteresowania. W stanie stacjonarnym ilość hormonu wchodzącego do krwi ze wszystkich źródeł będzie równa szybkości, z jaką jest usuwany (szybkość klirensu metabolicznego) pomnożona przez stężenie we krwi (szybkość produkcji = szybkość klirensu metabolicznego × stężenie). Jeśli udział metabolizmu prohormonów w krążącej puli sterydów jest niewielki, wówczas tempo produkcji będzie zbliżone do tempa wydzielania.” Źródła: patrz szablon.
|
|||||||
Alternatywne ścieżki
W roślinach i bakteriach szlak bez mewalonianu (szlak MEP) wykorzystuje pirogronian i 3-fosforan aldehydu glicerynowego jako substraty do produkcji IPP i DMAPP.
Podczas chorób szlaki, które w inny sposób nie są znaczące u zdrowych ludzi, mogą zostać wykorzystane. Na przykład w jednej z postaci wrodzonego przerostu nadnerczy niedobór szlaku enzymatycznego 21-hydroksylazy prowadzi do nadmiaru 17α-hydroksyprogesteronu (17-OHP) – ten patologiczny nadmiar 17-OHP z kolei może zostać przekształcony w dihydrotestosteron (DHT, silny androgen) poprzez m.in. 17,20 liazę (członek rodziny enzymów cytochromu P450 ), 5α-reduktazę i dehydrogenazę 3α-hydroksysteroidową .
Katabolizm i wydalanie
Steroidy są głównie utleniane przez enzymy oksydazy cytochromu P450 , takie jak CYP3A4 . Reakcje te wprowadzają tlen do pierścienia steroidowego, umożliwiając rozbicie cholesterolu przez inne enzymy na kwasy żółciowe. Kwasy te mogą być następnie wydalane przez wydzielanie z wątroby z żółcią . Ekspresja oksydazy może być regulowana w górę przez czujnik steroidowy PXR , gdy występuje wysokie stężenie steroidów we krwi. Zwykle występują hormony steroidowe, pozbawione łańcucha bocznego cholesterolu i kwasów żółciowych hydroksylowane w różnych pozycjach pierścienia lub utlenione w pozycji 17 , sprzężone z siarczanem lub kwasem glukuronowym i wydalane z moczem.
Izolacja, wyznaczanie struktury i metody analizy
Izolacja sterydów , w zależności od kontekstu, to izolacja materii chemicznej wymagana do wyjaśnienia struktury chemicznej , derywatyzacji lub degradacji chemii, testów biologicznych i innych potrzeb badawczych (ogólnie miligramy do gramów, ale często więcej lub izolacja „ilości analitycznych” substancja będąca przedmiotem zainteresowania (gdzie nacisk kładzie się na identyfikację i oznaczenie ilościowe substancji (na przykład w tkance biologicznej lub płynie). Wyizolowana ilość zależy od metody analitycznej, ale na ogół jest mniejsza niż jeden mikrogram. [ potrzebna strona ]
Metody izolacji w celu uzyskania dwóch skal produktu są różne, ale obejmują ekstrakcję , wytrącanie, adsorpcję , chromatografię i krystalizację . W obu przypadkach wyodrębniona substancja jest oczyszczana do jednorodności chemicznej; połączone metody rozdzielania i analizy, takie jak LC-MS , są wybierane jako „ortogonalne” — osiągając separację w oparciu o odrębne tryby interakcji między substancją a matrycą izolującą — w celu wykrycia pojedynczego gatunku w czystej próbce.
Określenie struktury odnosi się do metod określania struktury chemicznej wyizolowanego czystego steroidu przy użyciu rozwijającego się szeregu metod chemicznych i fizycznych, które obejmowały NMR i krystalografię małocząsteczkową . Metody analizy nakładają się na oba powyższe obszary, kładąc nacisk na metody analityczne na określenie obecności steroidu w mieszaninie i określenie jego ilości.
Synteza chemiczna
Mikrobiologiczny katabolizm łańcuchów bocznych fitosterolu daje steroidy C-19, steroidy C-22 i 17-ketosteroidy (tj. prekursory hormonów kory nadnerczy i środki antykoncepcyjne ). Dodawanie i modyfikacja grup funkcyjnych ma kluczowe znaczenie przy wytwarzaniu szerokiej gamy leków dostępnych w ramach tej klasyfikacji chemicznej. Modyfikacje te przeprowadza się stosując konwencjonalne syntezy organicznej i/lub biotransformacji .
Prekursory
Półsynteza
Półsynteza sterydów często rozpoczyna się od prekursorów, takich jak cholesterol , fitosterole czy sapogeniny . Wysiłki Syntex , firmy zajmującej się handlem meksykańskim barbasco , wykorzystały Dioscorea mexicana do produkcji sapogeniny diosgeniny we wczesnych latach przemysłu farmaceutycznego syntetycznych sterydów .
Totalna synteza
Niektóre hormony steroidowe są ekonomicznie pozyskiwane jedynie w drodze całkowitej syntezy z produktów petrochemicznych (np. 13- alkilosteroidy ). Na przykład farmaceutyczny Norgestrel zaczyna się od metoksy - 1-tetralonu , substancji petrochemicznej pochodzącej z fenolu .
Nagrody badawcze
Za badania nad sterydami przyznano wiele Nagród Nobla , w tym:
- 1927 ( Chemia ) Heinrich Otto Wieland — Budowa kwasów żółciowych i steroli oraz ich związek z witaminami
- 1928 (Chemia) Adolf Otto Reinhold Windaus — Budowa steroli i ich związek z witaminami
- 1939 (Chemia) Adolf Butenandt i Leopold Ružička - Izolacja i badania strukturalne steroidowych hormonów płciowych oraz powiązane badania nad wyższymi terpenami
- 1950 ( Fizjologia lub medycyna ) Edward Calvin Kendall , Tadeus Reichstein i Philip Hench — Struktura i efekty biologiczne hormonów nadnerczy
- 1965 (Chemia) Robert Burns Woodward — Częściowo za syntezę cholesterolu, kortyzonu i lanosterolu
- 1969 (Chemia) Derek Barton i Odd Hassel — Rozwój koncepcji konformacji w chemii, z naciskiem na jądro steroidowe
- 1975 (Chemia) Vladimir Prelog — Częściowo za opracowanie metod określania stereochemicznego przebiegu biosyntezy cholesterolu z kwasu mewalonowego przez skwalen
Zobacz też
Bibliografia
- Russel CA (2005). „Chemia organiczna: produkty naturalne, sterydy”. W Russell CA, Roberts GK (red.). Historia chemiczna: recenzje najnowszej literatury . Cambridge: Publikacja RSC. ISBN 978-0-85404-464-1 .
- „Russell Marker Stworzenie meksykańskiego przemysłu hormonów steroidowych - punkt orientacyjny -” . Amerykańskie Towarzystwo Chemiczne. 1999.
- Lednicer D (2011). Chemia sterydów w skrócie . Hoboken: Wiley. doi : 10.1002/9780470973639 . ISBN 978-0-470-66085-0 . Zwięzła historia badań nad sterydami.
- Yoder RA, Johnston JN (grudzień 2005). „Studium przypadku w biomimetycznej syntezie całkowitej: karbocyklizacje poliolefin do terpenów i steroidów” . Recenzje chemiczne . 105 (12): 4730–56. doi : 10.1021/cr040623l . PMC 2575671 . PMID 16351060 . Przegląd historii syntezy steroidów, zwłaszcza biomimetycznych .
- Han TS, Walker BR, Arlt W, Ross RJ (luty 2014). „Leczenie i wyniki zdrowotne u dorosłych z wrodzonym przerostem nadnerczy”. Recenzje przyrody. Endokrynologia . 10 (2): 115–24. doi : 10.1038/nrendo.2013.239 . PMID 24342885 . S2CID 6090764 . Szlak steroidogenezy nadnerczy.
- Greep RO, wyd. (22 października 2013). „Kwasy kortonowe” . Najnowsze postępy w badaniach nad hormonami: Proceedings of the Laurentian Hormone Conference 1979 . Nauka Elseviera . s. 345–391. ISBN 978-1-4832-1956-1 .
- Bowen RA (20 października 2001). „Steroidogeneza” . Patofizjologia układu hormonalnego . Uniwersytet Stanowy Kolorado. Zarchiwizowane od oryginału w dniu 28 lutego 2009 r.











