Selektywny modulator receptora progesteronowego
| Selektywny modulator receptora progesteronu | |
|---|---|
| Klasa leków | |

| |
| Identyfikatory klas | |
| Synonimy | SPRM |
| Używać | Antykoncepcja awaryjna , mięśniaki macicy |
| Kod ATC | G03XB |
| Cel biologiczny | Receptor progesteronu |
| Klasa chemiczna | sterydowe |
| W Wikidanych | |
Selektywny modulator receptora progesteronu ( SPRM ) jest środkiem działającym na receptor progesteronu (PR), biologiczny cel progestagenów, takich jak progesteron . Cechą odróżniającą takie substancje od pełnych agonistów receptora (np. progesteronu, progestyny ) i pełnych antagonistów (np. aglepristonu ) jest to, że ich działanie różni się w różnych tkankach , tj. agonista w niektórych tkankach, a antagonista w innych. Ten mieszany profil działania prowadzi do stymulacji lub hamowania w sposób specyficzny dla tkanki, co dodatkowo zwiększa możliwość oddzielenia niepożądanych skutków ubocznych od rozwoju kandydatów na syntetyczne modulatory PR .
Historia
Od czasu odkrycia hormonu progesteronu w połowie lat 30. a zwłaszcza po odkryciu jego receptora w 1970 r. pojawiło się znaczne zainteresowanie opracowaniem środka antagonistycznego do zastosowania terapeutycznego. różne analogi progesteronu , znane jako progestyny , aw 1981 roku wprowadzono pierwszego antagonistę receptora progesteronu o nazwie RU 38486 (RU 486, mifepristone ). Jednak kliniczne ograniczenie mifepristonu ze względu na jego stosunkowo wysokie powinowactwo wiązania z receptorem glukokortykoidowym w porównaniu z receptorem progesteronu wywołało zapotrzebowanie na bardziej selektywnego antagonistę progesteronu, aby zminimalizować ryzyko działań niepożądanych. W ramach wkładu opracowano tak zwane selektywne modulatory receptora progesteronu (SPRM). Zostały opisane jako środki o mieszanym działaniu antagonistycznym i agonistycznym na receptory progesteronu w sposób swoisty tkankowo, przy jednoczesnym zminimalizowaniu interakcji z innymi receptorami steroidowymi . W przeciwieństwie do antagonistów progesteronu, mieszany agonista-antagonista SPRM, ze względu na swoją wewnętrzną aktywność agonisty progesteronu, nie ma żadnego lub tylko minimalny wpływ na przerwanie ciąży, a zatem jest idealny do leczenia stanów ginekologicznych bez eliminowania potencjalnej ciąży. Opisano zarówno steroidowe, jak i niesteroidowe SPRM, a najbardziej godnymi uwagi przykładami są asoprisnil , który nie powiódł się w badaniu klinicznym fazy 3 w 2008 r., oraz octan uliprystalu , pierwszy SPRM na rynku (2009 w Europie).
Receptor progesteronu
Chwytnik
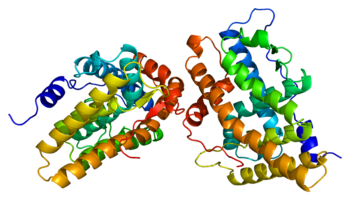
Jako białko , receptor progesteronu (ryc. 1) jest członkiem zależnej od ligandu rodziny jądrowych receptorów hormonalnych . Zidentyfikowano dwie główne izoformy receptora progesteronu , A i B, a także kilka innych mniej powszechnych wariantów splicingowych i wszystkie są kodowane przez ten sam gen złożony z 8 eksonów . Podobnie jak inne steroidowe receptory jądrowe , białko pełnej długości, izoforma B, można podzielić na 4 regiony funkcjonalne, a mianowicie region zmienny N-końcowy, po którym następuje wysoce konserwatywny Domena wiążąca DNA , zmienny region zawiasowy i umiarkowanie konserwowana domena wiążąca ligand. Miejsce wiązania liganda, znane jako domena AF2 , jest wyrażane przez eksony 4-8, odpowiadające 253 aminokwasom , a jego struktura jest bardzo interesująca dla rozwoju SPRM. Składa się z 10 helis α (H1, H3-H12) tworzących wiązkę 3 warstwową splecioną z 4 arkuszami β . H12 to skondensowana ciągła jednostka złożona z helis 10 i 11, która, jak sugerowano, bierze udział w procesie koaktywacji wiążący. Domena receptora wiążąca ligand jest w równowadze między dwiema różnymi konformacjami. Pierwsza to konformacja agonisty, która sprzyja wiązaniu koaktywatorów , co z kolei sprzyja regulacji w górę transkrypcji genów. Druga to konformacja antagonistyczna, która w przeciwieństwie do faworyzuje wiązanie korepresorów , aw konsekwencji obniżenie ekspresji genów. Pełni agoniści, tacy jak progesteron, wykazujący właściwości agonistyczne we wszystkich tkankach, silnie przesuwają równowagę konformacyjną w kierunku agonistycznym. Odwrotnie, pełni antagoniści, tacy jak aglepriston silnie przesunąć równowagę w kierunku antagonisty. Wreszcie, ogólny stosunek stężeń koaktywatora do korepresora może różnić się w różnych typach komórek.
Receptor sprzężony z białkiem G
Na przełomie tysiącleci stało się jasne, że w aktywności progesteronu pośredniczy nie tylko czynnik transkrypcyjny, ale także związany z błoną receptor sprzężony z białkiem G, oznaczony jako 7TMPR . Kiedy receptor jest aktywowany, blokuje on cyklazę adenylową , co prowadzi do zmniejszenia biosyntezy wewnątrzkomórkowego drugiego przekaźnika cAMP .
Mechanizmy niższego rzędu
Od lat 90. XX wieku było oczywiste, że dwa główne izomery receptorów, A i B, są funkcjonalnie odrębne w żeńskim układzie rozrodczym . Badania ukierunkowane na profil ekspresji izomerów sugerują, że izomery ulegają ekspresji w różnych tkankach w różnych momentach cyklu miesiączkowego . Stwierdzono, że PR-B jest regulowany w górę w zrębie i nabłonku gruczołowym podczas fazy folikularnej , ale jest regulowany w dół w obu tkankach podczas fazy lutealnej . Przeciwnie, PR-A jest regulowany w górę w obu typach tkanek w fazie folikularnej i utrzymuje się w tkance zrębowej podczas późnej fazy lutealnej. Badania wykazały, że aktywacja PR-B jest ważna dla wzrostu i rozwoju gruczołu sutkowego , podczas gdy PR-A odgrywa znaczącą rolę w normalnych funkcjach rozrodczych i owulacji . Również in vitro wykazały, że w identycznych warunkach PR-B działa jako silniejszy transaktywator genów reporterowych , podczas gdy PR-A jest zdolny do transrepresji PR-B i innych receptorów steroidowych. Znaleziono różne przyczyny tej różnorodności funkcji między izoformami. Przede wszystkim należy wspomnieć, że izoforma receptora progesteronu A nie zawiera 164 N-końcowych aminokwasów w porównaniu z izomerem B, co pozbawia go funkcji aktywacji AF-3 z powodu utraty segmentu B-upstream, co pozostawia mu tylko 2 funkcje aktywacji. Ponadto badania mechanizmu wykazały różnicę w rekrutacji kofaktorów między izoformami. Ze względu na te różnice funkcjonalne można zrozumieć, dlaczego istnieje zainteresowanie opracowaniem leku, który może selektywnie celować w izoformy receptora. W niektórych przypadkach rozwój SPRM koncentrował się na ukierunkowaniu na te dwie różne izoformy.
Interakcja SPRM z kieszeniami wiążącymi receptory
, że pewne interakcje między ligandem a receptorem progesteronu są ważne dla wiązania ligandu (ryc. 2). Badania krystalograficzne progesteronu związanego z jego receptorem ujawniły ważne oddziaływanie wiązaniami wodorowymi między grupą progesteronu odciągającą elektrony 3- keto a resztami Gln 725 helisy-3 i Arg 766 helisy-5, które są utrzymywane na miejscu przez strukturalną cząsteczkę wody. Wykazano, że ta interakcja występuje w interakcji z różnymi innymi ligandami, np. mifepristonem, tanaprogetem i asoprisnilem, a zatem może być uważana za interakcję istotną dla działania zarówno agonistów, jak i antagonistów. stwierdzono , że progesteron i tanaproget tworzą wiązanie wodorowe z Asn 719 w helisie-3, dając możliwość wyższej selektywności i powinowactwa, jednak stwierdzono, że asoprinil SPRM nie oddziałuje z tą resztą. Mimo że polarna pozostałość Thr 894 znajduje się blisko grupy karbonylowej C20 progesteronu , nie tworzy się żadne wiązanie wodorowe między tymi grupami chemicznymi. Należy zauważyć, że stwierdzono, że Thr 894 wchodzi w interakcje z innymi ligandami.
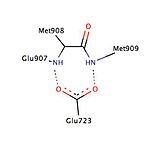
W różnych badaniach opisano obecność kieszeni hydrofobowej , określanej jako kieszeń 17α, która składa się z Leu 715 , Leu 718 , Phe 794 , Leu 797 , Met 801 i Tyr 890 i wydaje się zapewniać dodatkowe miejsce na ekspansję liganda niezależnie od agonizmu lub antagonizmu . Kieszeń 17α wraz z Met 756 i Met 759 w helisie-5, a także Met 909 , wykazują zaskakującą elastyczność w akomodacji różnych ligandów, czyniąc receptor progesteronu bardzo adaptacyjnym, jeśli chodzi o wiązanie. Badania porównujące zmiany konformacyjne helisy-12 przyczyniające się do efektów agonistycznych i antagonistycznych wykazały ważne oddziaływanie wodoru z Glu 723 helisy-3. W stanie nieaktywnym Glu 723 stabilizuje konformację helisy-12, tworząc wiązanie wodorowe z aminami łańcucha głównego w Met 908 i Met 909 . Kiedy ligand prowadzi efekt agonisty, taki jak oksym grupy asoprisnilu oddziałującej z kieszenią wiążącą agonisty, wówczas oddziaływanie wiązań wodorowych pomiędzy wspomnianymi wcześniej resztami w helisie-12 i helisie-3 wzmacnia się, prowadząc do dokowania i rekrutacji koaktywatorów. Jednak gdy antagonista, np. mifepriston, oddziałuje z tym układem wiązań wodorowych, wówczas jego dimetyloaminowa zderza się z Met 909 i destabilizuje helisę-12, powodując zmianę konformacyjną, która sprzyja rekrutacji korepresorów.
Mechanizm akcji
Kiedy SPRM wiążą się z receptorem progesteronu, równowaga między dwoma stanami konformacyjnymi jest bardziej zrównoważona, a zatem łatwiej zaburzona przez różnice w środowisku komórkowym. W tkankach, w których stężenie koaktywatorów jest wyższe niż korepresorów, nadmiar koaktywatorów kieruje równowagę w kierunku agonistycznym. I odwrotnie, w tkankach, w których stężenie korepresora jest wyższe, równowaga przesuwa się w kierunku antagonisty. Dlatego SPRM wykazują aktywność agonistyczną w tkankach, w których dominują koaktywatory, i aktywność antagonistyczną, w których korepresory są w nadmiarze.
Nieaktywny receptor progesteronowy, podobnie jak inne receptory steroidowe, tworzy kompleks składający się z samego siebie, białek szoku cieplnego (hsp70, hsp90) i immunofilin . Po aktywacji, z powodu wiązania hormonu z kieszenią wiążącą ligand, wykazano, że kompleks receptora dysocjuje, wyzwalając import jądrowy i nadając receptorowi właściwość dimeryzacji (ryc. 3). W jądrze dimer oddziałuje z elementem odpowiedzi hormonu progesteronowego w DNA powodując regulację w górę lub w dół genu. Różne badania wykazały, że wpływa na ekspresję nawet 100 różnych genów, w zależności od izomeru receptora. W działaniu agonizmu zachodzą zmiany konformacyjne, w których helisy alfa 3, 4 i 12 tworzą powierzchnię dokującą dla białek koaktywatorów, które działają jako czynniki pomostowe między receptorem a ogólną maszynerią transkrypcyjną. Jednak antagonista uniemożliwia właściwe upakowanie helisy alfa 12 względem helis 3 i 4, upośledzając zdolność receptora do interakcji z koaktywatorami, co umożliwia rekrutację korepresorów , takich jak SMRT i NCOR . Ze względu na minimalną rekrutację korepresorów podczas wiązania agonisty, Liu i in., 2002 postulowali, że stosunek między koaktywatorami a rekrutacją korepresorów może być wyznacznikiem tego, czy związek jest uważany za agonistę, antagonistę czy mieszanego agonistę. antagonista. Selektywne modulatory receptora progesteronu zostały opisane jako środki o mieszanej agonisty-antagonisty , a zatem mechanizm działania musi wynikać z równowagi tych funkcji.
Relacje struktura-aktywność
sterydowe SPRM
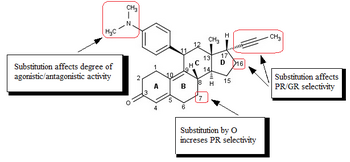
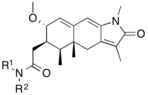
Badania nad analogami mifepristonu , skoncentrowane głównie na poprawie stosunku aktywności antyprogestagenowej/antyglukokortykoidowej, doprowadziły do odkrycia SPRM. Modyfikacje grupy 17-alfa-propinylowej lub w jej pobliżu (ryc. 4) na pierścieniu D odgrywają kluczową rolę w wiązaniu z receptorem progesteronu i/lub receptorem glukokortykoidowym. Niewielkie zmiany w regionie 17-alfa generują antyprogestyny o zmniejszonej aktywności antyglukokortykoidowej, gdzie alfa odnosi się do absolutnego stereodeskryptora sterydów. Wydaje się, że hydrofobowe podstawniki 17-alfa, takie jak 17-alfa etyl i 17-alfa (1'-pentynyl) powodują większą aktywność antyprogestagenną niż mifepriston. Podstawienie w pozycji 17-alfa obejmującej grupę fenylową małymi podstawnikami odciągającymi elektrony, takimi jak F i CF 3 , w pozycji para , również znacznie zwiększa selektywność w stosunku do receptora glukokortykoidowego, jak również siłę powstających związków. To samo podstawienie w orto - lub meta - prowadziło do zmniejszenia selektywności. Podstawniki o dużej objętości, takie jak tert -butyl, w tym regionie zmniejszają moc progesteronu.
Dostępne dane biologiczne i rentgenowskie sugerują, że podstawienie grupy 4-(dimetyloamino)fenylowej w pozycji C11 (ryc. 4) determinuje stopień aktywności agonistycznej i antagonistycznej. Małe podstawniki, takie jak metyl lub winyl, powodują silne właściwości agonistyczne receptora progesteronu, podczas gdy podstawione pochodne fenylowe wykazują różne stopnie aktywności antagonistycznej. Wskazuje się, że przy podstawieniu różnymi heterocyklami azotowymi najbardziej agonistycznymi są związki z wyraźnym maksimum w ujemnym potencjale elektrycznym w obszarze meta- i para - atomy pierścienia arylowego, natomiast związki pozbawione centrum elektroujemności w tym rejonie wykazują największą aktywność antagonistyczną.
Modyfikacja struktury rdzenia steroidowego wpływa na sposób wiązania się z receptorem progesteronowym. Zbadano substytucję C7 (ryc. 4) atomem tlenu i te oksasteroidy podobne do mifepristonu wykazywały zwiększoną selektywność w stosunku do receptora glukokortykoidowego, ale były słabsze niż mifepriston.
Niesteroidowe SPRM
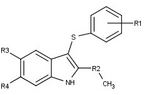
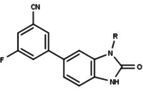
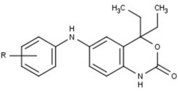
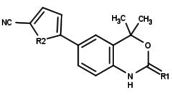
Modulatory receptora progesteronu o unikalnych strukturach niesteroidowych znajdują się obecnie na wczesnym etapie rozwoju (ryc. 5-12). Donoszono o różnorodności nowych typów antagonistów receptora progesteronu o różnym stopniu siły działania, które wykazują niezwykłą różnorodność strukturalną, co można zobaczyć w poniższej tabeli. Zidentyfikowano również różne związki ołowiu jako nowych agonistów receptora progesteronu. Można je również wyświetlić w tabeli.
| Antagoniści | |||||
|---|---|---|---|---|---|
| Agoniści |
Narkotyki
Członkowie obejmują:
- Octan uliprystalu („Ella”)
- Asoprisnil (J867; stan niepewny)
- Telapristone (CDB-4124; Proellex, Progenta; w fazie rozwoju)
SPRM sugerowano do wielu zastosowań ginekologicznych, takich jak antykoncepcja i antykoncepcja awaryjna, leczenie endometriozy , mięśniaków gładkich macicy oraz jako hormonalna terapia zastępcza u kobiet po menopauzie. W aktywności SPRM pośredniczy głównie receptor progesteronu, w którym znajduje się endometrium jest główną tkanką docelową. W przeciwieństwie do konwencjonalnych antagonistów progesteronu, SPRM eliminują możliwość przerwania ciąży ze względu na ich mieszany profil antagonista/agonista. Ponieważ SPRM mają niskie powinowactwo do receptora estrogenowego, nie uważa się, że powodują utratę masy kostnej związaną z okresem pomenopauzalnym. Stosowanie SPRM było związane z metaplazją endometrium , co wymaga długoterminowej oceny bezpieczeństwa.
| Mieszanina | Struktura chemiczna |
|---|---|
| Octan uliprystalu | Rysunek 13 |
| Asoprisnil | Rysunek 14 |
| telapriston | Rysunek 15 |
Octan uliprystalu
Octan uliprystalu (znany również jako CDB-2914) (ryc. 13) to SPRM podstawiony 11-β-arylem, który jest dostępny w Europie jako antykoncepcja awaryjna od 2009 r. i został zatwierdzony przez FDA w 2010 r. Jest również sprzedawany jako lek na macicę mięśniak gładkokomórkowy w Ameryce Północnej i Europie. Wykazano, że octan uliprystalu jako antykoncepcja awaryjna działa do 120 godzin po stosunku bez zabezpieczenia, w porównaniu z mocą obecnych środków antykoncepcyjnych do 72 godzin. Wydaje się, że w endometrium po menopauzie związek ten ma działanie antagonistyczne na receptor progesteronowy, co wskazuje na potencjalne zastosowanie w leczeniu menopauzy, ale nie zostało to jeszcze potwierdzone.
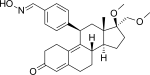
Asoprisnil
Asoprisnil (J867) jest steroidowym SPRM podstawionym 11β-benzaldoksymem (ryc. 14). Sugeruje się, że geometria jego grupy oksymowej odgrywa główną rolę w in vitro . Sugerowano, że jest to leczenie mięśniaka gładkokomórkowego i endometriozy i jest to pierwszy SPRM w rozwoju klinicznym leczenia endometriozy, który osiągnął zaawansowaną fazę.
telapriston
Telapriston (CDB-4124), znany również jako Proellex (ryc. 15), wszedł do II fazy badań klinicznych w leczeniu mięśniaków macicy w 2014 roku i ma zaplanowane badanie kliniczne II fazy dotyczące łagodzenia objawów endometriozy na początku 2016 roku. sugerowano, że mają działanie chemoprewencyjne.
Używa
SPRM są w trakcie opracowywania dla następujących zastosowań:
- Asoprisnil i telapriston są badane (2005) pod kątem leczenia mięśniaków gładkich macicy .
- Proellex ukończył szereg badań klinicznych w leczeniu endometriozy i mięśniaków macicy.
Chociaż te SPRM były skuteczne w leczeniu mięśniaków macicy, rozwój skutków ubocznych, takich jak pogrubienie endometrium, ograniczył ich podawanie do nie więcej niż trzech do czterech miesięcy.
Przyszły
Ze względu na działanie antyglukokortykoidowe, mifepriston jest badany pod kątem jego potencjału terapeutycznego we wskazaniach takich jak zespół Cushinga , choroba Alzheimera czy psychoza . Poza tym trwają prace nad SPRM do różnych zastosowań ginekologicznych, w tym antykoncepcji bezestrogenowej, mięśniaków gładkich macicy i endometriozy.