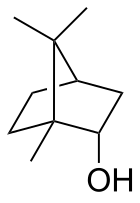
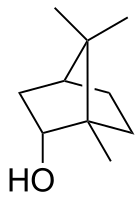
Borneol
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwa IUPAC
rel- (1R , 2S , 4R ) -1,7,7-Trimetylobicyklo[2.2.1]heptan-2-ol
|
|||
| Inne nazwy 1,7,7-trimetylobicyklo[2.2.1]heptan-2- endo -ol endo -2-bornanol, kamfora z Borneo |
|||
| Identyfikatory | |||
|
|||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.006.685 | ||
| Numer WE |
|
||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
| Numer ONZ | 1312 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C10H18O _ _ _ _ | |||
| Masa cząsteczkowa | 154,253 g·mol -1 | ||
| Wygląd | bezbarwne do białych grudek | ||
| Zapach | ostry , kamforowy | ||
| Gęstość | 1,011 g/cm3 ( 20°C) | ||
| Temperatura topnienia | 208 ° C (406 ° F; 481 K) | ||
| Temperatura wrzenia | 213 ° C (415 ° F; 486 K) | ||
| słabo rozpuszczalny ( forma D ) | |||
| Rozpuszczalność | rozpuszczalny w chloroformie , etanolu , acetonie , eterze , benzenie , toluenie , dekalinie , tetralinie | ||
| −1,26 × 10 −4 cm3 / mol | |||
| Zagrożenia | |||
| Oznakowanie GHS : | |||

|
|||
| Ostrzeżenie | |||
| H228 | |||
| P210 , P240 , P241 , P280 , P370+P378 | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 65 ° C (149 ° F; 338 K) | ||
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
Bornan (węglowodór) | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Borneol jest bicyklicznym związkiem organicznym i pochodną terpenu . Grupa hydroksylowa w tym związku jest umieszczona w pozycji endo . Diastereomer egzo nazywa się izoborneolem . Będąc chiralnym, borneol istnieje jako enancjomery , z których oba występują w przyrodzie.
Reakcje
Borneol utlenia się do ketonu ( kamfory ).
Występowanie
Związek ten został nazwany w 1842 roku przez francuskiego chemika Charlesa Frédérica Gerhardta . Borneol można znaleźć w kilku gatunkach Heterotheca , Artemisia , Rosmarinus officinalis ( rozmaryn ) Dipterocarpaceae , Blumea balsamifera i Kaempferia galanga .
Jest to jeden ze związków chemicznych występujących w kastoreum . Związek ten pozyskiwany jest z pokarmu roślinnego bobra.
Synteza
Borneol można zsyntetyzować przez redukcję kamfory przez redukcję Meerweina – Ponndorfa – Verleya (proces odwracalny) . Redukcja kamfory borowodorkiem sodu (szybka i nieodwracalna) daje w zamian diastereomer izoborneolu .
Używa
Podczas gdy d -borneol był enancjomerem , który był najłatwiej dostępny w handlu, obecnie bardziej dostępnym w handlu enancjomerem jest l -borneol, który również występuje w przyrodzie.
Borneol z Dipterocarpus spp. jest stosowany w tradycyjnej medycynie chińskiej . Wczesny opis znajduje się w Bencao Gangmu .
Borneol jest składnikiem wielu olejków eterycznych i jest naturalnym środkiem odstraszającym owady . Generuje również TRPM8 , podobne do mentolu .
Laevo-borneol jest stosowany w przemyśle perfumeryjnym. Ma balsamiczny zapach z sosnowymi, drzewnymi i kamforowymi akcentami.
Toksykologia
Borneol może powodować podrażnienie oczu, skóry i dróg oddechowych; jest szkodliwy w przypadku połknięcia. Ostra ekspozycja może powodować bóle głowy, nudności, wymioty, zawroty głowy, zawroty głowy i omdlenia. Narażenie na wyższe poziomy lub przez dłuższy czas może powodować niepokój, trudności z koncentracją, drażliwość i drgawki.
Podrażnienie skóry
Wykazano, że Borneol ma niewielkie lub żadne działanie drażniące po nałożeniu na ludzką skórę w dawkach stosowanych w delikatnych preparatach zapachowych. Kontakt ze skórą może prowadzić do uczulenia i przyszłej reakcji alergicznej nawet przy niewielkich ilościach.
Pochodne
Grupa bornylowa jest jednowartościowym rodnikiem C10H17 pochodzącym z borneolu przez usunięcie hydroksylu i jest również znana jako 2- bornyl . Isobornyl to jednowartościowy rodnik C10H17 , który pochodzi z izoborneolu. Izomer strukturalny fencholu jest również szeroko stosowanym związkiem pochodzącym z niektórych olejków eterycznych .
Octan bornylu to ester octanowy borneolu.