Etanol
|
|
|||
|
|
|||

|
|||
| Nazwy | |||
|---|---|---|---|
| Wymowa | / ˈ ɛ θ ə n ɒ l / | ||
|
Preferowana nazwa IUPAC
Etanol |
|||
| Inne nazwy alkohol absolutny alkohol woda kolońska spirytus pitny alkohol etylowy EtOH alkohol etylowy wodzian etylu wodorotlenek etylu etylol alkohol zbożowy hydroksyetan metylokarbinol |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| 1718733 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Bank Leków | |||
| Karta informacyjna ECHA | 100.000.526 | ||
| 787 | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
| Numer ONZ | ONZ 1170 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C2H6O _ _ _ _ | |||
| Masa cząsteczkowa | 46,069 g · mol -1 | ||
| Wygląd | Bezbarwna ciecz | ||
| Zapach | winny, ostry | ||
| Gęstość | 0,78945 g/cm3 ( przy 20 °C) | ||
| Temperatura topnienia | −114,14 ± 0,03 ° C (-173,45 ± 0,05 ° F; 159,01 ± 0,03 K) | ||
| Temperatura wrzenia | 78,23 ± 0,09 ° C (172,81 ± 0,16 ° F; 351,38 ± 0,09 K) | ||
| Mieszalny | |||
| dziennik P | −0,18 | ||
| Ciśnienie pary | 5,95 kPa (przy 20°C) | ||
| Kwasowość ( p Ka ) | 15,9 (H2O ) , 29,8 (DMSO) | ||
| −33,60·10 −6 cm 3 /mol | |||
|
Współczynnik załamania światła ( n D )
|
1.3611 | ||
| Lepkość | 1,2 mPa·s (przy 20°C), 1,074 mPa·s (przy 25°C) | ||
| 1,69 D | |||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H225 , H319 | |||
| P210 , P233 , P240 , P241 , P242 , P305+P351+P338 | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 14 °C (bezwzględna) | ||
| Śmiertelna dawka lub stężenie (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
7340 mg/kg (doustnie, szczur) 7300 mg/kg (mysz) |
||
| NIOSH (limity ekspozycji na zdrowie w USA): | |||
|
PEL (dopuszczalny)
|
TWA 1000 ppm (1900 mg/m 3 ) | ||
|
REL (zalecane)
|
TWA 1000 ppm (1900 mg/m 3 ) | ||
|
IDLH (bezpośrednie zagrożenie)
|
ND | ||
| Karta charakterystyki (SDS) | |||
| Związki pokrewne | |||
|
Związki pokrewne
|
Etan Metanol |
||
| Strona danych uzupełniających | |||
| Etanol (strona danych) | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
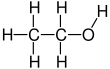
Etanol (w skrócie EtOH ; zwany także alkoholem etylowym , alkoholem zbożowym , alkoholem pitnym lub po prostu alkoholem ) jest związkiem organicznym . Jest to alkohol o wzorze chemicznym C 2 H 6 O . Jego wzór można również zapisać jako CH 3 −CH 2 −OH lub C 2 H 5 OH ( grupa etylowa połączona z grupą hydroksylową ). Etanol jest lotną , łatwopalną , bezbarwną cieczą o charakterystycznym winnym zapachu i ostrym smaku. Jest psychoaktywnym narkotykiem rekreacyjnym i aktywnym składnikiem napojów alkoholowych .
Etanol jest naturalnie wytwarzany w procesie fermentacji cukrów przez drożdże lub w procesach petrochemicznych , takich jak uwodnienie etylenu . Historycznie był używany jako środek znieczulający i ma nowoczesne zastosowania medyczne jako środek antyseptyczny , dezynfekujący , rozpuszczalnik niektórych leków i antidotum na zatrucie metanolem i glikolem etylenowym . Stosowany jest jako rozpuszczalnik chemiczny iw syntezie związków organicznych oraz jako źródło paliwa . Etanol można również odwodnić w celu wytworzenia etylenu, ważnego surowca chemicznego. W 2006 roku światowa produkcja etanolu wynosiła 51 gigalitrów (1,3 × 10 10 galonów amerykańskich) i pochodziła głównie z Brazylii i Stanów Zjednoczonych
Etymologia
Etanol to systematyczna nazwa zdefiniowana przez Międzynarodową Unię Chemii Czystej i Stosowanej dla związku składającego się z grupy alkilowej z dwoma atomami węgla (przedrostek „eth-”), między którymi występuje pojedyncze wiązanie (wrostek „-an-”) i dołączona grupa funkcyjna −OH (przyrostek „-ol”).
Przedrostek „eth-” i kwalifikator „etyl” w „alkoholu etylowym” pochodzą pierwotnie od nazwy „etyl” nadanej w 1834 r. grupie C
2 H
5 − przez Justusa Liebiga . Ukuł to słowo od niemieckiej nazwy Aether związku C
2 H
5 −O− C
2 H
5 (powszechnie zwanego „eterem” w języku angielskim , a dokładniej „ eterem dietylowym ”). Według Oxford English Dictionary , etyl jest skrótem od starogreckiego αἰθήρ ( aithḗr , „górne powietrze”) i greckiego słowa ὕλη ( hýlē , „substancja”).
Nazwa etanol powstała w wyniku rezolucji w sprawie nazewnictwa alkoholi i fenoli, przyjętej na Międzynarodowej Konferencji Nomenklatury Chemicznej, która odbyła się w kwietniu 1892 roku w Genewie w Szwajcarii.
Termin alkohol odnosi się teraz do szerszej klasy substancji w nomenklaturze chemicznej, ale w mowie potocznej pozostaje nazwą etanolu. Jest to średniowieczna pożyczka z arabskiego al-kuḥl , sproszkowana ruda antymonu używana od starożytności jako kosmetyk i zachowała to znaczenie w środkowej łacinie . Użycie słowa „alkohol” zamiast etanolu (w całości „alkohol winny”) jest współczesne i po raz pierwszy zostało odnotowane w 1753 r. Przed końcem XVIII wieku termin „alkohol” ogólnie odnosił się do każdej sublimowanej substancji.
Używa
Medyczny
Znieczulający
Etanol jest najstarszym znanym środkiem uspokajającym , stosowanym jako doustny środek znieczulający podczas operacji w starożytnej Mezopotamii iw średniowieczu . Łagodne zatrucie rozpoczyna się przy stężeniu alkoholu we krwi 0,03-0,05% i wywołuje śpiączkę znieczulającą przy stężeniu 0,4%. Jednak takie użycie wiązało się z wysokim ryzykiem śmiertelnego zatrucia alkoholem i zachłyśnięcia się wymiocinami, co doprowadziło w starożytności do stosowania alternatyw, takich jak opium i konopie indyjskie , a później eter dietylowy, począwszy od lat czterdziestych XIX wieku.
Antyseptyczny
Etanol jest stosowany w chusteczkach medycznych i najczęściej w antybakteryjnych żelach do dezynfekcji rąk jako środek antyseptyczny ze względu na swoje działanie bakteriobójcze i przeciwgrzybicze. Etanol zabija mikroorganizmy rozpuszczając ich dwuwarstwę lipidową w błonie komórkowej i denaturując ich białka , i jest skuteczny przeciwko większości bakterii , grzybów i wirusów . Jest jednak nieskuteczny wobec przetrwalników bakteryjnych , ale można to złagodzić, stosując nadtlenek wodoru . Roztwór 70% etanolu jest bardziej skuteczny niż czysty etanol, ponieważ etanol opiera się na cząsteczkach wody w celu uzyskania optymalnej aktywności przeciwdrobnoustrojowej. Bezwzględny etanol może dezaktywować drobnoustroje bez ich niszczenia, ponieważ alkohol nie jest w stanie w pełni przeniknąć przez błonę drobnoustroju. Etanol może być również stosowany jako środek dezynfekujący i antyseptyczny, ponieważ powoduje odwodnienie komórek poprzez zakłócenie równowagi osmotycznej w błonie komórkowej, więc woda opuszcza komórkę, co prowadzi do śmierci komórki.
Antidotum
Etanol można podawać jako antidotum na zatrucie glikolem etylenowym i metanolem . Etanol służy temu procesowi, działając jako konkurencyjny inhibitor dehydrogenazy alkoholowej przeciwko metanolowi i glikolowi etylenowemu . Chociaż ma więcej skutków ubocznych, etanol jest tańszy i łatwiej dostępny niż fomepizol , który jest również stosowany jako antidotum na zatrucie metanolem i glikolem etylenowym.
Rozpuszczalnik leczniczy
Etanol, często w wysokich stężeniach, służy do rozpuszczania wielu nierozpuszczalnych w wodzie leków i związków pokrewnych. Na przykład płynne preparaty leków przeciwbólowych , leków na kaszel i przeziębienie oraz płyny do płukania ust mogą zawierać do 25% etanolu i może być konieczne ich unikanie u osób z niepożądanymi reakcjami na etanol, takimi jak reakcje oddechowe wywołane alkoholem . Etanol występuje głównie jako przeciwdrobnoustrojowy środek konserwujący w ponad 700 płynnych preparatach leków, w tym acetaminofenie , suplementach żelaza , ranitydynie , furosemidzie , mannitolu , fenobarbitalu , trimetoprimie/sulfametoksazolu i dostępnych bez recepty lekach na kaszel .
Farmakologia
U ssaków etanol jest metabolizowany głównie w wątrobie i żołądku przez enzymy dehydrogenazy alkoholowej (ADH). Enzymy te katalizują utlenianie etanolu do aldehydu octowego (etanal):
- CH 3 CH 2 OH + NAD + → CH 3 CHO + NADH + H +
W przypadku obecności w znacznych stężeniach ten metabolizm etanolu jest dodatkowo wspomagany przez enzym CYP2E1 cytochromu P450 u ludzi, podczas gdy śladowe ilości są również metabolizowane przez katalazę .
Powstały związek pośredni, aldehyd octowy, jest znanym czynnikiem rakotwórczym i ma znacznie większą toksyczność dla ludzi niż sam etanol. Wiele objawów zwykle związanych z zatruciem alkoholem - jak również wiele zagrożeń dla zdrowia zwykle związanych z długotrwałym spożywaniem etanolu - można przypisać toksyczności aldehydu octowego u ludzi.
Późniejsze utlenianie aldehydu octowego do octanu jest przeprowadzane przez enzymy dehydrogenazy aldehydowej (ALDH). Mutacja w genie ALDH2, który koduje nieaktywną lub dysfunkcyjną postać tego enzymu, dotyka około 50% populacji wschodnioazjatyckich, przyczyniając się do charakterystycznej reakcji zaczerwienienia skóry , która może powodować przejściowe zaczerwienienie skóry, a także szereg powiązanych i często nieprzyjemne objawy zatrucia aldehydem octowym. Tej mutacji zwykle towarzyszy inna mutacja enzymu dehydrogenazy alkoholowej ADH1B u około 80% mieszkańców Azji Wschodniej, co poprawia wydajność katalityczną przekształcania etanolu w aldehyd octowy.
rekreacyjny
Jako środek depresyjny na ośrodkowy układ nerwowy , etanol jest jednym z najczęściej spożywanych środków psychoaktywnych .
rakotwórczych właściwości alkoholu , jest on łatwo dostępny i legalny w sprzedaży w większości krajów. Istnieją jednak przepisy regulujące sprzedaż, eksport/import, opodatkowanie, produkcję, konsumpcję i posiadanie napojów alkoholowych. Najczęściej spotykanym przepisem jest zakaz dla nieletnich.
Paliwo

Paliwo silnikowe
| Typ paliwa | MJ/L | MJ/kg |
Badaj liczbę oktanową |
|---|---|---|---|
| Suche drewno (20% wilgoci) | ~19,5 | ||
| Metanol | 17,9 | 19.9 | 108,7 |
| Etanol | 21.2 | 26,8 | 108,6 |
|
E85 (85% etanol, 15% benzyna) |
25.2 | 33.2 | 105 |
| Skroplony naturalny gaz | 25.3 | ~55 | |
|
Autogaz ( LPG ) (60% propan + 40% butan ) |
26,8 | 50 | |
|
Benzyna lotnicza (benzyna wysokooktanowa, nie paliwo do silników odrzutowych) |
33,5 | 46,8 | 100/130 (chude/bogate) |
|
Gasohol (90% benzyna + 10% etanol) |
33,7 | 47.1 | 93/94 |
| Zwykła benzyna/benzyna | 34,8 | 44,4 | min. 91 |
| Benzyna / benzyna premium | maks. 104 | ||
| Diesel | 38,6 | 45,4 | 25 |
| Węgiel drzewny , wytłaczany | 50 | 23 |
Największym jednorazowym zastosowaniem etanolu jest paliwo silnikowe i dodatek do paliw . W szczególności Brazylia w dużym stopniu polega na stosowaniu etanolu jako paliwa silnikowego, po części ze względu na swoją rolę jednego z wiodących światowych producentów etanolu. Benzyna sprzedawana w Brazylii zawiera co najmniej 25% bezwodnego etanolu. Uwodniony etanol (około 95% etanolu i 5% wody) może być stosowany jako paliwo w ponad 90% nowych samochodów benzynowych sprzedawanych w kraju.
W Stanach Zjednoczonych i wielu innych krajach stosuje się głównie mieszaniny etanolu i benzyny E10 (10% etanolu, czasami znane jako gazohol) i E85 (85% etanolu). Uważa się, że z biegiem czasu znaczna część rynku benzyny o wartości około 150 miliardów galonów amerykańskich (570 000 000 m3 ) rocznie zacznie być zastępowana paliwem etanolowym.

Australijskie prawo ogranicza użycie czystego etanolu z odpadów trzciny cukrowej do 10% w samochodach. Starsze samochody (i samochody zabytkowe zaprojektowane do spalania wolniej spalającego się paliwa) powinny mieć zmodernizowane lub wymienione zawory silnika.
Według branżowej grupy rzeczników etanol jako paliwo zmniejsza szkodliwą emisję tlenku węgla, cząstek stałych, tlenków azotu i innych zanieczyszczeń tworzących ozon z rury wydechowej. Argonne National Laboratory przeanalizowało emisje gazów cieplarnianych z wielu różnych silników i kombinacji paliw i stwierdziło, że mieszanka biodiesla i petrodiesel ( B20 ) wykazała redukcję o 8%, konwencjonalną mieszankę etanolu E85 o 17%, a etanol celulozowy o 64% w porównaniu z czystym benzyna. Etanol ma znacznie większą badawczą liczbę oktanową (RON) niż benzyna, co oznacza, że jest mniej podatny na przedwczesny zapłon, co pozwala na lepsze wyprzedzenie zapłonu, co oznacza większy moment obrotowy i wydajność oprócz niższej emisji dwutlenku węgla.
Spalanie etanolu w silniku spalinowym daje wiele produktów niecałkowitego spalania wytwarzanych przez benzynę i znacznie większe ilości formaldehydu i związków pokrewnych, takich jak aldehyd octowy. Prowadzi to do znacznie większej reaktywności fotochemicznej i większej ilości ozonu w warstwie przyziemnej . Dane te zostały zebrane w raporcie dotyczącym czystych paliw, porównując emisje z paliw i pokazują, że spaliny z etanolu wytwarzają 2,14 razy więcej ozonu niż spaliny z benzyny. Po dodaniu tego do niestandardowego wskaźnika lokalnego zanieczyszczenia (LPI) raportu o czystych paliwach, lokalne zanieczyszczenie etanolem (zanieczyszczenie, które przyczynia się do smogu) jest oceniane na 1,7, gdzie benzyna wynosi 1,0, a wyższe liczby oznaczają większe zanieczyszczenie. Kalifornijska Rada ds. Zasobów Powietrza sformalizowała tę kwestię w 2008 r., uznając normy kontroli formaldehydów za grupę kontrolującą emisje, podobnie jak konwencjonalne NOx i reaktywne gazy organiczne (ROG).
Ponad 20% brazylijskich samochodów może wykorzystywać 100% etanol jako paliwo, co obejmuje silniki zasilane wyłącznie etanolem i silniki typu flex-fuel . Silniki typu flex-fuel w Brazylii mogą pracować z każdym etanolem, całą benzyną lub dowolną mieszanką obu. W Stanach Zjednoczonych pojazdy typu flex-fuel mogą być napędzane etanolem o zawartości od 0% do 85% (15% benzyny), ponieważ mieszanki o wyższej zawartości etanolu nie są jeszcze dozwolone ani wydajne. Brazylia wspiera tę flotę samochodów spalających etanol dużą infrastrukturą krajową, która produkuje etanol z trzciny cukrowej uprawianej w kraju.
mieszalność etanolu z wodą sprawia, że nie nadaje się on do transportu nowoczesnymi rurociągami, takimi jak płynne węglowodory. Mechanicy zaobserwowali zwiększone przypadki uszkodzeń małych silników (w szczególności gaźnika ) i przypisują uszkodzenia zwiększonej retencji wody przez etanol w paliwie.
Paliwo rakietowe
Etanol był powszechnie używany jako paliwo we wczesnych pojazdach rakietowych na paliwo dwupaliwowe (napędzane cieczą), w połączeniu z utleniaczem , takim jak ciekły tlen. Niemiecka rakieta balistyczna A-4 z czasów II wojny światowej (lepiej znana pod propagandową nazwą V-2 ), której uważa się, że zapoczątkowała erę kosmiczną, wykorzystywała etanol jako główny składnik B-Stoff . W takiej nomenklaturze etanol mieszano z 25% wodą w celu obniżenia temperatury w komorze spalania. Zespół V-2 pomógł opracować amerykańskie rakiety po drugiej wojnie światowej, w tym napędzaną etanolem rakietę Redstone , która wyniosła pierwszego amerykańskiego satelitę. Alkohole wyszły z użycia, gdy opracowano paliwa rakietowe o większej gęstości energetycznej, chociaż etanol jest obecnie używany w lekkich samolotach wyścigowych z napędem rakietowym .
Ogniwa paliwowe
Komercyjne ogniwa paliwowe działają na reformowanym gazie ziemnym, wodorze lub metanolu. Etanol jest atrakcyjną alternatywą ze względu na jego szeroką dostępność, niski koszt, wysoką czystość i niską toksyczność. Istnieje wiele koncepcji ogniw paliwowych, które przeszły testy, w tym ogniwa paliwowe zasilane bezpośrednio etanolem , systemy autotermicznego reformingu i systemy zintegrowane termicznie. Większość prac prowadzona jest na poziomie badawczym, chociaż istnieje szereg organizacji, które rozpoczynają komercjalizację etanolowych ogniw paliwowych.
Ogrzewanie i gotowanie w gospodarstwie domowym
Kominki na etanol mogą służyć do ogrzewania domu lub do dekoracji. Etanol może być również używany jako paliwo do pieca do gotowania.
Surowiec
Etanol jest ważnym składnikiem przemysłowym. Ma szerokie zastosowanie jako prekursor innych związków organicznych, takich jak halogenki etylu , estry etylowe , eter dietylowy, kwas octowy i etyloaminy .
Rozpuszczalnik
Etanol jest uważany za uniwersalny rozpuszczalnik , ponieważ jego struktura molekularna pozwala na rozpuszczanie zarówno polarnych , hydrofilowych , jak i niepolarnych , hydrofobowych związków. Ponieważ etanol ma również niską temperaturę wrzenia , łatwo go usunąć z roztworu, który był używany do rozpuszczania innych związków, co czyni go popularnym środkiem do ekstrakcji olejków roślinnych. Metody ekstrakcji oleju konopnego często wykorzystują etanol jako rozpuszczalnik ekstrakcyjny, a także jako rozpuszczalnik po obróbce w celu usunięcia olejów, wosków i chlorofilu z roztworu w procesie znanym jako zimowanie .
Etanol znajduje się w farbach , nalewkach , markerach i produktach higieny osobistej, takich jak płyny do płukania ust, perfumy i dezodoranty. Polisacharydy wytrącają się z roztworu wodnego w obecności alkoholu iz tego powodu do oczyszczania DNA i RNA stosuje się wytrącanie etanolem .
Ciecz niskotemperaturowa
Ze względu na niską temperaturę zamarzania -114 ° C (-173 ° F) i niską toksyczność, etanol jest czasami używany w laboratoriach (z suchym lodem lub innymi chłodziwami) jako kąpiel chłodząca do utrzymywania naczyń w temperaturach poniżej punktu zamarzania wody . Z tego samego powodu jest również używany jako aktywny płyn w termometrach alkoholowych .
Chemia
Wzór chemiczny
Etanol to dwuwęglowy alkohol. Jego wzór cząsteczkowy to CH 3 CH 2 OH. Alternatywnym oznaczeniem jest CH 3 −CH 2 −OH, co wskazuje, że węgiel grupy metylowej (CH 3 −) jest przyłączony do węgla grupy metylenowej (−CH 2 –), która jest przyłączona do atomu tlenu grupa hydroksylowa (-OH). Jest izomerem konstytucyjnym eteru dimetylowego . Etanol jest czasami określany skrótem EtOH , przy użyciu powszechnej notacji chemii organicznej przedstawiającej grupę etylową (C 2 H 5 -) z Et .
Właściwości fizyczne
Etanol jest lotną, bezbarwną cieczą o lekkim zapachu. Pali się bezdymnym niebieskim płomieniem, który nie zawsze jest widoczny w normalnym świetle. Fizyczne właściwości etanolu wynikają przede wszystkim z obecności w nim grupy hydroksylowej oraz krótkiego łańcucha węglowego. Grupa hydroksylowa etanolu może uczestniczyć w wiązaniu wodorowym, czyniąc go bardziej lepkim i mniej lotnym niż mniej polarne związki organiczne o podobnej masie cząsteczkowej, takie jak propan .
Adiabatyczna temperatura płomienia etanolu do spalania w powietrzu wynosi 2082 ° C lub 3779 ° F.
Etanol jest nieco bardziej refrakcyjny niż woda i ma współczynnik załamania światła 1,36242 (przy λ = 589,3 nm i 18,35 ° C lub 65,03 ° F). Punkt potrójny dla etanolu wynosi 150 K pod ciśnieniem 4,3 × 10-4 Pa .
Właściwości rozpuszczalnika
Etanol jest wszechstronnym rozpuszczalnikiem, miesza się z wodą i wieloma rozpuszczalnikami organicznymi, w tym z kwasem octowym , acetonem , benzenem , tetrachlorkiem węgla , chloroformem , eterem dietylowym , glikolem etylenowym, glicerolem , nitrometanem , pirydyną i toluenem . Jego głównym zastosowaniem jako rozpuszczalnika jest wytwarzanie nalewek jodowych, syropów na kaszel itp. Miesza się również z lekkimi węglowodorami alifatycznymi, takimi jak pentan i heksan , oraz z chlorkami alifatycznymi, takimi jak trichloroetan i tetrachloroetylen .
Mieszalność etanolu z wodą kontrastuje z niemieszalnością alkoholi o dłuższych łańcuchach (pięć lub więcej atomów węgla), których mieszalność z wodą gwałtownie spada wraz ze wzrostem liczby atomów węgla. Mieszalność etanolu z alkanami jest ograniczona do alkanów aż do undekanu : mieszaniny z dodekanem i wyższymi alkanami wykazują lukę mieszalności poniżej pewnej temperatury (około 13°C dla dodekanu). Luka mieszalności ma tendencję do powiększania się przy wyższych alkanach, a temperatura pełnej mieszalności wzrasta.
Mieszaniny etanol-woda mają mniejszą objętość niż suma ich poszczególnych składników przy danych ułamkach. Mieszanie równych objętości etanolu i wody daje tylko 1,92 objętości mieszaniny. Mieszanie etanolu i wody jest egzotermiczne , przy 298 K uwalnia się do 777 J/mol.
Mieszaniny etanolu i wody tworzą azeotrop przy około 89% molowych etanolu i 11% molowych wody lub mieszaninę 95,6% masowych etanolu (lub około 97% objętościowych alkoholu ) pod normalnym ciśnieniem, który wrze w temperaturze 351 K (78 °C). Ten skład azeotropowy jest silnie zależny od temperatury i ciśnienia i zanika w temperaturach poniżej 303 K.
Wiązania wodorowe powodują, że czysty etanol jest higroskopijny do tego stopnia, że łatwo absorbuje wodę z powietrza. Polarny charakter grupy hydroksylowej powoduje, że etanol rozpuszcza wiele związków jonowych, zwłaszcza wodorotlenki sodu i potasu , chlorek magnezu , chlorek wapnia , chlorek amonu , bromek amonu i bromek sodu . Chlorki sodu i potasu są słabo rozpuszczalne w etanolu. Ponieważ cząsteczka etanolu ma również niepolarny koniec, rozpuszcza również substancje niepolarne, w tym większość olejków eterycznych oraz liczne środki smakowe, barwiące i lecznicze.
Dodatek nawet kilku procent etanolu do wody gwałtownie obniża napięcie powierzchniowe wody. Ta właściwość częściowo wyjaśnia zjawisko „ łzami wina ”. Kiedy wino jest wirowane w kieliszku, etanol szybko odparowuje z cienkiej warstwy wina na ściankach kieliszka. Wraz ze spadkiem zawartości etanolu w winie wzrasta jego napięcie powierzchniowe, a cienka warstwa „skleja się” i spływa po szkle kanałami, a nie gładką taflą.
Palność
Roztwór etanolu i wody zapali się, jeśli zostanie podgrzany powyżej temperatury zwanej jego temperaturą zapłonu , a następnie zostanie do niego przyłożone źródło zapłonu. W przypadku 20% masowych alkoholu (około 25% objętościowych) nastąpi to w temperaturze około 25 ° C (77 ° F). Temperatura zapłonu czystego etanolu wynosi 13 ° C (55 ° F), ale może na nią nieznacznie wpływać skład atmosfery, taki jak ciśnienie i wilgotność. Mieszaniny etanolu mogą zapalić się poniżej średniej temperatury pokojowej. Etanol jest uznawany za ciecz łatwopalną (materiał niebezpieczny klasy 3) w stężeniu powyżej 2,35% masowych (3,0% objętościowych; 6 dowodów ).
|
Ułamek masowy etanolu , % |
Temperatura | |
|---|---|---|
| °C | ° F | |
| 1 | 84,5 | 184.1 |
| 2 | 64 | 147 |
| 2.35 | 60 | 140 |
| 3 | 51,5 | 124,7 |
| 5 | 43 | 109 |
| 6 | 39,5 | 103.1 |
| 10 | 31 | 88 |
| 20 | 25 | 77 |
| 30 | 24 | 75 |
| 40 | 21.9 | 71,4 [ potrzebne źródło ] |
| 50 | 20 | 68 |
| 60 | 17,9 | 64,2 [ potrzebne źródło ] |
| 70 | 16 | 61 |
| 80 | 15.8 | 60,4 |
| 90 | 14 | 57 |
| 100 | 12,5 | 54,5 |
Potrawy wykorzystujące płonący alkohol do uzyskania efektów kulinarnych nazywane są flambé .
Występowanie naturalne
Etanol jest produktem ubocznym procesu metabolicznego drożdży. W związku z tym etanol będzie obecny w każdym środowisku drożdży. Etanol można powszechnie znaleźć w przejrzałych owocach. Etanol wytwarzany przez symbiotyczne drożdże można znaleźć w palmy bertam . Chociaż niektóre gatunki zwierząt, takie jak ryjówka ostrogoniasta , wykazują zachowania związane z poszukiwaniem etanolu, większość nie wykazuje zainteresowania ani unikania źródeł pożywienia zawierających etanol. Etanol powstaje również podczas kiełkowania wielu roślin w wyniku naturalnej beztlenowości . W przestrzeni kosmicznej wykryto etanol , który tworzy lodową powłokę wokół ziaren pyłu w obłokach międzygwiazdowych . Znikome ilości (średnio 196 ppb ) endogennego etanolu i aldehydu octowego stwierdzono w wydychanym powietrzu zdrowych ochotników. Zespół autobrowaru , znany również jako zespół fermentacji jelitowej, jest rzadkim schorzeniem, w którym w wyniku endogennej fermentacji w układzie pokarmowym wytwarzane są odurzające ilości etanolu .
Produkcja
Etanol jest wytwarzany zarówno jako produkt petrochemiczny , poprzez uwodnienie etylenu , jak i poprzez procesy biologiczne, poprzez fermentację cukrów z drożdżami . To, który proces jest bardziej ekonomiczny, zależy od panujących cen ropy naftowej i surowców zbożowych.
Źródła
Światowa produkcja etanolu w 2006 roku wyniosła 51 gigalitrów (1,3 × 10 10 galonów amerykańskich), przy czym 69 % światowej podaży pochodziło z Brazylii i USA . paliw kopalnych wykorzystywanych do jej produkcji) w porównaniu z niektórymi innymi uprawami energetycznymi . Trzcina cukrowa nie tylko ma większe stężenie sacharozy niż kukurydza (o około 30%), ale jest też znacznie łatwiejsza do ekstrakcji. Bagassa wytworzona w tym procesie nie jest wyrzucana, ale spalana przez elektrownie w celu wytworzenia energii elektrycznej . Spalanie bagassy odpowiada za około 9% energii elektrycznej produkowanej w Brazylii.
W latach 70. większość etanolu przemysłowego w USA była wytwarzana jako petrochemia, ale w latach 80. Stany Zjednoczone wprowadziły dotacje do etanolu na bazie kukurydzy . Według Renewable Fuels Association, na dzień 30 października 2007 r. 131 biorafinerii etanolu ze zboża w USA ma zdolność produkowania 7 × 10 9 galonów amerykańskich (26 000 000 m 3 ) etanolu rocznie. Dodatkowe 72 projekty budowlane będące w toku (w USA) mogą zwiększyć moce produkcyjne o 6,4 miliarda galonów amerykańskich (24 000 000 m 3 ) w ciągu następnych 18 miesięcy.
W Indiach etanol jest wytwarzany z trzciny cukrowej. Słodkie sorgo jest kolejnym potencjalnym źródłem etanolu i nadaje się do uprawy na terenach suchych. International Crops Research Institute for the Semi-Arid Tropics bada możliwość uprawy sorgo jako źródła paliwa, pożywienia i paszy dla zwierząt w suchych częściach Azji i Afryki . Słodkie sorgo ma jedną trzecią zapotrzebowania na wodę trzciny cukrowej w tym samym okresie. Wymaga również około 22% mniej wody niż kukurydza. Pierwsza na świecie destylarnia etanolu ze słodkiego sorgo rozpoczęła produkcję komercyjną w 2007 roku w Andhra Pradesh w Indiach .
Uwodnienie
Etanol można wytwarzać z surowców petrochemicznych , głównie w wyniku katalizowanej kwasem hydratacji etylenu . Jest często określany jako syntetyczny etanol.
Katalizatorem jest najczęściej kwas fosforowy adsorbowany na porowatym podłożu, takim jak żel krzemionkowy lub ziemia okrzemkowa . Katalizator ten został po raz pierwszy użyty do produkcji etanolu na dużą skalę przez firmę Shell Oil Company w 1947 r. Reakcję przeprowadza się w obecności pary wodnej pod wysokim ciśnieniem w temperaturze 300 ° C (572 ° F), gdzie stosunek etylenu do pary wynosi 5: 3 utrzymany. Proces ten był stosowany na skalę przemysłową przez Union Carbide Corporation i innych. Nie jest to już praktykowane w USA, ponieważ etanol fermentacyjny wytwarzany z kukurydzy jest bardziej ekonomiczny.
W starszym procesie, po raz pierwszy praktykowanym na skalę przemysłową w 1930 r. Przez Union Carbide, ale obecnie prawie całkowicie przestarzałym, etylen był pośrednio uwodniony w reakcji ze stężonym kwasem siarkowym w celu wytworzenia siarczanu etylu , który poddano hydrolizie w celu uzyskania etanolu i regeneracji kwasu siarkowego:
Z dwutlenku węgla
Etanol został wyprodukowany w laboratorium poprzez konwersję dwutlenku węgla w reakcjach biologicznych i elektrochemicznych .
2 O → CH
3 CH
2 O H + produkty uboczne
Fermentacja
Etanol w napojach alkoholowych i paliwie jest wytwarzany w procesie fermentacji. Niektóre gatunki drożdży (np. Saccharomyces cerevisiae ) metabolizują cukier , wytwarzając etanol i dwutlenek węgla. Poniższe równania chemiczne podsumowują konwersję:
6 H
12 O
6 → 2 CH
3 CH
2 O H + 2 CO 2
Fermentacja to proces hodowli drożdży w sprzyjających warunkach termicznych w celu wytworzenia alkoholu. Proces ten przeprowadza się w temperaturze około 35–40 ° C (95–104 ° F). Toksyczność etanolu dla drożdży ogranicza stężenie etanolu możliwe do uzyskania przez warzenie; dlatego wyższe stężenia uzyskuje się przez fortyfikację lub destylację . Najbardziej tolerujące etanol szczepy drożdży mogą przetrwać do około 18% objętościowych etanolu.
Aby wyprodukować etanol z materiałów skrobiowych, takich jak zboża , skrobię należy najpierw przekształcić w cukry. W warzeniu piwa tradycyjnie osiąga się to poprzez umożliwienie kiełkowania ziarna lub słodu , który wytwarza enzym amylazę . Kiedy słodowane ziarno jest zacierane , amylaza przekształca pozostałe skrobie w cukry.
Celuloza
Cukry do fermentacji etanolowej można otrzymać z celulozy . Wdrożenie tej technologii mogłoby zamienić wiele rolniczych produktów ubocznych zawierających celulozę, takich jak kolby kukurydzy , słoma i trociny , w odnawialne źródła energii. Inne pozostałości rolnicze, takie jak wytłoczyny z trzciny cukrowej i rośliny energetyczne, takie jak proso rózgowe , również mogą być źródłami cukru ulegającego fermentacji.
Testowanie

Browary i wytwórnie biopaliw stosują dwie metody pomiaru stężenia etanolu. Czujniki etanolu na podczerwień mierzą częstotliwość drgań rozpuszczonego etanolu za pomocą pasma C-H przy 2900 cm -1 . Ta metoda wykorzystuje stosunkowo niedrogi czujnik półprzewodnikowy, który porównuje pasmo C-H z pasmem odniesienia w celu obliczenia zawartości etanolu. Obliczenia wykorzystują prawo Beera-Lamberta . Alternatywnie, mierząc gęstość materiału wyjściowego i gęstość produktu za pomocą areometru , zmiana ciężaru właściwego podczas fermentacji wskazuje zawartość alkoholu. Ta niedroga i pośrednia metoda ma długą historię w branży piwowarskiej.
Oczyszczenie
Destylacja
Hydratacja lub warzenie etylenu daje mieszaninę etanolu i wody. W przypadku większości zastosowań przemysłowych i paliwowych etanol musi zostać oczyszczony. Destylacja frakcyjna pod ciśnieniem atmosferycznym może zatężyć etanol do 95,6% wagowych (89,5% molowych). Ta mieszanina jest azeotropem o temperaturze wrzenia 78,1 ° C (172,6 ° F) i nie może być dalej oczyszczana przez destylację. Dodatek środka porywającego, takiego jak benzen , cykloheksan lub heptan , umożliwia utworzenie nowego trójskładnikowego azeotropu zawierającego etanol, wodę i środek porywający. Ten niskowrzący trójskładnikowy azeotrop jest preferencyjnie usuwany, co prowadzi do etanolu bez wody.
Sita molekularne i osuszacze
Oprócz destylacji etanol można wysuszyć przez dodanie środka osuszającego , takiego jak sita molekularne , celuloza lub mąka kukurydziana . Osuszacze można wysuszyć i ponownie użyć. Sita molekularne mogą służyć do selektywnego wchłaniania wody z 95,6% roztworu etanolu. Sita molekularne o wielkości porów 3 angstremów , rodzaj zeolitu , skutecznie sekwestrują cząsteczki wody, jednocześnie wykluczając cząsteczki etanolu. Podgrzanie mokrych sit wypiera wodę, umożliwiając regenerację ich zdolności pochłaniania wilgoci.
Membrany i odwrócona osmoza
Membrany można również stosować do oddzielania etanolu i wody. Separacje oparte na membranach nie podlegają ograniczeniom azeotropu woda-etanol, ponieważ separacje nie są oparte na równowagach para-ciecz. Membrany są często stosowane w tzw. procesie hybrydowej destylacji membranowej. Proces ten wykorzystuje kolumnę destylacyjną ze wstępnym zatężaniem jako pierwszy etap rozdzielania. Dalsza separacja jest następnie realizowana za pomocą membrany działającej albo w trybie przepuszczania pary, albo w trybie perwaporacji. Przenikanie pary wykorzystuje zasilanie membraną parową, a perwaporację wykorzystuje zasilanie płynną membraną.
Inne techniki
Omówiono wiele innych technik, w tym następujące:
- Solenie przy użyciu węglanu potasu w celu wykorzystania jego nierozpuszczalności spowoduje rozdzielenie faz z etanolem i wodą. Zapewnia to bardzo małe zanieczyszczenie alkoholem węglanem potasu, które można usunąć przez destylację. Ta metoda jest bardzo przydatna w oczyszczaniu etanolu przez destylację, ponieważ etanol tworzy azeotrop z wodą.
- Bezpośrednia redukcja elektrochemiczna dwutlenku węgla do etanolu w warunkach otoczenia z użyciem nanocząstek miedzi na warstwie nanocząstek węgla jako katalizatora;
- Ekstrakcja etanolu z zacieru zbożowego dwutlenkiem węgla w stanie nadkrytycznym ;
- Perwaporacja ;
- Zamrażanie frakcyjne służy również do zagęszczania sfermentowanych roztworów alkoholowych, takich jak tradycyjnie wytwarzany Applejack (napój) ;
- Adsorpcja zmiennociśnieniowa .
Stopnie etanolu
Alkohol denaturat
Czysty etanol i napoje alkoholowe są mocno opodatkowane jako leki psychoaktywne, ale etanol ma wiele zastosowań, które nie wiążą się z jego spożyciem. Aby zmniejszyć obciążenie podatkowe związane z tymi zastosowaniami, większość jurysdykcji uchyla podatek, gdy do etanolu dodano środek, aby uczynić go niezdatnym do picia. Należą do nich środki gorzkie , takie jak benzoesan denatonium i toksyny, takie jak metanol, nafta i pirydyna . Produkty tego rodzaju nazywane są alkoholami denaturowanymi.
Absolutny alkohol
Bezwodny lub bezwodny alkohol odnosi się do etanolu o niskiej zawartości wody. Istnieją różne gatunki o maksymalnej zawartości wody w zakresie od 1% do kilku części na milion (ppm). Jeśli destylacja azeotropowa , będzie ona zawierać śladowe ilości środka rozdzielającego materiały (np. benzen). Alkohol absolutny nie jest przeznaczony do spożycia przez ludzi. Etanol absolutny jest używany jako rozpuszczalnik w zastosowaniach laboratoryjnych i przemysłowych, gdzie woda reaguje z innymi chemikaliami, oraz jako alkohol paliwowy. Etanol spektroskopowy to etanol absolutny o niskiej absorbancji w ultrafioletowym i widzialnym, nadający się do stosowania jako rozpuszczalnik w spektroskopii w zakresie widzialnym i ultrafiolecie .
Czysty etanol jest klasyfikowany jako dowód 200 w USA, co odpowiada 175 stopniom w systemie brytyjskim.
Spirytus rektyfikowany
Spirytus rektyfikowany, azeotropowy skład 96% etanolu zawierający 4% wody, jest używany zamiast bezwodnego etanolu do różnych celów. Wino spirytusowe zawiera około 94% etanolu (188 dowód). Zanieczyszczenia różnią się od tych w 95% (190 proof) laboratoryjnym etanolu.
Reakcje
Etanol jest klasyfikowany jako alkohol pierwszorzędowy, co oznacza, że węgiel, do którego przyłącza się jego grupa hydroksylowa, ma również przyłączone co najmniej dwa atomy wodoru. Wiele reakcji etanolu zachodzi na jego grupie hydroksylowej.
Tworzenie estrów
W obecności katalizatorów kwasowych etanol reaguje z kwasami karboksylowymi , tworząc estry etylowe i wodę:
- RCOOH + HOCH 2 CH 3 → RCOOCH 2 CH 3 + H 2 O
Ta reakcja, która jest prowadzona na dużą skalę przemysłową, wymaga usunięcia wody z mieszaniny reakcyjnej podczas jej tworzenia. Estry reagują w obecności kwasu lub zasady, dając z powrotem alkohol i sól. Ta reakcja jest znana jako zmydlanie , ponieważ jest używana do przygotowania mydła. Etanol może również tworzyć estry z kwasami nieorganicznymi. Siarczan dietylu i fosforan trietylu wytwarza się przez traktowanie etanolu odpowiednio trójtlenkiem siarki i pięciotlenkiem fosforu . Siarczan dietylu jest użytecznym środkiem etylującym w syntezie organicznej . Azotyn etylu , otrzymywany w reakcji etanolu z azotynem sodu i kwasem siarkowym, był dawniej stosowany jako środek moczopędny .
Odwodnienie
W obecności katalizatorów kwasowych alkohole można przekształcić w alkeny, takie jak etanol w etylen. Zwykle stosuje się kwasy stałe , takie jak tlenek glinu .
- CH3CH2OH → H2C = CH2 + H2O _ _ _ _
Ponieważ woda jest usuwana z tej samej cząsteczki, reakcja ta jest znana jako odwodnienie wewnątrzcząsteczkowe . Wewnątrzcząsteczkowe odwodnienie alkoholu wymaga wysokiej temperatury i obecności kwaśnego katalizatora, takiego jak kwas siarkowy .
Etylen wytwarzany z etanolu pochodzącego z cukru (głównie w Brazylii) konkuruje z etylenem wytwarzanym z surowców petrochemicznych, takich jak benzyna ciężka i etan.
W temperaturze niższej niż temperatura odwodnienia wewnątrzcząsteczkowego może wystąpić odwodnienie alkoholu międzycząsteczkowego , w wyniku którego powstaje symetryczny eter. To jest reakcja kondensacji . W poniższym przykładzie eter dietylowy jest wytwarzany z etanolu:
- 2 CH 3 CH 2 OH → CH 3 CH 2 OCH 2 CH 3 + H 2 O
Spalanie
Całkowite spalanie etanolu tworzy dwutlenek węgla i wodę:
- C2H5OH (l) + 3 O2 ( g) → 2 CO2 ( g ) + 3 H2O ( l ) ; −ΔH c = 1371 kJ/mol = 29,8 kJ/g = 327 kcal/mol = 7,1 kcal/g
- C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (G); −ΔH c = 1236 kJ/mol = 26,8 kJ/g = 295,4 kcal/mol = 6,41 kcal/g
Ciepło właściwe = 2,44 kJ/(kg·K)
Chemia kwasowo-zasadowa
Etanol jest cząsteczką obojętną, a pH roztworu etanolu w wodzie wynosi prawie 7,00. Etanol można ilościowo przekształcić w jego sprzężoną zasadę , jon etanolanu (CH 3 CH 2 O − ), w reakcji z metalem alkalicznym, takim jak sód :
- 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2
lub bardzo mocna zasada, taka jak wodorek sodu :
- CH 3 CH 2 OH + NaH → CH 3 CH 2 ONa + H 2
Kwasowości wody i etanolu są prawie takie same, na co wskazuje ich pKa wynoszące odpowiednio 15,7 i 16. Zatem etanolan sodu i wodorotlenek sodu istnieją w równowadze, która jest ściśle zrównoważona:
- CH 3 CH 2 OH + NaOH ⇌ CH 3 CH 2 ONa + H 2 O
halogenowanie
Etanol nie jest stosowany przemysłowo jako prekursor halogenków etylu, ale reakcje są ilustracyjne. Etanol reaguje z halogenowodorami, tworząc halogenki etylu , takie jak chlorek etylu i bromek etylu, poprzez reakcję S N 2 :
- CH 3 CH 2 OH + HCl → CH 3 CH 2 Cl + H 2 O
HCl wymaga katalizatora, takiego jak chlorek cynku . HBr wymaga refluksu z katalizatorem w postaci kwasu siarkowego . Halogenki etylu można w zasadzie również wytwarzać przez traktowanie etanolu bardziej wyspecjalizowanymi środkami halogenującymi , takimi jak chlorek tionylu lub tribromek fosforu .
- CH 3 CH 2 OH + SOCl 2 → CH 3 CH 2 Cl + SO 2 + HCl
Po potraktowaniu halogenami w obecności zasady etanol daje odpowiedni haloform (CHX3 , gdzie X = Cl, Br, I). Ta konwersja nazywana jest reakcją haloformową . Półproduktem w reakcji z chlorem jest aldehyd zwany chloralem , który w reakcji z wodą tworzy wodzian chloralu :
- 4 Cl 2 + CH 3 CH 2 OH → CCl 3 C H O + 5 HCl
- CCl 3 C H O + H 2 O → CCl 3 C(OH) 2 H
Utlenianie
Etanol można utlenić do aldehydu octowego i dalej utleniać do kwasu octowego , w zależności od odczynników i warunków. To utlenianie nie ma znaczenia przemysłowego, ale w organizmie ludzkim te reakcje utleniania są katalizowane przez enzym wątrobową dehydrogenazę alkoholową . Produkt utleniania etanolu, kwas octowy, jest składnikiem odżywczym dla człowieka, będąc prekursorem acetylo-CoA , w którym grupa acetylowa może być wykorzystana jako energia lub wykorzystana do biosyntezy.
Metabolizm
Etanol jest podobny do makroskładników odżywczych , takich jak białka, tłuszcze i węglowodany, ponieważ dostarcza kalorii. Po spożyciu i metabolizowaniu dostarcza 7 kilokalorii na gram poprzez metabolizm etanolu .
Bezpieczeństwo
Czysty etanol podrażnia skórę i oczy. Nudności, wymioty i zatrucie są objawami połknięcia. Długotrwałe stosowanie przez połknięcie może spowodować poważne uszkodzenie wątroby. Stężenia atmosferyczne powyżej jednej części na tysiąc przekraczają limity narażenia zawodowego obowiązujące w Unii Europejskiej .
Historia
Fermentacja cukru do etanolu jest jedną z najwcześniejszych biotechnologii stosowanych przez człowieka. W przeszłości etanol był różnie identyfikowany jako spirytus winny lub spirytusowy, a także jako aqua vitae lub aqua vita. Odurzające skutki jego spożycia znane są od czasów starożytnych. Etanol był używany przez ludzi od czasów prehistorycznych jako odurzający składnik napojów alkoholowych . Suszone pozostałości na 9000-letniej ceramice znalezionej w Chinach sugerują, że ludzie neolitu spożywali napoje alkoholowe.
Zapalny charakter wyziewów wina był już znany starożytnym filozofom przyrody, takim jak Arystoteles (384–322 p.n.e.), Teofrasta ( ok. 371–287 p.n.e.) i Pliniusz Starszy (23/24–79 n.e.). Jednak nie doprowadziło to od razu do wyizolowania etanolu, nawet pomimo rozwoju bardziej zaawansowanych technik destylacji w rzymskim Egipcie z II i III wieku . Ważnym uznaniem, po raz pierwszy znalezionym w jednym z pism przypisywanych Jābirowi ibn Ḥayyān (IX wiek n.e.), było to, że dodanie soli do wrzącego wina, co zwiększa względną lotność wina , może zwiększyć palność powstałych oparów. Destylacja wina jest poświadczona w dziełach arabskich przypisywanych al-Kindī ( ok. 801 –873 n.e.) i al-Fārābī ( ok. 872 –950 ) oraz w 28. księdze al-Zahrāwī ( łac . Abulcasis , 936–1013) Kitāb al-Taṣrīf (później przetłumaczony na łacinę jako Liber servatoris ). W XII wieku w wielu dziełach łacińskich zaczęły pojawiać się przepisy na wytwarzanie aqua ardens („płonącej wody”, czyli etanolu) poprzez destylację wina z solą, a pod koniec XIII wieku stało się to szeroko rozpowszechnione. znana substancja wśród chemików z Europy Zachodniej.
Prace Taddeo Alderottiego (1223–1296) opisują metodę zatężania etanolu polegającą na wielokrotnej destylacji frakcyjnej przez chłodzony wodą aparat destylacyjny , dzięki której można było uzyskać czystość etanolu na poziomie 90%. Właściwości lecznicze etanolu badali Arnald z Villanova (1240-1311 n.e.) i Jan z Rupescissy ( ok. 1310-1366 ), z których ten ostatni uważał go za substancję podtrzymującą życie, zdolną do zapobiegania wszelkim chorobom (aqua vitae lub „woda życia”, zwana także przez Jana kwintesencją wina).
W Chinach dowody archeologiczne wskazują, że prawdziwa destylacja alkoholu rozpoczęła się w czasach dynastii Jin (1115–1234) lub Southern Song (1127–1279). Na stanowisku archeologicznym w Qinglong w Hebei znaleziono fotos z XII wieku. W Indiach prawdziwa destylacja alkoholu została sprowadzona z Bliskiego Wschodu i była szeroko stosowana w Sułtanacie Delhi w XIV wieku.
W 1796 r. niemiecko-rosyjski chemik Johann Tobias Lowitz otrzymał czysty etanol, mieszając częściowo oczyszczony etanol (azeotrop alkohol-woda) z nadmiarem bezwodnej zasady, a następnie destylując mieszaninę na małym ogniu. Francuski chemik Antoine Lavoisier opisał etanol jako związek węgla, wodoru i tlenu, aw 1807 roku Nicolas-Théodore de Saussure określił wzór chemiczny etanolu. Pięćdziesiąt lat później Archibald Scott Couper opublikował wzór strukturalny etanolu. Był to jeden z pierwszych określonych wzorów strukturalnych.
Etanol został po raz pierwszy wytworzony syntetycznie w 1825 roku przez Michaela Faradaya . Odkrył, że kwas siarkowy może pochłaniać duże ilości gazu węglowego . Dał otrzymany roztwór Henry'emu Hennellowi , brytyjskiemu chemikowi, który odkrył w 1826 r., że zawiera on „kwas sulfowinowy” ( wodorosiarczan etylu ). W 1828 roku Hennell i francuski chemik Georges-Simon Serullas niezależnie odkryli, że kwas sulfowinowy można rozłożyć na etanol. Tak więc w 1825 roku Faraday nieświadomie odkrył, że etanol można wytwarzać z etylenu (składnika gazu węglowego) w procesie katalizowanej kwasem , procesu podobnego do obecnej przemysłowej syntezy etanolu.
Etanol był używany jako paliwo do lamp w Stanach Zjednoczonych już w 1840 r., Ale podatek nakładany na alkohol przemysłowy podczas wojny secesyjnej sprawił, że użycie to było nieopłacalne. Podatek został zniesiony w 1906 roku. Używanie jako paliwa samochodowego sięga 1908 roku, kiedy Ford Model T mógł być zasilany benzyną (benzyną) lub etanolem. Zasila niektóre lampy spirytusowe .
Etanol przeznaczony do użytku przemysłowego jest często produkowany z etylenu. Etanol ma szerokie zastosowanie jako rozpuszczalnik substancji przeznaczonych do kontaktu z ludźmi lub spożycia, w tym zapachów, aromatów, barwników i leków. W chemii jest zarówno rozpuszczalnikiem, jak i surowcem do syntezy innych produktów. Ma długą historię jako paliwo do ogrzewania i światła, a ostatnio jako paliwo do silników spalinowych.
Zobacz też
Dalsza lektura
- Boyce JM, Pittet D (2003). „Higiena rąk w placówkach służby zdrowia” . Atlanta, GA: Centra Kontroli Chorób . .
- Onuki S, Koziel JA, van Leeuwen J, Jenks WS, Grewell D, Cai L (czerwiec 2008). Techniki produkcji, oczyszczania i analizy etanolu: przegląd . Doroczne międzynarodowe spotkanie ASABE 2008. Opatrzność, RI . Źródło 16 lutego 2013 r .
- „Wyjaśnienie oznaczeń denaturatu w USA” . Zabawki naukowe .
- Lange, Norbert Adolph (1967). John Aurie Dean (red.). Lange's Handbook of Chemistry (wyd. 10). McGraw-Hill.
Linki zewnętrzne
- Alkohol (etanol) w układzie okresowym filmów (University of Nottingham)
- Informacje dotyczące bezpieczeństwa etanolu Międzynarodowej Organizacji Pracy
- Krajowy spis substancji zanieczyszczających — arkusz informacyjny dotyczący etanolu
- CDC – kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych – alkohol etylowy
- National Institute of Standards and Technology dane chemiczne dotyczące etanolu
- Chicago Board of Trade aktualności i dane rynkowe dotyczące kontraktów terminowych na etanol
- Obliczanie prężności par , gęstości cieczy , lepkości dynamicznej cieczy , napięcia powierzchniowego etanolu
- Historia etanolu Spojrzenie w historię etanolu
- ChemSub Online: alkohol etylowy
- Schemat blokowy procesu produkcji etanolu przemysłowego przy użyciu etylenu i kwasu siarkowego