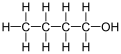
1-butanol
|
|
|||
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Butan-1-ol |
|||
| Inne nazwy n -butanol n -alkohol butylowy n -wodorotlenek butylu n -propylokarbinol n -propylometanol 1-hydroksybutan metylolopropan |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| 969148 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Bank Leków | |||
| Karta informacyjna ECHA | 100.000.683 | ||
| Numer WE |
|
||
| 25753 | |||
| KEGG | |||
| Siatka | 1-butanol | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 1120 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C4H10O _ _ _ _ | |||
| Masa cząsteczkowa | 74,123 g·mol -1 | ||
| Wygląd | Bezbarwna, refrakcyjna ciecz | ||
| Zapach | bananowy , ostry, alkoholowy i słodki | ||
| Gęstość | 0,81 g/cm 3 | ||
| Temperatura topnienia | -89,8 ° C (-129,6 ° F; 183,3 K) | ||
| Temperatura wrzenia | 117,7 ° C (243,9 ° F; 390,8 K) | ||
| 73 g/l przy 25°C | |||
| Rozpuszczalność | bardzo dobrze rozpuszczalny w acetonie mieszalny z etanolem , eterem etylowym |
||
| dziennik P | 0,839 | ||
| Ciśnienie pary | 0,58 kPa (20 °C) Międzynarodowe Karty Bezpieczeństwa Chemicznego MOP (ICSC) | ||
| Kwasowość ( p Ka ) | 16.10 | ||
| −56,536·10 −6 cm 3 /mol | |||
|
Współczynnik załamania światła ( n D )
|
1,3993 (20°C) | ||
| Lepkość | 2,573 mPa·s (przy 25 °C) | ||
| 1,66 D | |||
| Termochemia | |||
|
Standardowa entropia molowa ( S ⦵ 298 ) |
225,7 J/(K·mol) | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−328(4) kJ/mol | ||
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
−2670(20) kJ/mol | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
  
|
|||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 35 ° C (95 ° F; 308 K) | ||
| 343 ° C (649 ° F; 616 K) | |||
| Wybuchowe granice | 1,45–11,25% | ||
| Śmiertelna dawka lub stężenie (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
790 mg/kg (szczur, doustnie) | ||
|
LD Lo ( najniższy opublikowany )
|
3484 mg/kg (królik, doustnie) 790 mg/kg (szczur, doustnie) 1700 mg/kg (pies, doustnie) |
||
|
LC 50 ( mediana stężenia )
|
9221 ppm (ssak) 8000 ppm (szczur, 4 godz .) |
||
| NIOSH (limity ekspozycji na zdrowie w USA): | |||
|
PEL (dopuszczalny)
|
TWA 100 ppm (300 mg/m 3 ) | ||
|
REL (zalecane)
|
C 50 ppm (150 mg/m 3 ) [skóra] | ||
|
IDLH (bezpośrednie zagrożenie)
|
1400 str./min | ||
| Karta charakterystyki (SDS) | ICSC 0111 | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
Butanetiol n -Butyloamina Eter dietylowy Pentan |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
1-Butanol , znany również jako butan-1-ol lub n -butanol , jest pierwszorzędowym alkoholem o wzorze chemicznym C 4 H 9 OH i strukturze liniowej. Izomerami 1-butanolu są izobutanol , butan-2-ol i tert -butanol . Niemodyfikowany termin butanol zwykle odnosi się do izomeru o prostym łańcuchu.
1-Butanol występuje naturalnie jako drugorzędny produkt fermentacji etanolowej cukrów i innych sacharydów i jest obecny w wielu produktach spożywczych i napojach . Jest to również dozwolony sztuczny środek aromatyzujący w Stanach Zjednoczonych, stosowany w maśle, śmietanie, owocach, rumie, whisky, lodach i lodach, słodyczach, wypiekach i nalewkach. Jest również stosowany w szerokiej gamie produktów konsumenckich.
Największym zastosowaniem 1-butanolu jest przemysłowy półprodukt, szczególnie do produkcji octanu butylu (sam w sobie sztuczny środek aromatyzujący i rozpuszczalnik przemysłowy). Jest to produkt petrochemiczny pochodzący z propylenu . Szacunkowe dane dotyczące produkcji na rok 1997 to: Stany Zjednoczone 784 000 ton; Europa Zachodnia 575 000 ton; Japonia 225 000 ton.
Produkcja
Od lat pięćdziesiątych XX wieku większość 1-butanolu jest wytwarzana przez hydroformylowanie propenu (proces okso) w celu preferencyjnego utworzenia aldehydu masłowego n-butanalu . Typowe katalizatory są na bazie kobaltu i rodu. Aldehyd masłowy jest następnie uwodorniany w celu wytworzenia butanolu.
Druga metoda wytwarzania butanolu obejmuje reakcję Reppe propylenu z CO i wodą:
- CH 3 CH=CH 2 + H 2 O + 2 CO → CH 3 CH 2 CH 2 CH 2 OH + CO 2
W dawnych czasach butanol przygotowywano z aldehydu krotonowego , który można otrzymać z aldehydu octowego .
Butanol może być również wytwarzany przez fermentację biomasy przez bakterie. Przed 1950 rokiem Clostridium acetobutylicum było używane w fermentacji przemysłowej do produkcji butanolu. Badania przeprowadzone w ciągu ostatnich kilku dekad wykazały wyniki innych mikroorganizmów, które mogą wytwarzać butanol poprzez fermentację.
Użytek przemysłowy
Stanowiący 85% jego zużycia, 1-butanol wykorzystywany jest głównie do produkcji lakierów . Jest popularnym rozpuszczalnikiem np. nitrocelulozy . Jako rozpuszczalniki stosuje się różne estry butylowe, np. butoksyetanol . Wiele plastyfikatorów bazuje na estrach butylu, np. ftalan dibutylu . Monomer akrylan butylu jest używany do produkcji polimerów. Jest prekursorem n-butyloamin .
Biopaliwo
1-Butanol został zaproponowany jako substytut oleju napędowego i benzyny . Jest produkowany w małych ilościach w prawie wszystkich fermentacjach (patrz olej fuzlowy ). Clostridium wytwarza znacznie wyższe wydajności butanolu. Trwają badania nad zwiększeniem wydajności biobutanolu z biomasy .
Butanol jest uważany za potencjalne biopaliwo ( paliwo butanolowe ). Butanol o mocy 85% może być stosowany w samochodach na benzynę bez żadnych zmian w silniku (w przeciwieństwie do 85% etanolu) i dostarcza więcej energii na daną objętość niż etanol, prawie tyle samo co benzyna. Dlatego pojazd wykorzystujący butanol zwróciłby zużycie paliwa bardziej porównywalne do benzyny niż etanolu. Butanol można również dodawać do oleju napędowego w celu zmniejszenia emisji sadzy.
Produkcja lub w niektórych przypadkach stosowanie następujących substancji może skutkować narażeniem na działanie 1-butanolu: sztuczna skóra , estry butylu , cement kauczukowy , barwniki, esencje owocowe, lakiery, klisze filmowe i fotograficzne, płaszcze przeciwdeszczowe, perfumy, piroksylinowe tworzywa sztuczne, sztuczny jedwab , bezpieczne szkło, lakier szelakowy i wodoodporne tkaniny.
Występowanie w przyrodzie
Butan-1-ol występuje naturalnie w wyniku fermentacji węglowodanów w wielu napojach alkoholowych, w tym w piwie, brandy winogronowej, winie i whisky. Wykryto go w składnikach lotnych chmielu, owoców jack, mleka poddanego obróbce cieplnej, melona piżmowego, sera, nasion grochu południowego i gotowanego ryżu. 1-Butanol powstaje również podczas głębokiego smażenia oleju kukurydzianego, oleju z nasion bawełny, trilinoliny i trioleiny.
Butan-1-ol to jeden z „ alkoholi fuzlowych ” (z niem. „zły alkohol”), do których zalicza się alkohole posiadające więcej niż dwa atomy węgla i odznaczające się znaczną rozpuszczalnością w wodzie. Jest naturalnym składnikiem wielu napojów alkoholowych, choć w niskich i zmiennych stężeniach. Uważa się, że to (wraz z podobnymi alkoholami fuzlowymi) jest odpowiedzialne za ciężkiego kaca , chociaż eksperymenty na modelach zwierzęcych nie wykazują na to dowodów.
1-Butanol jest stosowany jako składnik przetworzonych i sztucznych aromatów oraz do ekstrakcji bezlipidowego białka z żółtek jaj, naturalnych środków aromatyzujących i olejów roślinnych, do produkcji ekstraktu chmielowego do produkcji piwa oraz jako rozpuszczalnik do usuwania pigmentów z wilgotny koncentrat białka z liści twarogu .
Metabolizm i toksyczność
Ostra toksyczność 1-butanolu jest stosunkowo niska, przy doustnej wartości LD50 . wynoszącej 790–4360 mg/kg (szczur; porównywalne wartości dla etanolu to 7000–15 000 mg/kg) Jest całkowicie metabolizowany u kręgowców w sposób podobny do etanolu : dehydrogenaza alkoholowa przekształca 1-butanol w aldehyd masłowy ; jest on następnie przekształcany w kwas masłowy przez dehydrogenazę aldehydową . Kwas masłowy może być w pełni metabolizowany do dwutlenku węgla i wody na szlaku β-utleniania . U szczurów tylko 0,03% dawki doustnej 2000 mg/kg było wydalane z moczem. W dawkach subletalnych 1-butanol działa depresyjnie na ośrodkowy układ nerwowy , podobnie jak etanol: jedno badanie na szczurach wykazało, że siła odurzająca 1-butanolu jest około 6 razy większa niż etanolu, prawdopodobnie z powodu jego wolniejsza przemiana przez dehydrogenazę alkoholową.
Inne zagrożenia
Ciekły 1-butanol, podobnie jak większość rozpuszczalników organicznych, jest wyjątkowo drażniący dla oczu; wielokrotny kontakt ze skórą może również powodować podrażnienie. Uważa się, że jest to ogólny efekt odtłuszczania . Nie zaobserwowano uczulenia skóry. Podrażnienie dróg oddechowych występuje tylko przy bardzo wysokich stężeniach (>2400 ppm).
Z temperaturą zapłonu 35 ° C, 1-butanol stwarza umiarkowane zagrożenie pożarowe: jest nieco bardziej łatwopalny niż nafta lub olej napędowy , ale mniej łatwopalny niż wiele innych powszechnych rozpuszczalników organicznych. Działanie depresyjne na ośrodkowy układ nerwowy (podobne do zatrucia etanolem) jest potencjalnym zagrożeniem podczas pracy z 1-butanolem w pomieszczeniach zamkniętych, chociaż próg zapachu (0,2–30 ppm) jest znacznie niższy od stężenia, które miałoby jakikolwiek efekt neurologiczny.
Zobacz też
Linki zewnętrzne
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0111
- Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych. "#0076" . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- Raport z wstępnej oceny SIDS dotyczący n -butanolu sporządzony przez Organizację Współpracy Gospodarczej i Rozwoju (OECD)
- Kryteria zdrowia środowiskowego IPCS 65: Butanole: cztery izomery
- Przewodnik BHP IPCS 3: 1-butanol


