Seryna
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwa IUPAC
Seryna
|
|||
| Inne nazwy Kwas 2-amino-3-hydroksypropanowy
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CHEBI |
|
||
| CHEMBL |
|
||
| ChemSpider | |||
| Bank Leków |
|
||
| Karta informacyjna ECHA | 100.000.250 | ||
| Numer WE |
|
||
|
|||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII |
|
||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 7 N O 3 | |||
| Masa cząsteczkowa | 105,093 g·mol -1 | ||
| Wygląd | białe kryształy lub proszek | ||
| Gęstość | 1,603 g/cm3 ( 22°C) | ||
| Temperatura topnienia | 246 ° C (475 ° F; 519 K) rozkłada się | ||
| rozpuszczalny | |||
| Kwasowość ( p Ka ) | 2,21 (karboksyl), 9,15 (amino) | ||
| Strona danych uzupełniających | |||
| Serine (strona danych) | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Seryna (symbol Ser lub S ) jest α- aminokwasem wykorzystywanym w biosyntezie białek. Zawiera grupę α-aminową (która w warunkach biologicznych występuje w postaci protonowanej − NH
+ 3 ), grupę karboksylową (która w warunkach biologicznych występuje w formie zdeprotonowanej − COO −
) oraz łańcuch boczny składający się z grupy hydroksymetylowej , klasyfikując go jako polarnego aminokwas. Może być syntetyzowany w ludzkim ciele w normalnych warunkach fizjologicznych, co czyni go nieistotnym aminokwasem. Jest kodowany przez kodony UCU, UCC, UCA, UCG, AGU i AGC.
Występowanie
Związek ten jest jednym z naturalnie występujących aminokwasów proteinogennych . Tylko L - stereoizomer występuje naturalnie w białkach. Nie jest niezbędny w diecie człowieka, ponieważ jest syntetyzowany w organizmie z innych metabolitów , w tym glicyny . Seryna została po raz pierwszy uzyskana z jedwabiu , szczególnie bogatego źródła, w 1865 roku przez Emila Cramera. Jego nazwa pochodzi od łacińskiego słowa oznaczającego jedwab, sericum . Struktura Serine powstała w 1902 roku. Źródła pokarmu o wysokiej zawartości L -seryny wśród ich białek obejmuje jajka, edamame, jagnięcinę, wątrobę, wieprzowinę, łososia, sardynki, wodorosty, tofu.
Biosynteza
Biosynteza seryny rozpoczyna się od utlenienia 3-fosfoglicerynianu ( półprodukt z glikolizy ) do 3-fosfohydroksypirogronianu i NADH przez dehydrogenazę fosfoglicerynianową ( EC 1.1.1.95 ). Redukcyjne aminowanie (transaminacja) tego ketonu przez transaminazę fosfoserynową ( EC 2.6.1.52 ) daje 3-fosfoserynę ( O -fosfoserynę), która jest hydrolizowana do seryny przez fosfataza fosfoserynowa ( EC 3.1.3.3 ).
U bakterii, takich jak E. coli, enzymy te są kodowane przez geny serA (EC 1.1.1.95), serC (EC 2.6.1.52) i serB (EC 3.1.3.3).
Biosynteza glicyny : hydroksymetylotransferaza serynowa (SHMT = serynowa transhydroksymetylaza) katalizuje również odwracalne konwersje L -seryny do glicyny (rozszczepienie retro-aldolowe) i 5,6,7,8-tetrahydrofolianu do 5,10-metylenotetrahydrofolianu (mTHF) (hydroliza) . SHMT jest fosforanu pirydoksalu (PLP). Glicyna może również powstać z CO 2 , NH
+ 4 i mTHF w reakcji katalizowanej przez syntazę glicyny .
Synteza i produkcja przemysłowa
Na skalę przemysłową L -seryna jest wytwarzana z glicyny i metanolu katalizowanych przez hydroksymetylotransferazę .
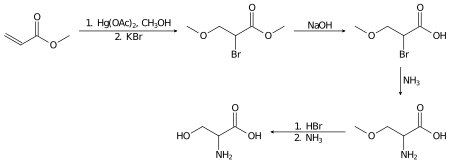
Racemiczną serynę można przygotować w laboratorium z akrylanu metylu w kilku etapach:
Funkcja biologiczna
Metaboliczny

Seryna jest ważna w metabolizmie , ponieważ bierze udział w biosyntezie puryn i pirymidyn . Jest prekursorem kilku aminokwasów, w tym glicyny i cysteiny , a także tryptofanu w bakteriach. Jest także prekursorem wielu innych metabolitów, w tym sfingolipidów i kwasu foliowego , który jest głównym dawcą jednowęglowych fragmentów w biosyntezie. [ potrzebne źródło ]
Sygnalizacja
D -seryna, syntetyzowana w neuronach przez racemazę serynową z L -seryny (jej enancjomer ), służy jako neuromodulator poprzez koaktywację receptorów NMDA , dzięki czemu mogą się otwierać, jeśli wiążą również glutaminian . D -seryna jest silnym agonistą w miejscu glicyny (NR1) receptora glutaminianu typu NMDA (NMDAR). Aby receptor się otworzył, glutaminian i glicyna lub D -seryna musi się z nią związać; ponadto bloker porów nie może być związany (np. Mg 2+ lub Zn 2+ ). W rzeczywistości D -seryna jest silniejszym agonistą w miejscu glicyny na NMDAR niż sama glicyna.
Do niedawna uważano, że D -seryna istnieje tylko w bakteriach; był to drugi aminokwas D naturalnie występujący u ludzi, obecny jako cząsteczka sygnałowa w mózgu, wkrótce po odkryciu D -asparaginianu . Gdyby aminokwasy D odkryto u ludzi wcześniej, miejsce glicyny na receptorze NMDA można by zamiast tego nazwać miejscem D -seryny. Poza ośrodkowym układem nerwowym D -seryna pełni rolę sygnalizacyjną w tkankach i narządach obwodowych, takich jak chrząstki, nerki i ciała jamiste.
Sensacja smakowa
Czysta D -seryna jest białawym krystalicznym proszkiem o bardzo słabym zapachu stęchlizny. D -Serine jest słodka z dodatkowym lekkim kwaśnym smakiem przy średnich i wysokich stężeniach.
Znaczenie kliniczne
Zaburzenia niedoboru seryny to rzadkie defekty w biosyntezie aminokwasu L -seryny. Obecnie opisano trzy zaburzenia:
- Niedobór dehydrogenazy 3-fosfoglicerynianowej
- Niedobór fosfatazy 3-fosfoserynowej
- Niedobór aminotransferazy fosfoserynowej
Te defekty enzymów prowadzą do poważnych objawów neurologicznych, takich jak wrodzona małogłowie i ciężkie opóźnienie psychoruchowe, a ponadto u pacjentów z niedoborem dehydrogenazy 3-fosfoglicerynianowej do napadów padaczkowych. Objawy te reagują w różnym stopniu na leczenie L -seryna, czasami połączona z glicyną. Odpowiedź na leczenie jest zmienna, a odległy i funkcjonalny wynik leczenia jest nieznany. Aby zapewnić podstawy do lepszego zrozumienia epidemiologii, korelacji genotyp/fenotyp i skutków tych chorób, ich wpływu na jakość życia pacjentów, a także do oceny strategii diagnostycznych i terapeutycznych, niekomercyjna Międzynarodowa Organizacja Robocza ds . Grupa ds. Zaburzeń związanych z neuroprzekaźnikami (iNTD).
Poza zaburzeniem biosyntezy seryny może dojść do zakłócenia jej transportu. Jednym z przykładów jest tetraplegia spastyczna , cienkie ciało modzelowate i postępująca małogłowie , choroba spowodowana mutacjami wpływającymi na funkcję transportera aminokwasów obojętnych A.
Badania do użytku terapeutycznego
Klasyfikacja L -seryny jako aminokwasu nieistotnego została uznana za warunkową, ponieważ kręgowce, takie jak ludzie, nie zawsze mogą syntetyzować optymalne ilości w ciągu całego życia. Bezpieczeństwo L -seryny wykazano w zatwierdzonym przez FDA badaniu klinicznym I fazy na ludziach ze stwardnieniem zanikowym bocznym, ALS (identyfikator ClinicalTrials.gov: NCT01835782), ale leczenie objawów ALS nie zostało jeszcze wykazane. Metaanaliza z 2011 roku wykazała obecność dodatkowej sarkozyny mieć średnią wielkość efektu dla negatywnych i całkowitych objawów schizofrenii. Istnieją również dowody na to, że L -seryna może odgrywać rolę terapeutyczną w cukrzycy.
D -seryna jest badana na gryzoniach jako potencjalne leczenie schizofrenii. D -seryna została również opisana jako potencjalny biomarker we wczesnej diagnostyce choroby Alzheimera (AD), ze względu na stosunkowo wysokie jej stężenie w płynie mózgowo-rdzeniowym pacjentów z prawdopodobnym AD.
D -seryna może być stosowana w leczeniu zaburzeń słuchu typu czuciowo-nerwowego, takich jak utrata słuchu i szum w uszach .
Zobacz też
- izoseryna
- Homoseryna (izotreonina)
- Klaster oktameru seryny