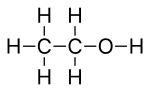
Szkieletowa formuła
Formuła szkieletowa lub formuła kąta linii lub formuła skrócona związku organicznego jest rodzajem molekularnego wzoru strukturalnego , który służy jako skrócona reprezentacja wiązania cząsteczki i niektórych szczegółów jej geometrii cząsteczkowej . Formuła szkieletowa przedstawia strukturę szkieletową lub szkielet cząsteczki, która składa się z atomów szkieletowych które tworzą cząsteczkę. Jest przedstawiony w dwóch wymiarach, jak na kartce papieru. Wykorzystuje pewne konwencje do reprezentowania węgla i wodoru , które są najbardziej powszechne w chemii organicznej.
Wczesna forma tej reprezentacji została po raz pierwszy opracowana przez chemika organicznego Augusta Kekulé , podczas gdy nowoczesna forma jest ściśle związana ze strukturą Lewisa cząsteczek i ich elektronów walencyjnych oraz pod wpływem tej reprezentacji. Stąd są one czasami nazywane strukturami Kekulé lub strukturami Lewisa-Kekule . Formuły szkieletowe stały się wszechobecne w chemii organicznej , częściowo dlatego, że można je stosunkowo szybko i łatwo narysować, a także dlatego, że zapis zakrzywionej strzałki używany do dyskusji o mechanizmach reakcji i delokalizacji elektronów można łatwo nałożyć.
Kilka innych sposobów przedstawiania struktur chemicznych jest również powszechnie stosowanych w chemii organicznej (choć rzadziej niż wzory szkieletowe). Na przykład struktury konformacyjne wyglądają podobnie do wzorów szkieletowych i służą do przedstawiania przybliżonych pozycji atomów w przestrzeni 3D, jako rysunek perspektywiczny. Inne rodzaje reprezentacji, takie jak projekcja Newmana , projekcja Hawortha czy projekcja Fischera , również wyglądają nieco podobnie do wzorów szkieletowych. Istnieją jednak niewielkie różnice w stosowanych konwencjach i czytelnik musi być ich świadomy, aby zrozumieć szczegóły strukturalne zakodowane w przedstawieniu. Podczas gdy struktury szkieletowe i konformacyjne są również używane w metaloorganicznej i nieorganicznej , stosowane konwencje również nieco się różnią.
Szkielet
Terminologia
Struktura szkieletowa związku organicznego to seria połączonych ze sobą atomów, które tworzą podstawową strukturę związku. Szkielet może składać się z łańcuchów, rozgałęzień i/lub pierścieni połączonych atomów. Atomy szkieletu inne niż węgiel lub wodór nazywane są heteroatomami .
Szkielet ma wodór i/lub różne podstawniki związane z jego atomami. Wodór jest najczęstszym atomem niebędącym węglem, który jest związany z węglem i dla uproszczenia nie jest wyraźnie narysowany. Ponadto atomy węgla nie są generalnie oznaczane jako takie bezpośrednio (tj. przez „C”), podczas gdy heteroatomy są zawsze wyraźnie oznaczone jako takie („N” dla azotu , „O” dla tlenu itp.)
Heteroatomy i inne grupy atomów, które powodują stosunkowo wysokie współczynniki reaktywności chemicznej lub wprowadzają specyficzne i interesujące cechy do widm związków, nazywane są grupami funkcyjnymi , ponieważ nadają cząsteczce funkcję. Heteroatomy i grupy funkcyjne są zbiorczo nazywane „podstawnikami”, ponieważ uważa się, że zastępują atom wodoru, który byłby obecny w macierzystym węglowodorze związku organicznego.
Podstawowa struktura
Podobnie jak w strukturach Lewisa, wiązania kowalencyjne są oznaczone odcinkami linii, z podwójnym lub potrójnym odcinkiem linii wskazującym odpowiednio wiązanie podwójne lub potrójne . Podobnie wzory szkieletowe wskazują ładunki formalne związane z każdym atomem (chociaż samotne pary są zwykle opcjonalne, patrz poniżej ). W rzeczywistości formuły szkieletowe można traktować jako skrócone struktury Lewisa, które przestrzegają następujących uproszczeń:
- Atomy węgla są reprezentowane przez wierzchołki (przecięcia lub końce) odcinków linii. Dla jasności, grupy metylowe są często wyraźnie zapisywane jako Me lub CH3 , podczas gdy węgle (hetero) kumulenowe są często reprezentowane przez ciężką kropkę w środku .
- Domniemane są atomy wodoru przyłączone do węgla. Rozumie się, że nieoznaczony wierzchołek reprezentuje węgiel przyłączony do liczby atomów wodoru wymaganej do spełnienia reguły oktetu , podczas gdy wierzchołek oznaczony ładunkiem formalnym i/lub niewiążącym elektronem (elektronami) ma liczbę atomów wodoru wymaganą do uzyskania atomowi węgla te wskazane właściwości. Opcjonalnie wodory acetylenowe i formylowe mogą być wyraźnie pokazane ze względu na przejrzystość.
- Atomy wodoru przyłączone do heteroatomu są wyraźnie pokazane. Heteroatom i dołączone do niego atomy wodoru są zwykle przedstawiane jako pojedyncza grupa (np. OH, NH 2 ) bez wyraźnego pokazywania wiązania wodór-heteroatom. Heteroatomy z prostymi podstawnikami alkilowymi lub arylowymi, takimi jak metoksy (OMe) lub dimetyloamino (NMe 2 ), są czasami przedstawiane w ten sam sposób, przez analogię.
- Samotne pary na węglach karbenowych muszą być wyraźnie wskazane, podczas gdy samotne pary w innych przypadkach są opcjonalne i są pokazane tylko dla podkreślenia. Natomiast ładunki formalne i niesparowane elektrony na elementach grupy głównej są zawsze wyraźnie pokazane.
W standardowym obrazie cząsteczki rysowana jest postać kanoniczna (struktura rezonansowa) o największym udziale. Jednak uważa się, że wzór szkieletowy reprezentuje „prawdziwą cząsteczkę” - to znaczy średnią ważoną wszystkich składowych form kanonicznych. Tak więc, w przypadkach, gdy dwie lub więcej postaci kanonicznych ma taką samą wagę (np. w benzenie lub anionie karboksylanowym) i jedna z form kanonicznych jest wybrana arbitralnie, przyjmuje się, że wzór szkieletowy przedstawia prawdziwą strukturę, zawierającą równoważne wiązania porządku ułamkowego, mimo że zdelokalizowane wiązania są przedstawione jako nierównoważne wiązania pojedyncze i podwójne.
Współczesne konwencje graficzne
Od czasu wprowadzenia konstrukcji szkieletowych w drugiej połowie XIX wieku ich wygląd przeszedł znaczną ewolucję. Stosowane dziś konwencje graficzne sięgają lat 80. Dzięki przyjęciu ChemDraw jako de facto standardu branżowego (przez American Chemical Society , Royal Society of Chemistry i Gesellschaft Deutscher Chemiker publikacje), konwencje te były niemal powszechne w literaturze chemicznej od późnych lat 90. Kilka drobnych konwencjonalnych odmian, zwłaszcza w odniesieniu do stosowania wiązań stereofonicznych, nadal istnieje w wyniku różnych praktyk w USA, Wielkiej Brytanii i Europie lub w wyniku osobistych preferencji. Jako kolejna niewielka różnica między autorami, zarzuty formalne mogą być pokazane ze znakiem plus lub minus w kółku (⊕, ⊖) lub bez koła. Poniżej podano zestaw konwencji, które są przestrzegane przez większość autorów, wraz z ilustrującymi przykładami.
- Wiązania między atomami węgla lub heteroatomami zhybrydyzowanymi sp 2 lub sp 3 są konwencjonalnie przedstawiane przy użyciu kątów 120°, gdy tylko jest to możliwe, przy czym najdłuższy łańcuch atomów układa się w zygzakowaty wzór, chyba że jest przerwany podwójnym wiązaniem cis . O ile wszystkie cztery podstawniki nie są wyraźne, jest to prawdą nawet wtedy, gdy stereochemia jest przedstawiona za pomocą wiązań zaklinowanych lub przerywanych ( patrz poniżej ).
- Jeśli wszystkie cztery podstawniki węgla tetraedrycznego są wyraźnie pokazane, wiązania z dwoma podstawnikami w płaszczyźnie nadal spotykają się przy 120 °; pozostałe dwa podstawniki są jednak zwykle pokazane z wiązaniami zaklinowanymi i przerywanymi (w celu zobrazowania stereochemii) i leżą naprzeciw mniejszego kąta 60–90 °.
- Geometria liniowa przy zhybrydyzowanych atomach sp jest zwykle przedstawiana przez odcinki linii spotykające się pod kątem 180 °. Tam, gdzie wiąże się to ze spotkaniem dwóch podwójnych wiązań ( allen lub kumulen ), wiązania są oddzielone kropką.
- Karbo- i heterocykle (3- do 8-członowe) są ogólnie przedstawiane jako regularne wielokąty; większe rozmiary pierścieni są zwykle reprezentowane przez wklęsłe wielokąty.
- Atomy w grupie są uporządkowane w taki sposób, że wiązanie pochodzi od atomu, który jest bezpośrednio przyłączony do szkieletu. Na przykład grupa nitrowa NO 2 jest oznaczana jako —NO 2 lub O 2 N— , w zależności od umiejscowienia wiązania. Natomiast izomeryczna grupa azotynowa jest oznaczona jako —ONO lub ONO— .
Niejawne atomy węgla i wodoru
Na przykład wzór szkieletowy heksanu (u góry) pokazano poniżej. Atom węgla oznaczony C1 wydaje się mieć tylko jedno wiązanie, więc muszą być z nim również związane trzy atomy wodoru, aby całkowita liczba wiązań wynosiła cztery. Atom węgla oznaczony C3 ma dwa wiązania z innymi atomami węgla, a zatem jest również związany z dwoma atomami wodoru. Dla porównania pokazano strukturę Lewisa (w środku) i model kulki i patyka (na dole) rzeczywistej struktury cząsteczkowej heksanu, określonej za pomocą krystalografii rentgenowskiej .
Nie ma znaczenia, od którego końca łańcucha zaczyna się numerację, o ile zachowana jest spójność podczas rysowania diagramów. Skondensowana formuła lub nazwa IUPAC potwierdzi orientację. Niektóre cząsteczki staną się znajome niezależnie od orientacji.
Wyraźne heteroatomy i atomy wodoru
Wszystkie atomy, które nie są węglem ani wodorem, są oznaczone symbolem chemicznym , na przykład Cl oznacza chlor , O oznacza tlen , Na oznacza sód i tak dalej. W kontekście chemii organicznej atomy te są powszechnie znane jako heteroatomy ( przedrostek hetero- pochodzi od greckiego ἕτερος héteros, co oznacza „inny”).
Wszelkie atomy wodoru związane z heteroatomami są rysowane wyraźnie. Na przykład w etanolu C2H5OH atom wodoru związany z tlenem jest oznaczony symbolem H, podczas gdy atomy wodoru związane z atomami węgla nie są pokazane bezpośrednio .
Linie reprezentujące wiązania heteroatom-wodór są zwykle pomijane ze względu na przejrzystość i zwartość, więc grupa funkcyjna, taka jak grupa hydroksylowa , jest najczęściej zapisywana jako −OH zamiast −OH. Wiązania te są czasami wyciągane w całości, aby podkreślić swoją obecność, gdy uczestniczą w mechanizmach reakcji .
Poniżej dla porównania pokazano wzór szkieletowy (na górze), jego strukturę Lewisa (w środku) i model kuli i kija (na dole) rzeczywistej trójwymiarowej struktury cząsteczki etanolu w fazie gazowej, określonej za pomocą spektroskopii mikrofalowej .
Symbole pseudoelementów
Istnieją również symbole, które wydają się być symbolami pierwiastków chemicznych , ale przedstawiają pewne bardzo powszechne podstawniki lub wskazują nieokreślonego członka grupy pierwiastków. Są one nazywane symbolami pseudoelementów lub elementami organicznymi i są traktowane jako jednowartościowe „elementy” we wzorach szkieletowych. Lista popularnych symboli pseudoelementów:
Symbole ogólne
- X dla dowolnego ( pseudo ) atomu halogenu (w powiązanej notacji MLXZ X oznacza ligand będący donorem jednego elektronu)
- L lub L n dla ligandu lub ligandów (w powiązanej notacji MLXZ L oznacza ligand będący donorem dwóch elektronów)
- M lub Met dla dowolnego atomu metalu ([M] jest używane do wskazania zligowanego metalu, ML n , gdy tożsamość ligandów jest nieznana lub nieistotna)
- E lub El dla dowolnego elektrofilu (w niektórych kontekstach E jest również używane do wskazania dowolnego elementu bloku p )
- Nu dla każdego nukleofila
- Z dla koniugacji grup odciągających elektrony (w powiązanej notacji MLXZ Z oznacza ligand będący donorem elektronów zerowych; w niepowiązanym użyciu Z jest również skrótem oznaczającym grupę karboksybenzylową ).
- D dla deuteru ( 2 H)
- T dla trytu ( 3 H)
Grupy alkilowe
- R dla dowolnej grupy alkilowej lub nawet dowolnej grupy organylowej (Alk może być użyty do jednoznacznego wskazania grupy alkilowej)
- Ja dla grupy metylowej
- Et dla grupy etylowej
- Pr, n -Pr lub n Pr dla ( normalnej ) propylowej ( grupy Pr jest również symbolem pierwiastka prazeodymu . Ponieważ jednak grupa propylowa jest jednowartościowa, podczas gdy prazeodym jest prawie zawsze trójwartościowy, niejednoznaczność pojawia się rzadko, jeśli w ogóle, w praktyce. )
- i -Pr lub iPr dla grupy izopropylowej
- Wszystko dla grupy allilowej (niezbyt często)
- Bu, n -Bu lub n Bu dla ( normalnej ) butylowej grupy
- i -Bu lub i Bu ( często pisałem kursywą) dla grupy izobutylowej
- s -Bu lub sBu dla drugorzędowej butylowej grupy
- t -Bu lub tBu dla trzeciorzędowej butylowej grupy
- Pn dla grupy pentylowej ( lub Am dla synonimicznej grupy amylowej , chociaż Am jest również symbolem ameryku . )
- Np lub Neo dla grupy neopentylowej ( Ostrzeżenie: chemicy metaloorganiczni często używają Np dla pokrewnej grupy neofilowej , PhMe 2 C–. Np jest również symbolem pierwiastka neptun . )
- Cy lub Chx dla grupy cykloheksylowej
- Reklama grupy 1- adamantylowej
- Tr lub Trt dla grupy tritylowej
Podstawniki aromatyczne i nienasycone
- Ar dla dowolnego podstawnika aromatycznego ( Ar jest również symbolem pierwiastka argonu . Jednak argon jest obojętny we wszystkich typowych warunkach spotykanych w chemii organicznej, więc użycie Ar do przedstawienia podstawnika arylowego nigdy nie powoduje zamieszania).
- Het dla dowolnego podstawnika heteroaromatycznego
- Bn lub Bzl dla grupy benzylowej ( nie mylić z Bz dla grupy benzoilowej ; jednak stara literatura może używać Bz dla grupy benzylowej ) .
- Dipp dla grupy 2,6-diizopropylofenylowej
- Mes dla grupy mezytylowej
- Ph, Φ lub φ dla grupy fenylowej ( wykorzystanie phi dla fenylu spada )
- Tol dla grupy tolilowej , zwykle izomeru para
- Is lub Tipp dla grupy 2,4,6-triizopropylofenylowej ( poprzedni symbol pochodzi od synonimu isityl )
- An oznacza grupę anizylową , zwykle izomer para ( An jest również symbolem ogólnego pierwiastka aktynoidowego . Ponieważ jednak grupa anizylowa jest jednowartościowa, podczas gdy aktynowce są zwykle dwuwartościowe, trójwartościowe lub nawet o wyższej wartościowości, niejednoznaczność rzadko, jeśli w ogóle pojawia się w praktyce ) .
- Cp dla grupy cyklopentadienylowej ( Cp było symbolem kasjopeium, dawna nazwa lutetu )
- Cp* dla grupy pentametylocyklopentadienylowej
- Vi dla grupy winylowej (niezbyt często)
Grupy funkcyjne
- Ac dla grupy acetylowej (Ac jest również symbolem pierwiastka aktynu . Jednak aktyn prawie nigdy nie występuje w chemii organicznej, więc użycie Ac do reprezentowania grupy acetylowej nigdy nie powoduje zamieszania) ;
- Bz dla grupy benzoilowej ; OBz to grupa benzoesanowa
- Piv dla grupy piwalilowej ( t -butylokarbonylowej); OPiv to grupa piwalanowa
- Bt dla grupy 1-benzotriazolilowej
- Jestem dla grupy 1-imidazolilowej
- NPth dla grupy ftalimid-1-ylowej
Grupy sulfonylowe/sulfonianowe
Estry sulfonianowe często opuszczają grupy w reakcjach podstawienia nukleofilowego. Więcej informacji można znaleźć w artykułach na temat grup sulfonylowych i sulfonianowych .
- Bs dla grupy brosylowej ( p -bromobenzenosulfonylowej); OBs to grupa brosylanów
- Ms dla grupy mesylowej (metanosulfonylowej); OMs to grupa mesylanowa
- Ns dla grupy nosylowej ( p -nitrobenzenosulfonylowej) (Ns był dawnym symbolem chemicznym bohru , zwanego wówczas nielsbohrium) ; ONs to grupa nosylanowa
- Tf dla grupy triflilowej (trifluorometanosulfonylowej); OTf to grupa triflatowa
- Nf dla grupy nonaflylowej ( nonafluorobutanosulfonylowej ), CF3 ( CF2 ) 3SO2 ; ONf to grupa nonflatowa
- Ts dla grupy tosylowej ( p- toluenosulfonylowej) (Ts jest również symbolem pierwiastka tennessine . Jednak tennessine nigdy nie występuje w chemii organicznej, więc użycie Ts do reprezentowania tosylu nigdy nie powoduje zamieszania) ; OTs to grupa tosylanowa
Grupy chroniące
Grupa zabezpieczająca lub grupa zabezpieczająca jest wprowadzana do cząsteczki poprzez chemiczną modyfikację grupy funkcyjnej w celu uzyskania chemoselektywności w późniejszej reakcji chemicznej, umożliwiającej wieloetapową syntezę organiczną.
- Boc dla grupy t- butoksykarbonylowej
- Cbz lub Z dla grupy karboksybenzylowej
- Fmoc dla grupy fluorenylometoksykarbonylowej
- Alloc dla grupy alliloksykarbonylowej
- Troc dla grupy trichloroetoksykarbonylowej
- TMS, TBDMS, TES, TBDPS, TIPS, ... dla różnych grup eterów sililowych
- PMB dla grupy 4-metoksybenzylowej
- MOM dla grupy metoksymetylowej
- THP dla grupy 2-tetrahydropiranylowej
Wiele obligacji
Dwa atomy mogą być połączone, dzieląc więcej niż jedną parę elektronów. Typowe wiązania z węglem to wiązania pojedyncze, podwójne i potrójne. Pojedyncze wiązania są najbardziej powszechne i są reprezentowane przez pojedynczą, ciągłą linię między dwoma atomami we wzorze szkieletowym. Wiązania podwójne są oznaczone dwiema równoległymi liniami, a wiązania potrójne trzema równoległymi liniami.
W bardziej zaawansowanych teoriach wiązania istnieją niecałkowite wartości rzędu wiązań . W takich przypadkach kombinacja linii ciągłych i przerywanych wskazuje odpowiednio całkowitą i niecałkowitą część kolejności wiązań.
Heks-3-en ma wewnętrzne wiązanie podwójne węgiel-węgiel
Hex-1-en ma końcowe wiązanie podwójne
Hex-3-yne ma wewnętrzne potrójne wiązanie węgiel-węgiel
Pierścienie benzenowe
W ostatnich latach benzen jest ogólnie przedstawiany jako sześciokąt z naprzemiennymi wiązaniami pojedynczymi i podwójnymi, podobnie jak struktura Kekulé pierwotnie zaproponowana w 1872 r. Jak wspomniano powyżej, naprzemienne wiązania pojedyncze i podwójne „1,3,5-cyklohekstrienu” są rozumiane być rysunkiem jednej z dwóch równoważnych form kanonicznych benzenu (izomerów 1,3,5- i 2,4,6), w których wszystkie wiązania węgiel-węgiel mają równoważną długość i kolejność wiązań dokładnie 1.5. Ogólnie rzecz biorąc, w przypadku pierścieni arylowych dwie analogiczne formy kanoniczne prawie zawsze mają główny udział w strukturze, ale nie są one równoważne, więc jedna struktura może mieć nieco większy wkład niż druga, a rzędy wiązań mogą różnić się nieco od 1,5.
Alternatywna reprezentacja, która podkreśla tę delokalizację, wykorzystuje okrąg narysowany wewnątrz sześciokąta pojedynczych wiązań, aby przedstawić zdelokalizowany orbital pi . Ten styl, oparty na stylu zaproponowanym przez Johannesa Thiele , był bardzo powszechny we wprowadzających podręcznikach chemii organicznej i nadal jest często używany w nieformalnych sytuacjach. Jednakże, ponieważ to przedstawienie nie śledzi par elektronów i nie jest w stanie pokazać dokładnego ruchu elektronów, zostało w dużej mierze zastąpione przez przedstawienie Kekuléan w kontekstach pedagogicznych i formalnych akademickich.
Stereochemia
Stereochemia jest dogodnie oznaczana we wzorach szkieletowych:
Model kulki i kija ( R )-2-chloro-2-fluoropentanu
Odpowiednie wiązania chemiczne można przedstawić na kilka sposobów:
- Linie ciągłe reprezentują wiązania w płaszczyźnie papieru lub ekranu.
- Stałe kliny reprezentują wiązania skierowane poza płaszczyznę papieru lub ekranu w kierunku obserwatora.
- Zaszyte kliny lub linie przerywane (grube lub cienkie) reprezentują wiązania skierowane w płaszczyznę papieru lub ekranu, z dala od obserwatora.
- Faliste linie reprezentują albo nieznaną stereochemię, albo mieszaninę dwóch możliwych stereoizomerów w tym punkcie.
- Przestarzałym przedstawieniem stereochemii wodoru, które było powszechne w chemii sterydów , jest użycie wypełnionego koła wyśrodkowanego na wierzchołku (czasami nazywanego odpowiednio H-kropka / H-kreska / H-koło) dla skierowanego w górę atomu wodoru i dwóch krzyżyki obok wierzchołka lub puste kółko oznaczające atom wodoru skierowany w dół.
Wczesne użycie tej notacji wywodzi się od Richarda Kuhna , który w 1932 roku użył w publikacji grubych i kropkowanych linii ciągłych. Nowoczesne kliny stałe i mieszane zostały wprowadzone w latach czterdziestych XX wieku przez Giulio Nattę w celu przedstawienia struktury polimerów o wysokiej zawartości i szeroko spopularyzowane w podręczniku Chemii organicznej z 1959 r. autorstwa Donalda J. Crama i George'a S. Hammonda .
Wzory szkieletowe mogą przedstawiać izomery cis i trans alkenów. Faliste wiązania pojedyncze są standardowym sposobem przedstawiania nieznanej lub nieokreślonej stereochemii lub mieszaniny izomerów (jak w przypadku tetraedrycznych centrów stereo). Czasami używano skrzyżowanego wiązania podwójnego; nie jest już uważany za akceptowalny styl do ogólnego użytku, ale nadal może być wymagany przez oprogramowanie komputerowe.
Wiązania wodorowe

Wiązania wodorowe są ogólnie oznaczone liniami kropkowanymi lub przerywanymi. W innych kontekstach linie przerywane mogą również przedstawiać częściowo utworzone lub zerwane wiązania w stanie przejściowym .
Notatki
Linki zewnętrzne
- Rysowanie cząsteczek organicznych z chemguide.co.uk