aktynowiec
| Część serii w |
| układzie okresowym |
|---|
aktynowców ( / ( ć k t ɪ n aɪ d / ) lub aktynoidów / o ć k t ɪ n ɔɪ d / ) obejmuje 15 metalicznych pierwiastków chemicznych liczbach atomowych od 89 do 103 , od aktynu do lawrenu . Seria aktynowców wywodzi swoją nazwę od pierwszego pierwiastka z tej serii, aktynu. Nieformalny symbol chemiczny An jest używany w ogólnych dyskusjach na temat chemii aktynowców w odniesieniu do dowolnego aktynowca.
Czerwona Księga IUPAC z 1985 r. zaleca stosowanie aktynoidów zamiast aktynowców , ponieważ przyrostek -ide zwykle wskazuje na jon ujemny . Jednak ze względu na powszechne obecne zastosowanie aktynowce są nadal dozwolone. Ponieważ aktynoid dosłownie oznacza podobny do aktynu (por. Humanoid lub android ), z powodów semantycznych argumentowano , że aktyn nie może logicznie być aktynoidem, ale IUPAC potwierdza jego włączenie na podstawie powszechnego użycia.
Wszystkie aktynowce są elementami bloku f , z wyjątkiem ostatniego (lawrenu), który jest elementem bloku d : na tej podstawie czasami kwestionowano włączenie lawrenu do aktynowców, ponieważ jest on również metalem przejściowym . Seria odpowiada głównie wypełnieniu powłoki elektronowej 5f , chociaż w stanie podstawowym wiele z nich ma anomalne konfiguracje obejmujące wypełnienie powłoki 6d z powodu odpychania międzyelektronowego. W porównaniu z lantanowcami , również głównie pierwiastkami z bloku f, aktynowce wykazują znacznie bardziej zmienną wartościowość . Wszystkie mają bardzo duże promienie atomowe i jonowe oraz wykazują niezwykle duży zakres właściwości fizycznych. Podczas gdy aktyn i późne aktynowce (począwszy od ameryku) zachowują się podobnie do lantanowców, pierwiastki tor, protaktyn i uran są znacznie bardziej podobne pod względem chemicznym do metali przejściowych , z neptunem i plutonem zajmującym pozycję pośrednią.
Wszystkie aktynowce są radioaktywne i uwalniają energię podczas rozpadu radioaktywnego; naturalnie występujące uran i tor oraz syntetycznie produkowany pluton to aktynowce występujące w największej ilości na Ziemi. Są one wykorzystywane w reaktorach jądrowych i broni jądrowej . Uran i tor mają również różne obecne lub historyczne zastosowania, a ameryk jest używany w komorach jonizacyjnych większości nowoczesnych czujek dymu .
Spośród aktynowców pierwotny tor i uran występują naturalnie w znacznych ilościach. W wyniku radioaktywnego rozpadu uranu powstają przejściowe ilości aktynu i protaktynu , a atomy neptunu i plutonu czasami powstają w wyniku reakcji transmutacji w rudach uranu . Pozostałe aktynowce to pierwiastki czysto syntetyczne . Testy broni jądrowej uwolniły do środowiska co najmniej sześć aktynowców cięższych od plutonu ; analiza szczątków z bomby wodorowej z 1952 r . wykazała obecność ameryku, kuru , berkelu , kalifornu , einsteinu i fermu .
W prezentacjach układu okresowego elementy bloku f są zwykle przedstawiane jako dwa dodatkowe wiersze poniżej głównej części układu. Ta konwencja jest całkowicie kwestią estetyki i praktyczności formatowania; rzadko używany szeroko sformatowany układ okresowy pierwiastków wstawia serie 4f i 5f w odpowiednich miejscach, jako części szóstego i siódmego rzędu (okresów) tabeli.
Odkrywanie, izolacja i synteza
| Element | Rok | metoda |
|---|---|---|
| Neptun | 1940 | Bombardowanie 238 U neutronami |
| Pluton | 1941 | Bombardowanie 238 U deuteronami |
| ameryk | 1944 | Bombardowanie 239 Pu neutronami |
| Kiur | 1944 | Bombardowanie 239 Pu cząstkami α |
| Berkelium | 1949 | Bombardowanie 241 Am cząstkami α |
| Kaliforn | 1950 | Bombardowanie 242 Cm cząstkami α |
| Einsteinium | 1952 | Jako produkt wybuchu jądrowego |
| Ferm | 1952 | Jako produkt wybuchu jądrowego |
| Mendelew | 1955 | Bombardowanie 253 Es cząstkami α |
| Nobel | 1965 | Bombardowanie 243 Am przez 15 N lub 238 U z 22 Ne |
| lawren |
1961 –1971 |
Bombardowanie 252 Cf przez 10 B lub 11 B i 243 Am z 18 O |
Podobnie jak lantanowce , aktynowce tworzą rodzinę pierwiastków o podobnych właściwościach. W obrębie aktynowców istnieją dwie nakładające się grupy: pierwiastki transuranowe , które w układzie okresowym następują po uranie ; i pierwiastki transplutonowe , które następują po plutonie. W porównaniu z lantanowcami, które (z wyjątkiem prometu ) występują w naturze w znacznych ilościach, większość aktynowców występuje rzadko. Większość nie występuje w przyrodzie, a spośród tych, które występują, tylko tor i uran występują w ilościach więcej niż śladowych. Najobficiej występującymi lub łatwo syntetyzowanymi aktynowcami są uran i tor, a następnie pluton, ameryk, aktyn, protaktyn, neptun i kur.
Istnienie pierwiastków transuranowych zostało zasugerowane w 1934 roku przez Enrico Fermiego na podstawie jego eksperymentów. Jednak chociaż w tym czasie znane były cztery aktynowce, nie było jeszcze zrozumiałe, że tworzą one rodzinę podobną do lantanowców. hafnowi , tantalu i wolframowi z 6. okresu . Synteza transuranów stopniowo podważyła ten punkt widzenia. Do 1944 roku obserwacja, że kur nie wykazuje stopni utlenienia powyżej 4 (podczas gdy jego rzekomy homolog z szóstego okresu, platyna , może osiągnąć stopień utlenienia 6) skłoniła Glenna Seaborga do sformułowania „ hipotezy aktynowców ”. Badania znanych aktynowców i odkrycia dalszych pierwiastków transuranowych dostarczyły więcej danych na poparcie tego stanowiska, ale wyrażenie „hipoteza aktynowców” (sugerowanie, że „hipoteza” to coś, czego nie udowodniono zdecydowanie) pozostawało w aktywnym użyciu przez naukowców do późnych lat pięćdziesiątych.
Obecnie istnieją dwie główne metody otrzymywania izotopów pierwiastków transplutonowych: (1) napromienianie lżejszych pierwiastków neutronami ; (2) napromieniowanie przyspieszonymi naładowanymi cząstkami. Pierwsza metoda jest ważniejsza dla zastosowań, ponieważ tylko napromieniowanie neutronami przy użyciu reaktorów jądrowych pozwala na produkcję znacznych ilości syntetycznych aktynowców; ogranicza się jednak do stosunkowo lekkich elementów. Zaletą drugiej metody jest to, że można otrzymać pierwiastki cięższe od plutonu, a także izotopy z niedoborem neutronów, które nie powstają podczas naświetlania neutronami.
W latach 1962-1966 w Stanach Zjednoczonych próbowano wyprodukować izotopy transplutonu za pomocą serii sześciu podziemnych wybuchów jądrowych . Natychmiast po teście z obszaru wybuchu pobrano małe próbki skał w celu zbadania produktów wybuchu, ale nie wykryto żadnych izotopów o liczbie masowej większej niż 257, pomimo przewidywań, że takie izotopy miałyby stosunkowo długi okres półtrwania rozpadu α . Ten brak obserwacji przypisywano spontanicznemu rozszczepieniu ze względu na dużą prędkość produktów i innym kanałom rozpadu, takim jak emisja neutronów i rozszczepienie jądrowe .
Od aktynu do uranu

Uran i tor były pierwszymi odkrytymi aktynowcami . Uran został zidentyfikowany w 1789 roku przez niemieckiego chemika Martina Heinricha Klaprotha w rudzie blendy smolistej . Nazwał ją na cześć planety Uran , odkrytej osiem lat wcześniej. Klaproth był w stanie wytrącić żółty związek (prawdopodobnie diuranian sodu ) przez rozpuszczenie blendy smolistej w kwasie azotowym i zobojętnienie roztworu wodorotlenkiem sodu . Następnie zredukował otrzymany żółty proszek węglem drzewnym i wydobył czarną substancję, którą wziął za metal. Sześćdziesiąt lat później francuski naukowiec Eugène-Melchior Péligot zidentyfikował go jako tlenek uranu. Wyizolował również pierwszą próbkę metalicznego uranu, ogrzewając tetrachlorek uranu z metalicznym potasem . Masa atomowa uranu została wówczas obliczona na 120, ale Dmitrij Mendelejew w 1872 roku poprawił ją na 240, stosując swoje prawa okresowości. Wartość tę potwierdził eksperymentalnie w 1882 roku K. Zimmerman.
Tlenek toru został odkryty przez Friedricha Wöhlera w minerale torianit , który został znaleziony w Norwegii (1827). Jöns Jacob Berzelius bardziej szczegółowo scharakteryzował ten materiał w 1828 r. Poprzez redukcję tetrachlorku toru potasem wyizolował metal i nazwał go torem na cześć nordyckiego boga piorunów i błyskawic Thora . Ta sama metoda izolacji została później zastosowana przez Péligota w przypadku uranu.
Aktyn został odkryty w 1899 roku przez André-Louisa Debierne'a , asystenta Marii Curie-Curie , w odpadach blendy smolistej pozostałej po usunięciu radu i polonu. Opisał tę substancję (w 1899 r.) jako podobną do tytanu i (w 1900 r.) jako podobną do toru. Odkrycie aktynu przez Debierne'a zostało jednak zakwestionowane w 1971 i 2000 roku, argumentując, że publikacje Debierne'a z 1904 roku zaprzeczały jego wcześniejszym pracom z lat 1899–1900. Zamiast tego pogląd ten przypisuje pracę Friedricha Oskara Giesela z 1902 roku , który odkrył radioaktywny pierwiastek o nazwie emanium , który zachowywał się podobnie do lantanu. Nazwa aktyn pochodzi od starogreckiego : ακτίς, ακτίνος (aktis, aktinos) , co oznacza promień lub promień. Metal ten został odkryty nie przez jego własne promieniowanie, ale przez promieniowanie produktów pochodnych. Ze względu na bliskie podobieństwo aktynu i lantanu oraz niewielką liczebność czysty aktyn można było wyprodukować dopiero w 1950 r. Termin aktynowce został prawdopodobnie wprowadzony przez Victora Goldschmidta w 1937 r.
Protaktyn został prawdopodobnie wyizolowany w 1900 roku przez Williama Crookesa . Po raz pierwszy został zidentyfikowany w 1913 roku, kiedy Kasimir Fajans i Oswald Helmuth Göhring napotkali krótkotrwały izotop 234 m Pa (okres półtrwania 1,17 minuty) podczas badań rozpadu 238 U. Nazwali nowy element brevium (z łac. brevis oznaczający krótki); nazwa została zmieniona na protoaktyn (z greckiego πρῶτος + ἀκτίς oznaczający „pierwiastek pierwszej wiązki”) w 1918 r., kiedy dwie grupy naukowców, kierowane przez Austriaków Lise Meitner i Otto Hahn z Niemiec oraz Fredericka Soddy'ego i Johna Cranstona z Wielkiej Brytanii, niezależnie odkryły znacznie dłużej żyjący 231 Pa. Nazwę skrócono do protaktynu w 1949 r. Pierwiastek ten był słabo scharakteryzowany do 1960 r., kiedy AG Maddock i jego współpracownicy w Wielkiej Brytanii wyizolowali 130 gramów protaktynu z 60 ton odpadów pozostałych po ekstrakcji uran z jego rudy.
Neptun i wyżej
Neptun (nazwany na cześć planety Neptun , następnej planety poza Uranem, od której pochodzi nazwa uranu) został odkryty przez Edwina McMillana i Philipa H. Abelsona w 1940 r. w Berkeley w Kalifornii . Wyprodukowali 239 Np (okres półtrwania = 2,4 dnia) przez bombardowanie uranu powolnymi neutronami . Był to pierwszy pierwiastek transuranowy wyprodukowany syntetycznie.

Pierwiastki transuranowe nie występują w przyrodzie w znacznych ilościach i są powszechnie syntetyzowane w reakcjach jądrowych prowadzonych w reaktorach jądrowych. Na przykład pod napromieniowaniem neutronami reaktora uran-238 częściowo przekształca się w pluton-239 :
Ta reakcja syntezy została wykorzystana przez Fermiego i jego współpracowników przy projektowaniu reaktorów zlokalizowanych w Hanford Site , które wytwarzały znaczne ilości plutonu-239 do broni jądrowej Projektu Manhattan i powojennego arsenału nuklearnego Stanów Zjednoczonych.
Aktynowce o najwyższych liczbach masowych są syntetyzowane przez bombardowanie uranu, plutonu, kuru i kalifornu jonami azotu, tlenu, węgla, neonu lub boru w akceleratorze cząstek . Tak więc nobel został wyprodukowany przez bombardowanie uranu-238 neonem-22 as
- .
Pierwsze izotopy pierwiastków transplutonowych, ameryku-241 i kuru-242 , zostały zsyntetyzowane w 1944 roku przez Glenna T. Seaborga, Ralpha A. Jamesa i Alberta Ghiorso . Curium-242 otrzymano przez bombardowanie plutonu-239 32-MeV cząstkami α
- .
Izotopy ameryku-241 i kuru-242 również zostały wyprodukowane przez napromieniowanie plutonu w reaktorze jądrowym. Ten ostatni pierwiastek został nazwany na cześć Marie Curie i jej męża Pierre'a , którzy są znani z odkrycia radu i pracy nad radioaktywnością .
Bombardowanie curium-242 cząstkami α dało izotop kalifornu 245 Cf (1950), a podobna procedura dała w 1949 berkelium-243 z ameryku-241. Nowe pierwiastki zostały nazwane na cześć Berkeley w Kalifornii , przez analogię do jego homologu lantanowca terbu , który został nazwany na cześć wioski Ytterby w Szwecji.
W 1945 roku BB Cunningham otrzymał pierwszy masowy związek chemiczny pierwiastka transplutonowego, a mianowicie wodorotlenek ameryku . W ciągu kilku lat zgromadzono miligramowe ilości ameryku i mikrogramowe ilości kuru, co umożliwiło produkcję izotopów berkelium (Thomson, 1949) i kalifornu (Thomson, 1950). Znaczne ilości tych pierwiastków wyprodukowano w 1958 roku (Burris B. Cunningham i Stanley G. Thomson), a pierwszy związek kalifornu (0,3 µg CfOCl) otrzymali w 1960 roku BB Cunningham i JC Wallmann.
Einsteinium i ferm zostały zidentyfikowane w latach 1952–1953 w opadzie z próby jądrowej „ Ivy Mike ” (1 listopada 1952 r.), Pierwszego udanego testu bomby wodorowej. Chwilowa ekspozycja uranu-238 na duży strumień neutronów powstały w wyniku eksplozji wytworzyła ciężkie izotopy uranu, w tym uran-253 i uran-255, a ich rozpad β dał einstein-253 i ferm-255 . Odkrycie nowych pierwiastków i nowe dane dotyczące wychwytywania neutronów były początkowo utrzymywane w tajemnicy na rozkaz armii amerykańskiej do 1955 r. z powodu zimną wojną . Niemniej jednak zespół z Berkeley był w stanie przygotować einstein i ferm środkami cywilnymi, poprzez bombardowanie neutronami plutonu-239, i opublikował tę pracę w 1954 r. Z zastrzeżeniem, że nie były to pierwsze badania przeprowadzone na tych pierwiastkach. Badania „Ivy Mike” zostały odtajnione i opublikowane w 1955 r. Pierwsze znaczące (submikrogramowe) ilości einsteinu zostały wyprodukowane w 1961 r. przez Cunninghama i współpracowników, ale nie zostało to jeszcze zrobione w przypadku fermu.
Pierwszy izotop mendelewium, 256 Md (okres półtrwania 87 min), został zsyntetyzowany przez Alberta Ghiorso, Glenna T. Seaborga, Gregory'ego R. Choppina, Bernarda G. Harveya i Stanleya G. Thompsona, kiedy bombardowali cel 253 Es alfa cząstki w 60-calowym cyklotronie Berkeley Radiation Laboratory ; był to pierwszy izotop dowolnego pierwiastka, który został zsyntetyzowany po jednym atomie na raz.
Było kilka prób uzyskania izotopów nobelu przez grupy szwedzkie (1957) i amerykańskie (1958), ale pierwszym wiarygodnym wynikiem była synteza 256 No przez grupę rosyjską ( Georgy Flyorov et al. ) w 1965 r. IUPAC w 1992. W swoich eksperymentach Flyorov et al. bombardowany uran-238 neonem-22.
W 1961 roku Ghiorso i in. otrzymał pierwszy izotop lawrenu przez napromieniowanie kalifornu (głównie kalifornu-252 ) jonami boru-10 i boru-11 . Liczba masowa tego izotopu nie została wówczas jednoznacznie ustalona (prawdopodobnie 258 lub 259). W 1965 roku Flyorov i in. zsyntetyzowali 256 Lr . od 243 rano i 18 o . W ten sposób IUPAC uznał zespoły fizyki jądrowej w Dubnej i Berkeley za współodkrywców lawrenu.
izotopy
| Właściwości jądrowe izotopów najważniejszych izotopów transplutonowych | ||||||
|---|---|---|---|---|---|---|
| Izotop | Pół życia |
Prawdopodobieństwo samoistnego rozszczepienia w % |
Energia emisji (MeV) (wydajność w %) |
Specyficzna aktywność (Bq/kg) | ||
| α | γ | α, β-cząstki | rozszczepienie | |||
| 241 rano | 432.2(7) y | 4,3(18 ) × 10-10 |
5,485 (84,8) 5,442 (13,1) 5,388 (1,66) |
0,059 (35,9) 0,026 (2,27) |
1,27 × 10 14 | 546.1 |
| 243 rano | 7,37(4) × 10 3 r | 3,7(2 ) × 10-9 |
5,275 (87,1) 5,233 (11,2) 5,181 (1,36) |
0,074 (67,2) 0,043 (5,9) |
7,39 × 10 12 | 273,3 |
| 242 cm | 162.8(2)d | 6,2(3 ) × 10-6 |
6,069 (25,92) 6,112 (74,08) |
( 0,04) 0,102 (4 × 10-3 ) |
1,23 × 10 17 | 7,6 × 10 9 |
| 244 cm | 18.10 ust. 2 r | 1,37(3 ) × 10-4 |
5,762 (23,6) 5,804 (76,4) |
0,043 (0,02) 0,100 (1,5 × 10-3 ) |
2,96 × 10 15 | 4,1 × 10 9 |
| 245 cm | 8.5(1) × 10 3 r | 6,1(9 ) × 10-7 |
5,529 (0,58) 5,488 (0,83) 5,361 (93,2) |
0,175 (9,88) 0,133 (2,83) |
6,35 × 10 12 | 3,9 × 10 4 |
| 246 cm | 4,76(4) × 10 3 r | 0,02615(7) |
5,343 (17,8) 5,386 (82,2) |
0,045 (19) | 1,13 × 10 13 | 2,95 × 10 9 |
| 247 cm | 1,56(5) × 10 7 y | — |
5,267 (13,8) 5,212 (5,7) 5,147 (1,2) |
0,402 (72) 0,278 (3,4) |
3,43 × 10 9 | — |
| 248 cm | 3,48(6) × 10 5 r | 8.39(16) |
5,034 (16,52) 5,078 (75) |
— | 1,40 × 10 11 | 1,29 × 10 10 |
| 249 Bk | 330(4)d | 4,7(2 ) × 10-8 |
5,406 (1 × 10-3 ) 5,378 ( 2,6 × 10-4 ) |
0,32 (5,8 × 10-5 ) | 5,88 × 10 16 | 2,76 × 10 7 |
| 249 Por | 351 ust. 2 r | 5,0(4 ) × 10-7 |
6,193 (2,46) 6,139 (1,33) 5,946 (3,33) |
0,388 (66) 0,333 (14,6) |
1,51 × 10 14 | 7,57 × 10 5 |
| 250 Por | 13.08(9) r | 0,077(3) |
5,988 (14,99) 6,030 (84,6) |
0,043 | 4,04 × 10 15 | 3,11 × 10 12 |
| 251 Por | 900(40) r | ? |
6,078 (2,6) 5,567 (0,9) 5,569 (0,9) |
0,177 (17,3) 0,227 (6,8) |
5,86 × 10 13 | — |
| 252 Por | 2.645(8) r | 3.092(8) |
6,075 (15,2) 6,118 (81,6) |
0,042 (1,4 × 10-2 ) 0,100 (1,3 × 10-2 ) |
1,92 × 10 16 | 6,14 × 10 14 |
| 254 Por | 60.5(2)d | ≈100 |
5,834 (0,26) 5,792 (5,3 × 10-2 ) |
— | 9,75 × 10 14 | 3,13 × 10 17 |
| 253 Es | 20.47(3) d | 8,7(3 ) × 10-6 |
6,540 (0,85) 6,552 (0,71) 6,590 (6,6) |
( 0,05) 0,429 (8 × 10-3 ) |
9,33 × 10 17 | 8,12 × 10 10 |
| 254 Es | 275.7(5)d | < 3 × 10-6 |
6,347 (0,75) 6,358 (2,6) 6,415 (1,8) |
0,042 (100) 0,034 (30) |
6,9 × 10 16 | — |
| 255 Es | 39.8(12)d | 0,0041(2) |
6,267 (0,78) 6,401 (7) |
— |
4,38 × 10 17 (β) 3,81 × 10 16 (α) |
1,95 × 10 13 |
| 255 Fm | 20.07(7) godz | 2,4(10 ) × 10-5 |
7,022 (93,4) 6,963 (5,04) 6,892 (0,62) |
0,00057 (19,1) 0,081 (1) |
2,27 × 10 19 | 5,44 × 10 12 |
| 256 Fm | 157,6(13) min | 91.9(3) |
6,872 (1,2) 6,917 (6,9) |
— | 1,58 × 10 20 | 1,4 × 10 19 |
| 257 Fm | 100.5(2)d | 0,210(4) |
6,752 (0,58) 6,695 (3,39) 6,622 (0,6) |
0,241 (11) 0,179 (8,7) |
1,87 × 10 17 | 3,93 × 10 14 |
| 256 Md | 77 ust. 2 min | — |
7,142 (1,84) 7,206 (5,9) |
— | 3,53 × 10 20 | — |
| 257 Md | 5.52 ust. 5 godz | — | 7.074 (14) |
0,371 (11,7) 0,325 (2,5) |
8,17 × 10 19 | — |
| 258 Md | 51.5(3)d | — | 6.73 | — | 3,64 × 10 17 | — |
| 255 Nie | 3.1(2) min | — |
8,312 (1,16) 8,266 (2,6) 8,121 (27,8) |
0,187 (3,4) | 8,78 × 10 21 | — |
| 259 Nie | 58(5) min | — |
7,455 (9,8) 7,500 (29,3) 7,533 (17,3) |
— | 4,63 × 10 20 | — |
| 256 Lr | 27 ust. 3 ust | < 0,03 |
8.319 (5.4) 8.390 (16) 8.430 (33) |
— | 5,96 × 10 22 | — |
| 257 Lr | 646(25) ms | — |
8.796 (18) 8.861 (82) |
— | 1,54 × 10 24 | — |
Do 2016 roku zidentyfikowano 32 izotopy aktynu i osiem wzbudzonych stanów izomerycznych niektórych jego nuklidów . Trzy izotopy, 225 Ac , 227 Ac i 228 Ac , znaleziono w naturze, a pozostałe zostały wyprodukowane w laboratorium; w zastosowaniach stosuje się tylko trzy naturalne izotopy. Aktyn-225 należy do serii radioaktywnych neptunów ; został po raz pierwszy odkryty w 1947 roku jako produkt rozpadu uranu-233 , jest emiterem α o okresie półtrwania wynoszącym 10 dni. Aktyn-225 jest mniej dostępny niż aktyn-228, ale jest bardziej obiecujący w zastosowaniach radioznacznika. Aktyn-227 (okres półtrwania 21,77 lat) występuje we wszystkich rudach uranu, ale w niewielkich ilościach. Jeden gram uranu (w równowadze radioaktywnej) zawiera tylko 2 × 10-10 gramów 227 Ac . Aktyn-228 należy do serii radioaktywnego toru utworzonej w wyniku rozpadu 228 Ra ; jest to emiter β - z okresem półtrwania 6,15 godziny. W jednej tonie toru znajduje się 5 × 10-8 gramów 228 Ac. Została odkryta w 1906 roku przez Otto Hahna .
Znanych jest 31 izotopów toru o liczbie masowej od 208 do 238. Spośród nich najdłużej żyjący to 232 Th, którego okres półtrwania wynoszący 1,4 × 10 10 lat oznacza, że nadal istnieje on w przyrodzie jako pierwotny nuklid . Następnym najdłużej żyjącym jest 230 Th, pośredni produkt rozpadu 238 U z okresem półtrwania 75 400 lat. Kilka innych izotopów toru ma okres półtrwania w ciągu jednego dnia; wszystkie z nich są również przejściowe w łańcuchach rozpadu 232 Th, 235 U i 238 U.
28 izotopów protaktynu o liczbach masowych 212–239, a także trzy wzbudzone stany izomeryczne . W naturze znaleziono tylko 231 Pa i 234 Pa . Wszystkie izotopy mają krótki czas życia, z wyjątkiem protaktyny-231 (okres półtrwania 32 760 lat). Najważniejszymi izotopami są 231 Pa i 233 Pa , który jest produktem pośrednim w otrzymywaniu uranu-233 i najtańszym spośród sztucznych izotopów protaktynu. 233 Pa ma dogodny okres półtrwania i energię promieniowania γ , dlatego był używany w większości badań chemii protaktynu. Protaktyn-233 jest emiterem β o okresie półtrwania wynoszącym 26,97 dni.
Znanych jest 26 izotopów uranu o liczbach masowych 215–242 (z wyjątkiem 220 i 241). Trzy z nich, 234 U , 235 U i 238 U, występują w przyrodzie w znacznych ilościach. Między innymi najważniejszym jest 232Th 233 U , który jest końcowym produktem przemiany napromieniowanej przez powolne neutrony. 233 U ma znacznie wyższą wydajność rozszczepienia neutronami niskoenergetycznymi (termicznymi) w porównaniu np. z 235 U. Większość badań chemii uranu przeprowadzono na uranie-238 ze względu na jego długi okres półtrwania wynoszący 4,4 × 10 9 lat.
Istnieje 24 izotopów neptunu o liczbach masowych 219, 220 i 223–244; wszystkie są wysoce radioaktywne. Najbardziej popularne wśród naukowców są długowieczne 237 Np (t 1/2 = 2,20 × 10 6 lat) i krótkotrwałe 239 Np, 238 Np (t 1/2 ~ 2 dni).
osiemnaście izotopów ameryku o liczbach masowych od 229 do 247 (z wyjątkiem 231). Najważniejsze to 241 Am i 243 Am, które są emiterami alfa i również emitują miękkie, ale intensywne promienie γ; oba można otrzymać w izotopowo czystej postaci. Właściwości chemiczne ameryku badano najpierw przy 241 Am, ale później zmieniono je na 243 Am, czyli prawie 20 razy mniej radioaktywne. Wadą 243 Am jest wytwarzanie krótkotrwałego izotopu pochodnego 239 Np, co należy uwzględnić w analizie danych.
Spośród 19 izotopów kuru o liczbie masowej od 233 do 251 najbardziej dostępne są izotopy 242 Cm i 244 Cm; są emiterami α, ale mają znacznie krótszy czas życia niż izotopy ameryku. Izotopy te prawie nie emitują promieniowania γ, ale ulegają spontanicznemu rozszczepieniu z towarzyszącą emisją neutronów. Bardziej długowieczne izotopy kuru ( 245–248 Cm, wszystkie emitery α) powstają jako mieszanina podczas napromieniania neutronami plutonu lub ameryku. Po krótkim naświetlaniu mieszanina ta jest zdominowana przez 246 Cm, a następnie zaczyna się gromadzić 248 Cm. Oba te izotopy, zwłaszcza 248 Cm, mają dłuższy okres półtrwania (3,48 × 10 5 lat) i są znacznie wygodniejsze do prowadzenia badań chemicznych niż 242 Cm i 244 Cm, ale mają też dość wysoki wskaźnik spontanicznego rozszczepienia . 247 Cm ma najdłuższy czas życia wśród izotopów kuru (1,56 × 10 7 lat), ale nie powstaje w dużych ilościach z powodu silnego rozszczepienia wywołanego neutronami termicznymi.
Zidentyfikowano siedemnaście izotopów berkelium o liczbach masowych 233–234, 236, 238 i 240–252. Tylko 249 Bk jest dostępne w dużych ilościach; ma stosunkowo krótki okres półtrwania wynoszący 330 dni i emituje głównie miękkie cząstki β , które są niewygodne do wykrycia. Jego promieniowanie alfa jest raczej słabe (1,45 × 10-3 % w stosunku do promieniowania β), ale czasami jest używane do wykrywania tego izotopu . 247 Bk jest emiterem alfa o długim okresie półtrwania wynoszącym 1380 lat, ale trudno go uzyskać w znacznych ilościach; nie powstaje po napromieniowaniu neutronami plutonu ze względu na β-stabilność izotopów izotopów kuru o liczbie masowej poniżej 248.
W reaktorach jądrowych powstaje 20 izotopów kalifornu o liczbach masowych 237–256; kaliforn-253 jest emiterem β, a reszta to emitery α. Izotopy o parzystych liczbach masowych ( 250 Cf, 252 Cf i 254 Cf) charakteryzują się dużą szybkością spontanicznego rozszczepienia, zwłaszcza 254 Cf, z którego 99,7% rozpada się w wyniku samorzutnego rozszczepienia. Kaliforn-249 ma stosunkowo długi okres półtrwania (352 lata), słabe spontaniczne rozszczepienie i silną emisję γ, co ułatwia jego identyfikację. 249 Cf nie powstaje w dużych ilościach w reaktorze jądrowym ze względu na powolny rozpad β macierzystego izotopu 249 Bk i duży przekrój oddziaływania z neutronami, ale może być akumulowany w postaci izotopowo czystej jako rozpad β produkt (wstępnie wybrany) 249 Bk. Kaliforn wytwarzany przez napromieniowanie plutonu w reaktorze składa się głównie z 250 Cf i 252 Cf, przy czym ten ostatni dominuje w przypadku dużych fluencji neutronów, a jego badanie jest utrudnione przez silne promieniowanie neutronowe.
| Izotop macierzysty |
t 1/2 |
Córka izotopu |
t 1/2 |
Czas na ustalenie równowagi radioaktywnej |
|---|---|---|---|---|
| 243 rano | 7370 lat | 239 np | 2,35 dnia | 47,3 dni |
| 245 cm | 8265 lat | 241 pu | 14 lat | 129 lat |
| 247 cm | 1,64 × 10 7 lat | 243 pu | 4,95 godziny | 7,2 dnia |
| 254 Es | 270 dni | 250 Bk | 3,2 godziny | 35,2 godziny |
| 255 Es | 39,8 dni | 255 Fm | 22 godziny | 5 dni |
| 257 Fm | 79 dni | 253 Por | 17,6 dni | 49 dni |
Spośród 18 znanych izotopów einsteinium o liczbach masowych od 240 do 257, najtańszym jest 253 Es. Jest emiterem α z okresem półtrwania 20,47 dni, stosunkowo słabą emisją γ i małą spontaniczną szybkością rozszczepienia w porównaniu z izotopami kalifornu. Długotrwałe napromieniowanie neutronami wytwarza również długożyciowy izotop 254 Es (t 1/2 = 275,5 dni).
dwadzieścia izotopów fermu o liczbach masowych 241–260. 254 Fm, 255 Fm i 256 Fm to emitery α o krótkim okresie półtrwania (godziny), które można wydzielić w znacznych ilościach. 257 Fm (t 1/2 = 100 dni) może gromadzić się przy długotrwałym i silnym napromieniowaniu. Wszystkie te izotopy charakteryzują się wysokimi wskaźnikami spontanicznego rozszczepienia.
Spośród 17 znanych izotopów mendelewium (liczby masowe od 244 do 260) najlepiej zbadanym jest 256 Md, który rozpada się głównie poprzez wychwyt elektronów (promieniowanie α wynosi ≈10%) z okresem półtrwania 77 minut. Inny emiter alfa, 258 Md, ma okres półtrwania wynoszący 53 dni. Oba te izotopy są wytwarzane z rzadkiego einsteinium ( 253 Es i 255 Es), co ogranicza ich dostępność.
Długożyciowe izotopy nobelu i izotopy lawrenu (i cięższych pierwiastków) mają stosunkowo krótkie okresy półtrwania. W przypadku nobelu znanych jest 11 izotopów o liczbach masowych 250–260 i 262. Właściwości chemiczne nobelu i lawrenu badano za pomocą 255 No (t 1/2 = 3 min) i 256 Lr (t 1/2 = 35 s). Najdłużej żyjący izotop nobelu, 259 No, ma okres półtrwania około 1 godziny. Lawren ma 13 znanych izotopów o liczbach masowych 251–262 i 266. Najbardziej stabilnym z nich wszystkich jest 266 Lr, którego okres półtrwania wynosi 11 godzin.
Spośród nich jedynymi izotopami, które występują w przyrodzie w ilościach wystarczających do wykrycia czegoś więcej niż ślady i które mają wymierny udział w masach atomowych aktynowców, są pierwotne 232 Th, 235 U i 238 U oraz trzy długożyciowe produkty rozpadu naturalnego uranu, 230 Th, 231 Pa i 234 U. Naturalny tor składa się z 0,02(2)% 230 Th i 99,98(2)% 232 Th; naturalny protaktyn składa się w 100% z 231 Pa; a uran naturalny składa się z 0,0054(5)% 234 U, 0,7204(6)% 235 U i 99,2742(10)% 238 U.
Powstawanie w reaktorach jądrowych
Rysunek nagromadzenia aktynowców to tabela nuklidów z liczbą neutronów na osi poziomej (izotopy) i liczbą protonów na osi pionowej (pierwiastki). Czerwona kropka dzieli nuklidy na dwie grupy, więc figura jest bardziej zwarta. Każdy nuklid jest reprezentowany przez kwadrat z liczbą masową pierwiastka i jego okresem półtrwania. Naturalnie istniejące izotopy aktynowców (Th, U) zaznaczono pogrubioną obwódką, emitery alfa mają kolor żółty, a emitery beta mają kolor niebieski. Różowy wskazuje na wychwyt elektronów ( 236 Np), podczas gdy biały oznacza długotrwały stan metastabilny ( 242 Am).
Powstawanie nuklidów aktynowców charakteryzuje się przede wszystkim:
- Reakcje wychwytu neutronów (n, γ), które są reprezentowane na rysunku przez krótką strzałkę w prawo.
- Uwzględniono również reakcje (n,2n) i rzadziej występujące reakcje (γ,n), obie zaznaczone krótką strzałką w lewo.
- Jeszcze rzadziej i tylko wyzwalana przez szybkie neutrony zachodzi reakcja (n,3n), którą pokazano na rysunku z jednym przykładem, oznaczonym długą strzałką w lewo.
Oprócz tych reakcji jądrowych indukowanych neutronami lub promieniami gamma, radioaktywna konwersja nuklidów aktynowców wpływa również na inwentaryzację nuklidów w reaktorze. Te typy rozpadu zaznaczono na rysunku ukośnymi strzałkami. Rozpad beta-minus , oznaczony strzałką skierowaną w górę w lewo, odgrywa główną rolę w równowadze gęstości cząstek nuklidów. Nuklidy rozpadające się w wyniku emisji pozytonów (rozpad beta-plus) lub wychwytu elektronów (ϵ) nie występują w reaktorze jądrowym, z wyjątkiem produktów reakcji nokautu; ich rozpady są zaznaczone strzałkami skierowanymi w dół w prawo. Ze względu na długi okres półtrwania danych nuklidów rozpad alfa nie odgrywa prawie żadnej roli w powstawaniu i rozpadzie aktynowców w reaktorze energetycznym, ponieważ czas przebywania paliwa jądrowego w rdzeniu reaktora jest raczej krótki (kilka lat ). Wyjątkiem są dwa stosunkowo krótkotrwałe nuklidy 242 Cm (T 1/2 = 163 d) i 236 Pu (T 1/2 = 2,9 y). Tylko w tych dwóch przypadkach rozpad α jest oznaczony na mapie nuklidów długą strzałką skierowaną w dół-lewo. Kilku długowiecznych izotopów aktynowców, takich jak 244 Pu i 250 Cm, nie można wyprodukować w reaktorach, ponieważ wychwyt neutronów nie zachodzi wystarczająco szybko, aby ominąć krótkotrwałe nuklidy rozkładające beta 243 Pu i 249 Cm; mogą jednak powstawać w wybuchach jądrowych, które mają znacznie większe strumienie neutronów.
Dystrybucja w przyrodzie

Tor i uran są najobficiej występującymi aktynowcami w przyrodzie o odpowiednich stężeniach masowych 16 ppm i 4 ppm. Uran występuje głównie w skorupie ziemskiej jako mieszanina jego tlenków w minerale uraninicie , który jest również nazywany blendą smołową ze względu na swój czarny kolor. Istnieje kilkadziesiąt innych minerałów uranu, takich jak karnotyt (KUO 2 VO 4 ·3H 2 O) i autunit (Ca(UO 2 ) 2 (PO 4 ) 2 ·nH 2 O). Skład izotopowy naturalnego uranu wynosi 238 U (względna obfitość 99,2742%), 235 U (0,7204%) i 234 U (0,0054%); z tych 238 U ma największy okres półtrwania wynoszący 4,51 × 10 9 lat. Światowa produkcja uranu w 2009 roku wyniosła 50 572 ton , z czego 27,3% wydobyto w Kazachstanie . Inne ważne kraje wydobywające uran to Kanada (20,1%), Australia (15,7%), Namibia (9,1%), Rosja (7,0%) i Niger (6,4%).
| Kruszec | Lokalizacja |
uranu , % |
Stosunek masowy 239 Pu/ruda |
Stosunek 239 Pu/U ( × 10 12 ) |
|---|---|---|---|---|
| Uraninit | Kanada | 13,5 | 9,1 × 10-12 _ | 7.1 |
| Uraninit | Kongo | 38 | 4,8 × 10-12 _ | 12 |
| Uraninit | Kolorado , Stany Zjednoczone | 50 | 3,8 × 10-12 _ | 7.7 |
| monacyt | Brazylia | 0,24 | 2,1 × 10-14 _ | 8.3 |
| monacyt | Karolina Północna , Stany Zjednoczone | 1,64 | 5,9 × 10-14 _ | 3.6 |
| fergusonit | - | 0,25 | < 1 × 10-14 | <4 |
| Karnotyt | - | 10 | < 4 × 10-14 | <0,4 |
Najbardziej rozpowszechnionymi minerałami toru są torianit ( ThO 2 ), toryt ( ThSiO 4 ) i monacyt ( (Th,Ca,Ce)PO 4 ). Większość minerałów toru zawiera uran i odwrotnie; i wszystkie mają znaczną frakcję lantanowców. Bogate złoża minerałów toru znajdują się w Stanach Zjednoczonych (440 000 ton), Australii i Indiach (po ~300 000 ton) oraz Kanadzie (~100 000 ton).
w skorupie ziemskiej wynosi tylko około 5 × 10-15 %. Aktyn występuje głównie w minerałach zawierających uran, ale także w innych minerałach, choć w znacznie mniejszych ilościach. Zawartość aktynu w większości obiektów naturalnych odpowiada równowadze izotopowej macierzystego izotopu 235 U i nie ma na nią wpływu słaba migracja Ac. Protaktyn występuje w większej ilości ( 10-12 %) w skorupie ziemskiej niż aktyn. Został odkryty w rudzie uranu w 1913 roku przez Fajansa i Göhringa. Podobnie jak w przypadku aktynu, dystrybucja protaktyny jest zgodna z dystrybucją 235 U.
Okres półtrwania najdłużej żyjącego izotopu neptunu, 237 Np , jest znikomy w porównaniu z wiekiem Ziemi. Tak więc neptun występuje w przyrodzie w znikomych ilościach i powstaje jako pośrednie produkty rozpadu innych izotopów. Ślady plutonu w minerałach uranu po raz pierwszy znaleziono w 1942 r., A bardziej systematyczne wyniki dotyczące 239 Pu podsumowano w tabeli (w tych próbkach nie można było wykryć żadnych innych izotopów plutonu). Górna granica obfitości najdłużej żyjącego izotopu plutonu, 244 Pu , wynosi 3 × 10-20 %. Plutonu nie można było wykryć w próbkach księżycowej gleby. Ze względu na jego niedobór w przyrodzie większość plutonu jest produkowana syntetycznie.
Ekstrakcja

Ze względu na małą liczebność aktynowców ich ekstrakcja jest złożonym, wieloetapowym procesem. Fluorki aktynowców są zwykle stosowane, ponieważ są nierozpuszczalne w wodzie i można je łatwo oddzielić w reakcjach redoks . Fluorki są redukowane za pomocą wapnia , magnezu lub baru :
Spośród aktynowców najłatwiej wyodrębnić tor i uran. Tor jest ekstrahowany głównie z monacytu : pirofosforan toru (ThP 2 O 7 ) poddaje się reakcji z kwasem azotowym , a powstały azotan toru traktuje się fosforanem tributylu . Zanieczyszczenia pierwiastkami ziem rzadkich są oddzielane przez zwiększanie pH w roztworze siarczanu.
W innej metodzie ekstrakcji monacyt rozkłada się 45% wodnym roztworem wodorotlenku sodu w temperaturze 140 ° C. Najpierw ekstrahuje się mieszane wodorotlenki metali, przesącza w temperaturze 80°C, przemywa wodą i rozpuszcza w stężonym kwasie solnym . Następnie kwaśny roztwór zobojętnia się wodorotlenkami do pH = 5,8, w wyniku czego wytrąca się wodorotlenek toru (Th(OH) 4 ) zanieczyszczony ~3% wodorotlenkami metali ziem rzadkich; reszta wodorotlenków metali ziem rzadkich pozostaje w roztworze. Wodorotlenek toru rozpuszcza się w kwasie nieorganicznym, a następnie oczyszcza z pierwiastków ziem rzadkich . Skuteczną metodą jest rozpuszczenie wodorotlenku toru w kwasie azotowym, ponieważ otrzymany roztwór można oczyścić poprzez ekstrakcję rozpuszczalnikami organicznymi:
- Th(OH) 4 + 4 HNO 3 → Th(NO 3 ) 4 + 4 H 2 O
Metaliczny tor jest oddzielany od bezwodnego tlenku, chlorku lub fluorku w reakcji z wapniem w obojętnej atmosferze:
- ThO 2 + 2 Ca → 2 CaO + Th
Czasami tor jest ekstrahowany przez elektrolizę fluorku w mieszaninie chlorku sodu i potasu w temperaturze 700–800 ° C w tyglu grafitowym . Wysoce czysty tor można wyekstrahować z jego jodku za pomocą procesu kryształowego pręta .
Uran jest wydobywany z jego rud na różne sposoby. W jednej metodzie ruda jest spalana, a następnie poddawana reakcji z kwasem azotowym w celu przekształcenia uranu w stan rozpuszczony. Traktowanie roztworu roztworem fosforanu tributylu (TBP) w nafcie powoduje przekształcenie uranu w formę organiczną UO 2 (NO 3 ) 2 (TBP) 2 . Nierozpuszczalne zanieczyszczenia są filtrowane, a uran ekstrahowany w reakcji z wodorotlenkami jako (NH 4 ) 2 U 2 O 7 lub z nadtlenkiem wodoru jako UO 4 ·2H 2 O.
Kiedy ruda uranu jest bogata w takie minerały jak dolomit , magnezyt itp., minerały te zużywają dużo kwasu. W tym przypadku do ekstrakcji uranu stosowana jest metoda węglanowa. Jego głównym składnikiem jest wodny roztwór węglanu sodu , który przekształca uran w kompleks [UO 2 (CO 3 ) 3 ] 4− , który jest stabilny w roztworach wodnych przy niskich stężeniach jonów wodorotlenkowych. Zaletą metody z węglanem sodu jest to, że chemikalia mają niską korozyjność (w porównaniu z azotanami) oraz to, że większość metali innych niż uran wytrąca się z roztworu. Wadą jest to, że wytrącają się również czterowartościowe związki uranu. Dlatego rudę uranu traktuje się węglanem sodu w podwyższonej temperaturze i pod ciśnieniem tlenu:
- 2 UO 2 + O 2 + 6 CO
2− 3 → 2 [UO 2 (CO 3 ) 3 ] 4−
Z równania tego wynika, że najlepszym rozpuszczalnikiem do przetwarzania węglanu uranu jest mieszanina węglanu z wodorowęglanem. Przy wysokim pH powoduje to wytrącenie diuranianu, który jest traktowany wodorem w obecności niklu, dając nierozpuszczalny tetrawęglan uranu.
Inna metoda separacji wykorzystuje żywice polimerowe jako polielektrolit . Procesy wymiany jonowej w żywicach skutkują oddzieleniem uranu. Uran z żywic przemywa się roztworem azotanu amonu lub kwasu azotowego, co daje azotan uranylu , UO 2 (NO 3 ) 2 ·6H 2 O. Po podgrzaniu zamienia się w UO 3 , który jest przekształcany w UO 2 za pomocą wodoru:
- UO 3 + H 2 → UO 2 + H 2 O
Reakcja dwutlenku uranu z kwasem fluorowodorowym zmienia go w tetrafluorek uranu , który daje uran metaliczny w reakcji z metalicznym magnezem:
- 4 HF + UO 2 → UF 4 + 2 H 2 O
do otrzymanego roztworu dodaje się środek redukujący ( FeSO 4 lub H 2 O 2 ). Dodatek ten zmienia stopień utlenienia plutonu z +6 na +4, podczas gdy uran pozostaje w postaci azotanu uranylu (UO 2 (NO 3 ) 2 ). Roztwór traktuje się środkiem redukującym i zobojętnia węglanem amonu do pH = 8, co powoduje wytrącenie związków Pu 4+ .
W innej metodzie Pu 4+ i UO
2+ 2 najpierw ekstrahuje się fosforanem tributylu, a następnie poddaje reakcji z hydrazyną, wypłukując odzyskany pluton.
Główną trudnością w separacji aktynu jest podobieństwo jego właściwości do właściwości lantanu. Tak więc aktyn jest albo syntetyzowany w reakcjach jądrowych z izotopów radu, albo oddzielany za pomocą procedur wymiany jonowej.
Nieruchomości
Aktynowce mają podobne właściwości do lantanowców. Powłoki elektroniczne 6d i 7s są wypełnione aktynem i torem, a powłoka 5f jest wypełniana przy dalszym wzroście liczby atomowej; powłoka 4 f jest wypełniona lantanowcami. Pierwszy eksperymentalny dowód na wypełnienie powłoki 5 f aktynowcami uzyskali McMillan i Abelson w 1940 r. Podobnie jak w przypadku lantanowców (patrz skurcz lantanowców ), promień jonowy aktynowców maleje monotonicznie wraz z liczbą atomową (patrz także zasada Aufbau ).
| Element | Ak | Cz | Rocznie | u | np | Pu | Jestem | Cm | Bk | por | Es | Fm | Md | NIE | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ładunek rdzeniowy ( Z ) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| masa atomowa | [227] | 232.0377(4) | 231.03588(2) | 238.02891(3) | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| Liczba naturalnych izotopów | 3 | 7 | 3 | 8 | 3 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Naturalne izotopy | 225, 227–228 | 227-232, 234 | 231, 233–234 | 233–240 | 237, 239–240 | 238–240, 244 | — | — | — | — | — | — | — | — | — |
| Izotopy w ilości naturalnej | — | 230, 232 | 231 | 234, 235, 238 | — | — | — | — | — | — | — | — | — | — | — |
| Najdłużej żyjący izotop | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| Okres półtrwania najdłużej żyjącego izotopu | 21,8 lat | 14 miliardów lat | 32 500 lat | 4,47 miliarda lat | 2,14 miliona lat | 80,8 miliona lat | 7370 lat | 15,6 miliona lat | 1380 lat | 900 lat | 1,29 roku | 100,5 dnia | 52 dni | 58 min | 11 godzin |
| Najpopularniejszy izotop | 227 | 232 | 231 | 238 | 237 | 239 | 241 | 244 | 249 | 252 | 253 | 255 | 256 | 255 | 260 |
| Okres półtrwania najpowszechniejszego izotopu | 21,8 lat | 14 miliardów lat | 32 500 lat | 4,47 miliarda lat | 2,14 miliona lat | 24 100 lat | 433 lata | 18,1 lat | 320 dni | 2,64 roku | 20,47 dni | 20.07 godz | 78 min | 3,1 min | 2,7 minuty |
|
Konfiguracja elektroniczna w stanie podstawowym (faza gazowa) |
6d 1 7s 2 | 6d 2 7s 2 | 5f 2 6d 1 7s 2 | 5f 3 6d 1 7s 2 | 5f 4 6d 1 7s 2 | 5f 6 7s 2 | 5f 7 7s 2 | 5f 7 6d 1 7s 2 | 5f 9 7s 2 | 5f 10 7s 2 | 5f 11 7s 2 | 5f 12 7s 2 | 5f 13 7s 2 | 5f 14 7s 2 | 5f 14 7s 2 7p 1 |
| Stany utleniania | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5 , 6, 7 | 3, 4 , 5, 6, 7 | 2, 3 , 4, 5, 6, 7 | 2, 3 , 4, 6 | 2, 3 , 4 | 2, 3 , 4 | 2, 3 , 4 | 2, 3 | 2, 3 | 2 , 3 | 3 |
| Promień metaliczny (nm) | 0,203 | 0,180 | 0,162 | 0,153 | 0,150 | 0,162 | 0,173 | 0,174 | 0,170 | 0,186 | 0,186 | ? 0,198 | ? 0,194 | ? 0,197 | ? 0,171 |
|
Promień jonowy (nm): An 4+ An 3+ |
— 0,126 |
0,114 — |
0,104 0,118 |
0,103 0,118 |
0,101 0,116 |
0,100 0,115 |
0,099 0,114 |
0,099 0,112 |
0,097 0,110 |
0,096 0,109 |
0,085 0,098 |
0,084 0,091 |
0,084 0,090 |
0,084 0,095 |
0,083 0,088 |
|
Temperatura (°C): topienie wrzenie |
1050 3198 |
1842 4788 |
1568 ? 4027 |
1132.2 4131 |
639 ? 4174 |
639,4 3228 |
1176 ? 2607 |
1340 3110 |
986 2627 |
900 ? 1470 |
860 ? 996 |
1530 — |
830 — |
830 — |
1630 — |
| Gęstość, g/cm 3 | 10.07 | 11.78 | 15.37 | 19.06 | 20.45 | 19.84 | 11.7 | 13.51 | 14.78 | 15.1 | 8.84 | ? 9.7 | ? 10.3 | ? 9.9 | ? 14.4 |
|
0 0 Standardowy potencjał elektrody (V): E ° (An 4+ /An ) E ° (An 3+ /An ) |
— −2.13 |
−1,83 — |
−1,47 — |
−1,38 −1,66 |
−1,30 −1,79 |
−1,25 −2,00 |
−0,90 −2,07 |
−0,75 −2,06 |
−0,55 −1,96 |
−0,59 −1,97 |
−0,36 −1,98 |
−0,29 −1,96 |
— −1,74 |
— −1,20 |
— −2.10 |
|
Kolor: [M(H 2 O) n ] 4+ [M(H 2 O) n ] 3+ |
— Bezbarwny |
Bezbarwny niebieski |
Żółty Ciemnoniebieski |
zielony fioletowy |
Żółto-zielony Fioletowy |
Brązowy Fiolet |
czerwona róża |
Żółty Bezbarwny |
Beżowy Żółto-zielony |
Zielony Zielony |
— Różowy |
— — |
— — |
— — |
— — |
|
Przybliżone kolory jonów aktynowców w roztworze wodnym Kolory aktynowców 100–103 są nieznane, ponieważ nie zsyntetyzowano jeszcze wystarczających ilości. Barwa CmO2 + 2 również nie została zarejestrowana.
|
|||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aktynowiec ( Z ) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| Stan utlenienia | |||||||||||||||
| +2 | FM 2+ | Md 2+ | nr 2+ | ||||||||||||
| +3 | Ac 3+ | 3+ _ | Pa 3+ | U 3+ | Np 3+ | pu 3+ | Mam 3+ | cm 3+ | Bk 3+ | Por. 3+ | Es 3+ | FM 3+ | Md 3+ | nr 3+ | Lr 3+ |
| +4 | 4+ _ | 4+ _ | U 4+ | Np 4+ | pu 4+ | Mam 4+ | cm 4+ | Bk 4+ | Por. 4+ | ||||||
| +5 |
PaO + 2 |
UO + 2 |
NpO + 2 |
PuO + 2 |
AmO + 2 |
||||||||||
| +6 |
UO 2+ 2 |
NpO 2+ 2 |
PuO 2+ 2 |
AmO 2+ 2 |
CmO 2+ 2 |
||||||||||
| +7 |
NpO 3+ 2 |
PuO 3+ 2 |
AmO 3− 5 |
||||||||||||
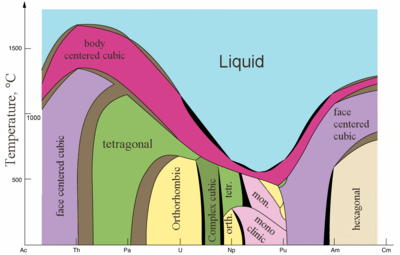
Właściwości fizyczne
|

|
| Główne struktury krystaliczne niektórych aktynowców a temperatura | metaliczne i jonowe aktynowców |

Aktynowce to typowe metale. Wszystkie są miękkie i mają srebrzysty kolor (ale matowieją w powietrzu), stosunkowo dużą gęstość i plastyczność. Niektóre z nich można kroić nożem. Ich oporność elektryczna waha się między 15 a 150 µΩ·cm. Twardość toru jest podobna do twardości miękkiej stali, więc ogrzany czysty tor można zwijać w arkusze i wciągać w drut. Tor jest prawie w połowie tak gęsty jak uran i pluton, ale jest twardszy niż którykolwiek z nich. Wszystkie aktynowce są radioaktywne, paramagnetyczne i, z wyjątkiem aktynu, mają kilka faz krystalicznych: pluton ma siedem, a uran, neptun i kaliforn trzy. Struktury krystaliczne protaktynu, uranu, neptunu i plutonu nie mają wyraźnych analogów wśród lantanowców i są bardziej podobne do struktur 3- d - metali przejściowych .
Wszystkie aktynowce są piroforyczne , zwłaszcza gdy są drobno rozdrobnione, to znaczy spontanicznie zapalają się w reakcji z powietrzem w temperaturze pokojowej. Temperatura topnienia aktynowców nie ma wyraźnej zależności od liczby f -elektronów. Niezwykle niską temperaturę topnienia neptunu i plutonu (~640 ° C) tłumaczy się hybrydyzacją orbitali 5 f i 6 d oraz tworzeniem wiązań kierunkowych w tych metalach.
| Lantanowce | Ln 3+ , Å | Aktynowce | An 3+ , Å | An 4+ , Å |
|---|---|---|---|---|
| Lantan | 1.061 | Aktyn | 1.11 | – |
| Cer | 1.034 | Tor | 1.08 | 0,99 |
| prazeodym | 1.013 | Protaktyn | 1.05 | 0,93 |
| neodym | 0,995 | Uran | 1.03 | 0,93 |
| Promet | 0,979 | Neptun | 1.01 | 0,92 |
| Samar | 0,964 | Pluton | 1.00 | 0,90 |
| Europ | 0,950 | ameryk | 0,99 | 0,89 |
| Gadolin | 0,938 | Kiur | 0,98 | 0,88 |
| Terb | 0,923 | Berkelium | – | – |
| Dysproz | 0,908 | Kaliforn | – | – |
| Holmium | 0,894 | Einsteinium | – | – |
| Erb | 0,881 | Ferm | – | – |
| Tul | 0,869 | Mendelew | – | – |
| Iterb | 0,858 | Nobel | – | – |
| lutet | 0,848 | lawren | – | – |
Właściwości chemiczne
Podobnie jak lantanowce, wszystkie aktynowce są wysoce reaktywne z halogenami i chalkogenami ; jednak aktynowce reagują łatwiej. Aktynowce, zwłaszcza te o małej liczbie elektronów 5- f , są podatne na hybrydyzację . Wyjaśnia to podobieństwo energii elektronów na powłokach 5 f , 7 s i 6 d . Większość aktynowców wykazuje większą różnorodność stanów walencyjnych, a najbardziej stabilne to +6 dla uranu, +5 dla protaktynu i neptunu, +4 dla toru i plutonu oraz +3 dla aktynu i innych aktynowców.
Aktyn jest chemicznie podobny do lantanu, co tłumaczy się podobnymi promieniami jonowymi i strukturami elektronowymi. Podobnie jak lantan, aktyn prawie zawsze ma stopień utlenienia +3 w związkach, ale jest mniej reaktywny i ma bardziej wyraźne właściwości podstawowe . Spośród innych trójwartościowych aktynowców Ac 3+ jest najmniej kwaśny, czyli ma najsłabszą tendencję do hydrolizy w roztworach wodnych.
Tor jest raczej aktywny chemicznie. Ze względu na brak elektronów na orbitali 6 d i 5 f czterowartościowe związki toru są bezbarwne. Przy pH < 3 w roztworach soli toru dominują kationy [Th(H 2 O) 8 ] 4+ . Jon Th 4+ jest stosunkowo duży iw zależności od liczby koordynacyjnej może mieć promień od 0,95 do 1,14 Å. W rezultacie sole toru mają słabą tendencję do hydrolizy. Cechą charakterystyczną soli toru jest ich wysoka rozpuszczalność zarówno w wodzie, jak i polarnych rozpuszczalnikach organicznych.
Protaktyn wykazuje dwa stany walencyjne; +5 jest stabilny, a stan +4 łatwo utlenia się do protaktyny (V). Tak więc czterowartościowy protaktyn w roztworach otrzymuje się w wyniku działania silnych środków redukujących w atmosferze wodoru. Czterowartościowy protaktyn jest chemicznie podobny do uranu (IV) i toru (IV). Fluorki, fosforany, podfosforany, jodan i fenyloarsoniany protaktyny(IV) są nierozpuszczalne w wodzie i rozcieńczonych kwasach. Protaktyn tworzy rozpuszczalne węglany. Właściwości hydrolityczne pięciowartościowego protaktynu są zbliżone do właściwości tantalu (V) i niobu (V). Złożone zachowanie chemiczne protaktynu jest konsekwencją rozpoczęcia procesu wypełniania się otoczki 5 f w tym pierwiastku.
Uran ma wartościowość od 3 do 6, przy czym ta ostatnia jest najbardziej stabilna. W stanie sześciowartościowym uran jest bardzo podobny do pierwiastków z grupy 6 . Wiele związków uranu(IV) i uranu(VI) jest niestechiometrycznych , tzn. ma zmienny skład. Na przykład rzeczywisty wzór chemiczny dwutlenku uranu to UO 2+x , gdzie x waha się między -0,4 a 0,32. Związki uranu(VI) są słabymi utleniaczami . Większość z nich zawiera liniową grupę „ uranylową ”, UO
2+ 2 . W płaszczyźnie równikowej prostopadłej do grupy uranylowej może znajdować się od 4 do 6 ligandów. Grupa uranylowa działa jak twardy kwas i tworzy silniejsze kompleksy z ligandami będącymi donorami tlenu niż z ligandami będącymi donorami azotu. NpO
2+ 2 i PuO
2+ 2 są również powszechną formą Np i Pu na stopniu utlenienia +6. Związki uranu(IV) wykazują właściwości redukujące, np. łatwo ulegają utlenieniu pod wpływem tlenu atmosferycznego. Uran(III) jest bardzo silnym reduktorem. Ze względu na obecność d-powłoki uran (podobnie jak wiele innych aktynowców) tworzy związki metaloorganiczne , takie jak U III (C 5 H 5 ) 3 i U IV (C 5 H 5 ) 4 .
Neptun ma stany walencyjne od 3 do 7, które można jednocześnie zaobserwować w roztworach. Najbardziej stabilny stan w roztworze to +5, ale wartościowość +4 jest preferowana w stałych związkach neptunu. Metaliczny neptun jest bardzo reaktywny. Jony neptunu są podatne na hydrolizę i tworzenie związków koordynacyjnych .
Pluton wykazuje również stany walencyjne między 3 a 7 włącznie, a zatem jest chemicznie podobny do neptunu i uranu. Jest wysoce reaktywny i szybko tworzy warstwę tlenku w powietrzu. Pluton reaguje z wodorem nawet w temperaturach tak niskich, jak 25–50 ° C; łatwo tworzy również halogenki i związki międzymetaliczne . Reakcje hydrolizy jonów plutonu o różnych stopniach utlenienia są dość zróżnicowane. Pluton(V) może wchodzić w polimeryzacji .
Największą różnorodność chemiczną wśród aktynowców obserwuje się w ameryku, który może mieć wartościowość od 2 do 6. Ameryk dwuwartościowy otrzymuje się tylko w suchych związkach i roztworach niewodnych ( acetonitryl ). Stopnie utlenienia +3, +5 i +6 są typowe dla roztworów wodnych, ale także w stanie stałym. Czterowartościowy ameryk tworzy trwałe związki stałe (dwutlenek, fluorek i wodorotlenek) oraz kompleksy w roztworach wodnych. Donoszono, że w roztworze alkalicznym ameryk można utlenić do stanu siedmiowartościowego, ale dane te okazały się błędne. Najbardziej stabilna wartościowość ameryku wynosi 3 w roztworach wodnych i 3 lub 4 w związkach stałych.
Walencja 3 dominuje we wszystkich kolejnych pierwiastkach aż do lawrenu (z wyjątkiem nobelu). Kur może być czterowartościowy w ciałach stałych (fluorek, dwutlenek). Berkel, wraz z wartościowością +3, wykazuje również wartościowość +4, bardziej stabilną niż kiur; wartościowość 4 obserwuje się w stałym fluorku i dwutlenku. Stabilność Bk 4+ w roztworze wodnym jest zbliżona do stabilności Ce 4+ . Tylko wartościowość 3 zaobserwowano dla kalifornu, einsteinu i fermu. Stan dwuwartościowy jest udowodniony dla mendelewium i nobelium, aw nobelium jest bardziej stabilny niż stan trójwartościowy. Lawrens wykazuje wartościowość 3 zarówno w roztworach, jak iw ciałach stałych.
Wzrasta potencjał redoks od −0,32 V w uranie, przez 0,34 V (Np) i 1,04 V (Pu) do 1,34 V w ameryku, co świadczy o wzrastającej zdolności redukcyjnej jonu An 4+ z ameryku do uranu. Wszystkie aktynowce tworzą wodorki AnH 3 o czarnej barwie i właściwościach podobnych do soli. Aktynowce wytwarzają również węgliki o ogólnym wzorze AnC lub AnC 2 (U 2 C 3 dla uranu) oraz siarczki An 2 S 3 i AnS 2 .
związki
Tlenki i wodorotlenki
| Mieszanina | Kolor | Kryształowa symetria, typ | Stałe sieciowe, Å | Gęstość, g/cm 3 | Temperatura, °C | ||
|---|---|---|---|---|---|---|---|
| A | B | C | |||||
| Ac 2 O 3 | Biały | Sześciokątny, La 2 O 3 | 4.07 | - | 6.29 | 9.19 | – |
| PaO 2 | - | Sześcienny, CaF 2 | 5.505 | - | - | - | - |
| Pa 2 O 5 | Biały |
sześcienny, CaF 2 sześcienny czworokątny sześciokątny rombowy rombowy |
5,446 10,891 5,429 3,817 5,425 6,92 |
- - - - - 4.02 |
- 10,992 5,503 13,22 - 4,18 |
- |
700 700–1100 1000 1000–1200 1240–1400 – |
| ThO 2 | Bezbarwny | Sześcienny | 5,59 | - | - | 9.87 | – |
| UO 2 | Czarny brązowy | Sześcienny | 5.47 | - | - | 10.9 | – |
| NpO 2 | Zielonkawo-brązowy | Sześcienny, CaF 2 | 5.424 | - | - | 11.1 | – |
| PuO | Czarny | sześcienny, NaCl | 4,96 | - | - | 13,9 | – |
| PuO 2 | Zielona oliwka | Sześcienny | 5.39 | - | - | 11.44 | – |
| Poprawka 2 O 3 |
Czerwono-brązowy Czerwono-brązowy |
Sześcienny, Mn 2 O 3 Sześciokątny, La 2 O 3 |
11,03 3,817 |
- |
- 5.971 |
10,57 11,7 |
– |
| AmO 2 | Czarny | Sześcienny, CaF 2 | 5.376 | - | - | - | - |
| Cm 2 O 3 |
Biały - - |
Sześcienny, Mn 2 O 2 Sześciokątny, LaCl 3 Jednoskośny, Sm 2 O 3 |
11,01 3,80 14,28 |
- - 3,65 |
- 6 8.9 |
11.7 | – |
| CmO 2 | Czarny | Sześcienny, CaF 2 | 5.37 | - | - | - | - |
| Bk 2 O 3 | Jasnobrązowy | Sześcienny, Mn 2 O 3 | 10.886 | - | - | - | - |
| BkO 2 | Kasztanowy | Sześcienny, CaF 2 | 5.33 | - | - | - | - |
| Por. 2 O 3 |
Bezbarwny Żółtawy - |
Sześcienny, Mn 2 O 3 Jednoskośny, Sm 2 O 3 Sześciokątny, La 2 O 3 |
10,79 14,12 3,72 |
- 3,59 - |
- 8,80 5,96 |
- | - |
| CfO 2 | Czarny | Sześcienny | 5.31 | - | - | - | - |
| Es 2 O 3 | - |
Sześcienny, Mn 2 O 3 Jednoskośny sześciokątny, La 2 O 3 |
10,07 14,1 3,7 |
- 3,59 - |
- 8,80 6 |
- | - |
| Stan utlenienia | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | Pu 2 O 3 | Poprawka 2 O 3 | Cm 2 O 3 | Bk 2 O 3 | Por. 2 O 3 | Es 2 O 3 | |||||
| +4 | ThO 2 | PaO 2 | UO 2 | NpO 2 | PuO 2 | AmO 2 | CmO 2 | BkO 2 | CfO 2 | ||
| +5 | Pa 2 O 5 | U 2 O 5 | Np 2 O 5 | ||||||||
| +5,+6 | U 3 O 8 | ||||||||||
| +6 | UO 3 |
| Wzór chemiczny | ThO 2 | PaO 2 | UO 2 | NpO 2 | PuO 2 | AmO 2 | CmO 2 | BkO 2 | CfO 2 |
| Numer CAS | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| Masa cząsteczkowa | 264.04 | 263.035 | 270.03 | 269.047 | 276.063 | 275.06 | 270–284** | 279.069 | 283.078 |
| Temperatura topnienia | 3390°C | 2865°C | 2547°C | 2400°C | 2175°C | ||||
| Struktura krystaliczna |
 An 4+ : __ / O 2− : __ |
||||||||
| Grupa kosmiczna | Fm 3 m | ||||||||
| Numer koordynacyjny | An [8], O [4] | ||||||||
An – aktynowce **W zależności od izotopów
Niektóre aktynowce mogą występować w kilku formach tlenkowych, takich jak An 2 O 3 , AnO 2 , An 2 O 5 i AnO 3 . Dla wszystkich aktynowców tlenki AnO 3 są amfoteryczne , a An 2 O 3 , AnO 2 i An 2 O 5 są zasadowe, łatwo reagują z wodą, tworząc zasady:
- An 2 O 3 + 3 H 2 O → 2 An (OH) 3 .
Zasady te są słabo rozpuszczalne w wodzie i swoją aktywnością zbliżone są do wodorotlenków metali ziem rzadkich. Np(OH) 3 nie został jeszcze zsyntetyzowany, Pu(OH) 3 ma kolor niebieski, podczas gdy Am(OH) 3 jest różowy, a wodorotlenek kuru Cm(OH) 3 jest bezbarwny. Znane są również Bk(OH) 3 i Cf(OH) 3 , podobnie jak wodorotlenki czterowartościowe dla Np, Pu i Am oraz pięciowartościowe dla Np i Am.
Najsilniejszą zasadą jest aktyn. Wszystkie związki aktynu są bezbarwne, z wyjątkiem czarnego siarczku aktynu (Ac 2 S 3 ). Dwutlenki czterowartościowych aktynowców krystalizują w układzie sześciennym , podobnie jak we fluorku wapnia .
Tor reagując z tlenem tworzy wyłącznie dwutlenek:
Dwutlenek toru jest materiałem ogniotrwałym o najwyższej temperaturze topnienia spośród wszystkich znanych tlenków (3390 ° C). Dodanie 0,8–1% ThO 2 do wolframu stabilizuje jego strukturę, dzięki czemu domieszkowane włókna mają lepszą odporność mechaniczną na wibracje. Aby rozpuścić ThO 2 w kwasach, ogrzewa się go do 500–600 °C; ogrzewanie powyżej 600 °C daje bardzo odporną na kwasy i inne odczynniki postać ThO 2 . Niewielki dodatek jonów fluorkowych katalizuje rozpuszczanie dwutlenku toru w kwasach.
Otrzymano dwa tlenki protaktynu: PaO 2 (czarny) i Pa 2 O 5 (biały); pierwszy jest izomorficzny z ThO2, a drugi jest łatwiejszy do uzyskania. Oba tlenki są zasadowe, a Pa(OH) 5 jest słabą, słabo rozpuszczalną zasadą.
Rozkład niektórych soli uranu, na przykład UO 2 (NO 3 )·6H 2 O w powietrzu w temperaturze 400 °C, daje pomarańczowy lub żółty UO 3 . Ten tlenek jest amfoteryczny i tworzy kilka wodorotlenków, z których najbardziej stabilny to wodorotlenek uranylu UO 2 (OH) 2 . W wyniku reakcji tlenku uranu(VI) z wodorem powstaje dwutlenek uranu, który ma podobne właściwości do ThO 2 . Ten tlenek jest również zasadowy i odpowiada wodorotlenkowi uranu (U(OH) 4 ).
Pluton, neptun i ameryk tworzą dwa zasadowe tlenki: An 2 O 3 i AnO 2 . Trójtlenek neptunu jest niestabilny; dotychczas można było otrzymać tylko Np 3 O 8 . Jednak tlenki plutonu i neptunu o wzorze chemicznym AnO 2 i An 2 O 3 są dobrze scharakteryzowane.
Sole
| Wzór chemiczny | AcCl 3 | UCI 3 | NpCl 3 | PuCI 3 | AmCl 3 | CmCl 3 | BkCl 3 | CfCI 3 |
|---|---|---|---|---|---|---|---|---|
| Numer CAS | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 |
| Masa cząsteczkowa | 333.386 | 344.387 | 343.406 | 350,32 | 349,42 | 344–358** | 353.428 | 357.438 |
| Temperatura topnienia | 837°C | 800°C | 767°C | 715°C | 695°C | 603°C | 545°C | |
| Temperatura wrzenia | 1657°C | 1767°C | 850°C | |||||
| Struktura krystaliczna |
 An 3+ : __ / Cl - : __ |
|||||||
| Grupa kosmiczna | P6 3 /m | |||||||
| Numer koordynacyjny | An *[9], Cl [3] | |||||||
| Stałe kratowe |
a = 762 pm do = 455 pm |
a = 745,2 pm c = 432,8 pm |
a = 739,4 pm c = 424,3 pm |
a = 738,2 pm c = 421,4 pm |
a = 726 pm do = 414 pm |
a = 738,2 pm c = 412,7 pm |
a = 738 pm do = 409 pm |
|
* An – aktynowce **W zależności od izotopów
| Mieszanina | Kolor | Kryształowa symetria, typ | Stałe sieciowe, Å | Gęstość, g/cm 3 | ||
|---|---|---|---|---|---|---|
| A | B | C | ||||
| Ac F 3 | Biały | Sześciokątny, LaF 3 | 4.27 | - | 7.53 | 7,88 |
| PaF 4 | Ciemny brąz | Jednoskośny | 12.7 | 10.7 | 8.42 | – |
| PaF 5 | Czarny | Tetragonalny , β-UF 5 | 11.53 | - | 5.19 | – |
| CzF 4 | Bezbarwny | Jednoskośny | 13 | 10,99 | 8.58 | 5.71 |
| UF 3 | Czerwono-fioletowy | Sześciokątny | 7.18 | - | 7.34 | 8.54 |
| UF 4 | Zielony | Jednoskośny | 11.27 | 10.75 | 8.40 | 6.72 |
| α-UF 5 | Niebieskawy | Tetragonalny | 6.52 | - | 4.47 | 5.81 |
| β-UF 5 | Niebieskawy | Tetragonalny | 11.47 | - | 5.20 | 6.45 |
| UF 6 | Żółtawy | Rombowy | 9,92 | 8,95 | 5.19 | 5.06 |
| NPF 3 | Czarny lub fioletowy | Sześciokątny | 7.129 | - | 7.288 | 9.12 |
| NPF 4 | Jasnozielony | Jednoskośny | 12.67 | 10.62 | 8.41 | 6.8 |
| NPF 6 | Pomarańczowy | Rombowy | 9.91 | 8,97 | 5.21 | 5 |
| PuF 3 | Fioletowo-niebieski | Trójkątny | 7.09 | - | 7.25 | 9.32 |
| PuF 4 | Bladobrązowy | Jednoskośny | 12.59 | 10.57 | 8.28 | 6,96 |
| PuF 6 | Kasztanowy | Rombowy | 9,95 | 9.02 | 3.26 | 4,86 |
| AmF 3 | Różowy lub jasny beż | sześciokątny , LaF 3 | 7.04 | - | 7.255 | 9.53 |
| AmF 4 | Pomarańczowy czerwony | Jednoskośny | 12.53 | 10.51 | 8.20 | – |
| CmF 3 | Od brązu do bieli | Sześciokątny | 4.041 | - | 7.179 | 9.7 |
| CmF 4 | Żółty | Jednoskośny, UF 4 | 12.51 | 10.51 | 8.20 | – |
| BK F 3 | Żółty zielony |
Trygonalny , LaF 3 Rombowy , YF 3 |
6,97 6,7 |
- 7.09 |
7,14 4,41 |
10.15 9.7 |
| BK F 4 | - | Jednoskośny, UF 4 | 12.47 | 10.58 | 8.17 | – |
| por. 3 |
- - |
Trygonalny, LaF 3 Rombowy, YF 3 |
6. 94 6.65 |
- 7.04 |
7,10 4,39 |
– |
| Por. 4 |
- - |
Jednoskośny, UF 4 Jednoskośny, UF 4 |
1,242 1,233 |
1.047 1.040 |
8.126 8.113 |
– |

Aktynowce łatwo reagują z halogenami tworząc sole o wzorach MX 3 i MX 4 (X = halogen ). Tak więc pierwszy związek berkelium, BkCl 3 , został zsyntetyzowany w 1962 roku w ilości 3 nanogramów. Podobnie jak halogeny pierwiastków ziem rzadkich, chlorki , bromki i jodki aktynowców są rozpuszczalne w wodzie, a fluorki są nierozpuszczalne. Uran z łatwością daje bezbarwny sześciofluorek, który sublimuje w temperaturze 56,5 ° C; ze względu na swoją lotność jest stosowany do rozdzielania izotopów uranu za pomocą wirówki gazowej lub dyfuzji gazowej . Sześciofluorki aktynowców mają właściwości zbliżone do bezwodników . Są bardzo wrażliwe na wilgoć i hydrolizują tworząc AnO 2 F 2 . Pentachlorek i czarny sześciochlorek uranu zostały zsyntetyzowane, ale oba są niestabilne.
Działanie kwasów na aktynowce daje sole, a jeśli kwasy nie są utleniające, to aktynowce w soli są w stanie o niskiej wartościowości:
- U + 2 H 2 SO 4 → U (SO 4 ) 2 + 2 H 2
- 2 Pu + 6 HCl → 2 PuCl 3 + 3 H 2
Jednak w tych reakcjach regenerujący się wodór może reagować z metalem, tworząc odpowiedni wodorek. Uran reaguje z kwasami i wodą znacznie łatwiej niż tor.
Sole aktynowców można również otrzymać przez rozpuszczenie odpowiednich wodorotlenków w kwasach. Azotany, chlorki, siarczany i nadchlorany aktynowców są rozpuszczalne w wodzie. Podczas krystalizacji z roztworów wodnych sole te tworzą hydraty, takie jak Th(NO 3 ) 4 ·6H 2 O, Th(SO 4 ) 2 ·9H 2 O i Pu 2 (SO 4 ) 3 ·7H 2 O. Sole aktynowce o wysokiej wartościowości łatwo hydrolizują. Tak więc bezbarwny siarczan, chlorek, nadchloran i azotan toru przekształcają się w sole zasadowe o wzorach Th(OH) 2 SO 4 i Th(OH) 3 NO 3 . Rozpuszczalność i nierozpuszczalność trójwartościowych i czterowartościowych aktynowców jest podobna do soli lantanowców. Tak więc fosforany , fluorki , szczawiany , jodany i węglany aktynowców są słabo rozpuszczalne w wodzie; wytrącają się jako hydraty, takie jak ThF 4 ·3H 2O i Th(CrO 4 ) 2 ·3H 2O .
Aktynowce na stopniu utlenienia +6, z wyjątkiem kationów typu AnO 2 2+ , tworzą [AnO 4 ] 2− , [An 2 O 7 ] 2− i inne złożone aniony. Na przykład uran, neptun i pluton tworzą sole typu Na 2 UO 4 (uranian) i (NH 4 ) 2 U 2 O 7 (diuranian). W porównaniu z lantanowcami aktynowce łatwiej tworzą związki koordynacyjne , a zdolność ta wzrasta wraz z wartościowością aktynowców. Trójwartościowe aktynowce nie tworzą fluorkowych związków koordynacyjnych, podczas gdy czterowartościowy tor tworzy kompleksy K 2 ThF 6 , KThF 5 , a nawet K 5 ThF 9 . Tor tworzy również odpowiednie siarczany (na przykład Na 2 SO 4 ·Th(SO 4 ) 2 ·5H 2 O), azotany i tiocyjaniany. Sole o ogólnym wzorze An 2 Th(NO 3 ) 6 · n H 2 O mają charakter koordynacyjny, o liczbie koordynacyjnej toru równej 12. Jeszcze łatwiej jest wytworzyć złożone sole aktynowców pięcio- i sześciowartościowych. Najbardziej stabilne związki koordynacyjne aktynowców – czterowartościowego toru i uranu – otrzymuje się w reakcjach z diketonami, np. acetyloacetonem .
Aplikacje
Chociaż aktynowce mają pewne ustalone zastosowania w życiu codziennym, takie jak czujniki dymu (ameryk) i płaszcze gazowe (tor), są one najczęściej używane w broni jądrowej i jako paliwo w reaktorach jądrowych. Dwa ostatnie obszary wykorzystują właściwości aktynowców do uwalniania ogromnej energii w reakcjach jądrowych, które w pewnych warunkach mogą stać się samopodtrzymującymi reakcjami łańcuchowymi .
Najważniejszym izotopem do zastosowań w energetyce jądrowej jest uran-235 . Stosowany jest w reaktorze termicznym , a jego stężenie w uranie naturalnym nie przekracza 0,72%. Izotop ten silnie absorbuje neutrony termiczne uwalniając dużo energii. Jeden akt rozszczepienia 1 grama 235 U zamienia się w około 1 MW·dzień. Istotne jest to, że
235 92 U
emituje więcej neutronów niż pochłania; po osiągnięciu masy krytycznej
235 92 U
wchodzi w samopodtrzymującą się reakcję łańcuchową. Zwykle jądro uranu dzieli się na dwa fragmenty z uwolnieniem 2–3 neutronów, na przykład:
Inne obiecujące izotopy aktynowców dla energii jądrowej to tor-232 i jego produkt z cyklu paliwowego toru , uran-233 .
| Reaktor jądrowy |
|
Rdzeń większości reaktorów jądrowych II generacji zawiera zestaw wydrążonych prętów metalowych, zwykle wykonanych ze stopów cyrkonu , wypełnionych granulkami stałego paliwa jądrowego – najczęściej tlenku, węglika, azotku lub monosiarczku uranu, plutonu lub toru lub ich mieszaniną (tzw. - zwane paliwem MOX ). Najpopularniejszym paliwem jest tlenek uranu-235.
Szybkie neutrony są spowalniane przez moderatory , które zawierają wodę, węgiel , deuter lub beryl , jako neutrony termiczne , aby zwiększyć efektywność ich interakcji z uranem-235. Szybkość reakcji jądrowej kontroluje się wprowadzając dodatkowe pręty wykonane z boru lub kadmu lub absorbent cieczy, zwykle kwas borowy . Reaktory do produkcji plutonu nazywane są reaktorami hodowlanymi lub hodowcami; mają inną konstrukcję i wykorzystują szybkie neutrony. |
Emisja neutronów podczas rozszczepienia uranu jest ważna nie tylko dla utrzymania jądrowej reakcji łańcuchowej, ale także dla syntezy cięższych aktynowców. Uran-239 przekształca się poprzez rozpad β w pluton-239, który podobnie jak uran-235 jest zdolny do spontanicznego rozszczepienia. Pierwsze na świecie reaktory jądrowe zostały zbudowane nie dla energii, ale do produkcji plutonu-239 do broni jądrowej.
Około połowa wyprodukowanego toru jest wykorzystywana jako materiał emitujący światło w płaszczach gazowych. Tor jest również dodawany do wieloskładnikowych stopów magnezu i cynku . Stopy Mg-Th są więc lekkie i mocne, ale mają też wysoką temperaturę topnienia i plastyczność, dzięki czemu są szeroko stosowane w przemyśle lotniczym i przy produkcji pocisków . Tor ma również dobre emisyjne , z długą żywotnością i niską barierą potencjału dla emisji. Względna zawartość izotopów toru i uranu jest szeroko stosowana do szacowania wieku różnych obiektów, w tym gwiazd (patrz datowanie radiometryczne ).
Głównym zastosowaniem plutonu była broń jądrowa , gdzie izotop plutonu-239 był kluczowym składnikiem ze względu na łatwość rozszczepienia i dostępność. Konstrukcje oparte na plutonie pozwalają zmniejszyć masę krytyczną do około jednej trzeciej masy uranu-235. Bomby plutonowe typu „Fat Man” wyprodukowane podczas Projektu Manhattan wykorzystywały wybuchową kompresję plutonu w celu uzyskania znacznie wyższych gęstości niż normalnie, w połączeniu z centralnym źródłem neutronów w celu rozpoczęcia reakcji i zwiększenia wydajności. Tak więc tylko 6,2 kg plutonu było potrzebne do wybuchu odpowiadającego 20 kilotonom trotylu . (Zobacz także Projektowanie broni jądrowej .) Hipotetycznie zaledwie 4 kg plutonu — a może nawet mniej — można by użyć do wyprodukowania pojedynczej bomby atomowej przy użyciu bardzo wyrafinowanych projektów montażowych.
Pluton-238 jest potencjalnie bardziej wydajnym izotopem dla reaktorów jądrowych, ponieważ ma mniejszą masę krytyczną niż uran-235, ale nadal uwalnia dużo energii cieplnej (0,56 W/g) w wyniku rozpadu, nawet gdy reakcja łańcuchowa rozszczepienia zostanie zatrzymana przez pręty kontrolne . Jego zastosowanie ogranicza wysoka cena (ok. 1000 USD/g). Izotop ten był używany w termostosach i systemach destylacji wody niektórych satelitów i stacji kosmicznych. Tak więc Galileo i Apollo (np. Apollo 14 ) miały grzejniki zasilane kilogramowymi ilościami tlenku plutonu-238; to ciepło jest również przekształcane w energię elektryczną za pomocą stosów termoelektrycznych. Rozpad plutonu-238 wytwarza stosunkowo nieszkodliwe cząstki alfa i nie towarzyszy mu promieniowanie gamma. Dlatego ten izotop (~160 mg) jest wykorzystywany jako źródło energii w rozrusznikach serca, gdzie działa około 5 razy dłużej niż konwencjonalne baterie.
Aktyn-227 jest używany jako źródło neutronów. Jego wysoka energia właściwa (14,5 W/g) oraz możliwość uzyskania znacznych ilości związków termostabilnych są atrakcyjne do zastosowania w długowiecznych generatorach termoelektrycznych do zdalnego użytku. 228 Ac jest używany jako wskaźnik radioaktywności w badaniach chemicznych, ponieważ emituje elektrony o wysokiej energii (2,18 MeV), które można łatwo wykryć. Mieszaniny 228 Ac - 228 Ra są szeroko stosowane jako źródło intensywnego promieniowania gamma w przemyśle i medycynie.
Rozwój samoświecących materiałów domieszkowanych aktynowcami z trwałymi matrycami krystalicznymi to nowy obszar wykorzystania aktynowców, ponieważ dodanie radionuklidów emitujących promieniowanie alfa do niektórych szkieł i kryształów może nadawać luminescencję.
Toksyczność

Substancje radioaktywne mogą szkodzić zdrowiu ludzkiemu poprzez (i) miejscowe zanieczyszczenie skóry, (ii) narażenie wewnętrzne w wyniku spożycia izotopów promieniotwórczych oraz (iii) nadmierne narażenie zewnętrzne w wyniku aktywności β i promieniowania γ . Wraz z pierwiastkami radu i transuranu aktyn jest jedną z najniebezpieczniejszych trucizn radioaktywnych o wysokiej właściwej aktywności α . Najważniejszą cechą aktynu jest jego zdolność do akumulacji i pozostawania w powierzchniowej warstwie szkieletów . W początkowej fazie zatrucia aktyn gromadzi się w wątrobie . Innym niebezpieczeństwem aktynu jest to, że ulega on rozpadowi radioaktywnemu szybciej niż jest wydalany. Adsorpcja z przewodu pokarmowego jest znacznie mniejsza (~ 0,05%) w przypadku aktynu niż radu.
Protaktyn w organizmie ma tendencję do gromadzenia się w nerkach i kościach. Maksymalna bezpieczna dawka protaktynu w organizmie człowieka to 0,03 µCi , co odpowiada 0,5 mikrograma 231 Pa. Ten izotop, który może występować w powietrzu w postaci aerozolu , jest 2,5 × 10 8 razy bardziej toksyczny niż kwas cyjanowodorowy . [ sprzeczne ]
Pluton, który dostaje się do organizmu przez powietrze, pokarm lub krew (np. przez ranę), osadza się głównie w płucach, wątrobie i kościach, a tylko około 10% przechodzi do innych narządów i pozostaje tam przez dziesięciolecia. Długi czas przebywania plutonu w organizmie można częściowo wytłumaczyć jego słabą rozpuszczalnością w wodzie. Niektóre izotopy plutonu emitują jonizujące promieniowanie α, które uszkadza otaczające je komórki. Średnia dawka śmiertelna (LD 50 ) na 30 dni u psów po dożylnym wstrzyknięciu plutonu wynosi 0,32 miligrama na kg masy ciała, a więc dawka śmiertelna dla człowieka wynosi około 22 mg dla osoby ważącej 70 kg; ilość narażenia oddechowego powinna być około cztery razy większa. Inne oszacowanie zakłada, że pluton jest 50 razy mniej toksyczny niż rad , a więc dopuszczalna zawartość plutonu w organizmie powinna wynosić 5 µg lub 0,3 µCi. Taka ilość jest prawie niewidoczna pod mikroskopem. Po próbach na zwierzętach ta maksymalna dopuszczalna dawka została zmniejszona do 0,65 µg lub 0,04 µCi. Badania na zwierzętach wykazały również, że najniebezpieczniejszą drogą narażenia na pluton jest wdychanie, po którym 5–25% wdychanych substancji zatrzymuje się w organizmie. W zależności od wielkości cząstek i rozpuszczalności związków plutonu, pluton jest zlokalizowany albo w płucach, albo w układzie limfatycznym , albo jest wchłaniany do krwi, a następnie transportowany do wątroby i kości. Zanieczyszczenie poprzez żywność jest najmniej prawdopodobnym sposobem. W tym przypadku tylko około 0,05% rozpuszczalnych 0,01% nierozpuszczalnych związków plutonu wchłania się do krwi, a reszta jest wydalana. Ekspozycja uszkodzonej skóry na pluton zatrzymałaby prawie 100% tego.
Stosowanie aktynowców w paliwie jądrowym, zamkniętych źródłach promieniotwórczych lub zaawansowanych materiałach, takich jak samoświecące kryształy, ma wiele potencjalnych korzyści. Jednak poważnym problemem jest niezwykle wysoka radiotoksyczność aktynowców i ich migracja w środowisku. Stosowanie chemicznie nietrwałych postaci aktynowców w MOX i zamkniętych źródłach promieniotwórczych nie jest zgodne z nowoczesnymi standardami bezpieczeństwa. Wyzwaniem jest opracowanie stabilnych i trwałych materiałów zawierających aktynowce, które zapewnią bezpieczne przechowywanie, użytkowanie i ostateczną utylizację. Kluczową potrzebą jest zastosowanie stałych roztworów aktynowców w trwałych krystalicznych fazach macierzystych.
Właściwości jądrowe
| Nuklid | Pół życia | Tryb rozpadu | Frakcja rozgałęziająca | Źródło |
|---|---|---|---|---|
206 81 Tl |
4,202 ± 0,011 m | β- _ | 1.0 | LNHB |
208 81 Tl |
3,060 ± 0,008 m | β- _ | 1.0 | BIPM-5 |
210 82 Pb |
22,20 ± 0,22 r | β- _ | 1.0 | ENSDF |
| α | ( 1,9 ± 0,4 ) x 10-8 | |||
211 82 Pb |
36,1 ± 0,2 m | β- _ | 1.0 | ENSDF |
212 82 Pb |
10,64 ± 0,01 godz | β- _ | 1.0 | BIPM-5 |
214 82 Pb |
26,8 ± 0,9 m | β- _ | 1.0 | ENSDF |
211 83 Bi |
2,14 ± 0,02 m | β- _ | 0,00276 ± 0,00004 | ENSDF |
| α | 0,99724 ± 0,00004 | |||
212 83 Bi |
60,54 ± 0,06 m | α | 0,3593 ± 0,0007 | BIPM-5 |
| β- _ | 0,6407 ± 0,0007 | |||
214 83 Bi |
19,9 ± 0,4 m | α | 0,00021 ± 0,00001 | ENSDF |
| β- _ | 0,99979 ± 0,00001 | |||
210 84 Poz |
138,376 ± 0,002 d | α | 1.0 | ENSDF |
219 86 Rn |
3,96 ± 0,01 sek | α | 1.0 | ENSDF |
220 86 Rn |
55,8 ± 0,3 sek | α | 1.0 | BIPM-5 |
221 87 Ks |
4,9 ± 0,2 m | β- _ | 0,00005 ± 0,00003 | ENSDF |
| α | 0,99995 ± 0,00003 | |||
223 88 Ra |
11,43 ± 0,05 d | α | 1.0 | ENSDF |
| 14 C | ( 8,9 ± 0,4 ) x 10-10 | |||
224 88 Ra |
3,627 ± 0,007 d | α | 1.0 | BIPM-5 |
225 88 Ra |
14,9 ± 0,2 d | β- _ | 1.0 | ENSDF |
226 88 Ra |
( 1,600 ± 0,007 ) x 10 3 r | α | 1.0 | BIPM-5 |
228 88 Ra |
5,75 ± 0,03 r | β- _ | 1.0 | ENSDF |
224 89 Dz |
2,78 ± 0,17 godz | α | 0,091 +0,020 -0,014 | ENSDF |
| WE | 0,909 +0,014 -0,020 | |||
225 89 Dz |
10,0 ± 0,1 d | α | 1.0 | ENSDF |
227 89 Dz |
21,772 ± 0,003 r | α | 0,01380 ± 0,00004 | ENSDF |
| β- _ | 0,98620 ± 0,00004 | |||
228 89 Dz |
6,15 ± 0,02 godz | β- _ | 1.0 | ENSDF |
227 90 tys |
18,718 ± 0,005 d | α | 1.0 | BIPM-5 |
228 90 tys |
698,60 ± 0,23 d | α | 1.0 | BIPM-5 |
229 90 tys |
( 7,34 ± 0,16 ) x 10 3 y | α | 1.0 | ENSDF |
230 90 tys |
( 7,538 ± 0,030 ) x 10 4 y | α | 1.0 | ENSDF |
| SF | ≤ 4 x 10-13 | |||
231 90 tys |
25,52 ± 0,01 godz | β- _ | 1.0 | ENSDF |
| α | ~ 4 x 10-13 | |||
232 90 tys |
( 1,405 ± 0,006 ) x 10 10 r | α | 1.0 | ENSDF |
| SF | ( 1,1 ± 0,4 ) x 10-11 | |||
233 90 tys |
22,15 ± 0,15 m | β- _ | 1.0 | LNHB |
234 90 tys |
24,10 ± 0,03 d | β- _ | 1.0 | ENSDF |
231 91 Pa |
( 3,276 ± 0,011 ) x 10 4 y | α | 1.0 | ENSDF |
| SF | ≤ 3 x 10-12 | |||
232 91 Pa |
1,32 ± 0,02 d | WE | 0,00003 ± 0,00001 | ENSDF |
| β- _ | 0,99997 ± 0,00001 | |||
233 91 Pa |
26,98 ± 0,02 d | β- _ | 1.0 | LNHB |
234 91 Pa |
6,70 ± 0,05 godz | β- _ | 1.0 | ENSDF |
234m 91 Pa |
1,159 ± 0,016 m | TO | 0,0016 ± 0,0002 | MAEA-CRP-XG |
| β- _ | 0,9984 ± 0,0002 | |||
232 92 U |
68,9 ± 0,4 r | α | 1.0 | ENSDF |
| SF | ||||
233 92 U |
( 1,592 ± 0,002 ) x 10 5 r | α | 1.0 | ENSDF |
| SF | ||||
234 92 U |
( 2,455 ± 0,006 ) x 10 5 y | α | 1.0 | LNHB |
| SF | ( 1,6 ± 0,2 ) x 10-11 | |||
235m 92 U |
26 ± 1 m | TO | 1.0 | ENSDF |
235 92 U |
( 7,038 ± 0,005 ) x 10 8 y | α | 1.0 | ENSDF |
| SF | ( 7 ± 2 ) x 10-11 | |||
236 92 U |
( 2,342 ± 0,004 ) x 10 7 y | α | 1.0 | ENSDF |
| SF | ( 9,4 ± 0,4 ) x 10-10 | |||
237 92 U |
6,749 ± 0,016 d | β- _ | 1.0 | LNHB |
238 92 U |
( 4,468 ± 0,005 ) x 10 9 y | α | 1.0 | LNHB |
| SF | (5,45 ± 0,04) x 10-7 | |||
239 92 U |
23,45 ± 0,02 m | β- _ | 1.0 | ENSDF |
236 93 Np |
( 1,55 ± 0,08 ) x 10 5 r | α | 0,0016 ± 0,0006 | LNHB |
| β- _ | 0,120 ± 0,006 | |||
| WE | 0,878 ± 0,006 | |||
236m 93 Np |
22,5 ± 0,4 godz | β- _ | 0,47 ± 0,01 | LNHB |
| WE | 0,53 ± 0,01 | |||
237 93 Np |
( 2,144 ± 0,007 ) x 10 6 r | α | 1.0 | ENSDF |
| SF | ||||
238 93 Np |
2,117 ± 0,002 d | β- _ | 1.0 | ENSDF |
239 93 Np |
2,356 ± 0,003 d | β- _ | 1.0 | ENSDF |
236 94 pu |
2,858 ± 0,008 r | α | 1.0 | ENSDF |
| LNHB | Laboratoire National Henri Becquerel, zalecane dane, http://www.nucleide.org/DDEP_WG/DDEPdata.htm , 3 października 2006. |
| BIPM-5 | M.-M. Bé, V. Chisté, C. Dulieu, E. Browne, V. Chechev, N. Kuzmenko, R. Helmer, A. Nichols, E. Schönfeld, R. Dersch, Monografia BIPM-5, Tabela radionuklidów, tom. 2 – A = 151 do 242, 2004. |
| ENSDF | „Oceniony plik danych struktury jądrowej” . Narodowe Laboratorium Brookhaven . Źródło 15 listopada 2006 . |
| MAEA-CRP-XG | M.-M. Bé, VP Chechev, R. Dersch, OAM Helene, RG Helmer, M. Herman, S. Hlavác, A. Marcinkowski, GL Molnár, AL Nichols, E. Schönfeld, VR Vanin, MJ Woods, IAEA CRP „Update of X Ray and Gamma Decay Data Standards for Detector Calibration and Other Applications”, Informacje naukowe i techniczne IAEA raport STI/PUB/1287, maj 2007, Międzynarodowa Agencja Energii Atomowej, Wiedeń, Austria, ISBN 92-0-113606-4 . |
Zobacz też
Notatki
Bibliografia
- Golub, AM (1971). Общая и неорганическая химия (Chemia ogólna i nieorganiczna) . Tom. 2.
- Greenwood, Norman N .; Earnshaw, Alan (1997). Chemia pierwiastków (wyd. 2). Butterwortha-Heinemanna . ISBN 978-0-08-037941-8 .
- Miasojedow, B. (1972). Chemia analityczna pierwiastków transplutonowych . Moskwa: Nauka. ISBN 978-0-470-62715-0 .
Linki zewnętrzne
- Lawrence Berkeley Obraz laboratoryjny historycznego układu okresowego pierwiastków autorstwa Seaborga przedstawiający po raz pierwszy serie aktynowców
- Lawrence Livermore National Laboratory, Odkrywanie tajemnic aktynowców
- Los Alamos National Laboratory, kwartalnik badań aktynowców
![{\displaystyle {\ce {{^{238}_{92}U}+{}_{0}^{1}n->{}_{92}^{239}U->[\beta ^{-}][23.5\ {\ce {min}}]{}_{93}^{239}Np->[\beta ^{-}][2.3\ {\ce {days}}]{}_{94}^{239}Pu}}\left({\ce {->[\alpha ][2.4\cdot 10^{4}\ {\ce {years}}]}}\right){\ce {^{235}_{92}U}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7a95dee843f1cf5e9156013e8ca01c30870d896)




![{\displaystyle {\begin{array}{l}{}\\{\ce {2AmF3{}+3Ba->[{\ce {1150-1350^{\circ }C}}]3BaF2{}+2Am}}\\{\ce {PuF4{}+2Ba->[{\ce {1200^{\circ }C}}]2BaF2{}+Pu}}\\{\ce {UF4{}+2Mg->[{\ce {>500^{\circ }C}}]U{}+2MgF2}}\\{}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/057c8209f7427fca3331e574fa79f36c0e2a81db)










![{\displaystyle {\ce {Th{}+O2->[{\ce {1000^{\circ }C}}]\overbrace {ThO2} ^{Thorium~dioxide}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13e4a27b9ed3d03fc5420ed4a04020bf77562406)


