Sześcienny system kryształów

W krystalografii sześcienny (lub izometryczny ) układ kryształów to układ kryształów , w którym komórka elementarna ma kształt sześcianu . Jest to jeden z najczęstszych i najprostszych kształtów występujących w kryształach i minerałach .
Istnieją trzy główne odmiany tych kryształów:
- Pierwotny sześcienny (w skrócie cP i alternatywnie nazywany prostym sześciennym )
- Sześcienny skoncentrowany na ciele (w skrócie cI lub bcc )
- Sześcienny centrowany na twarzy (w skrócie cF lub fcc )
Uwaga: termin fcc jest często używany jako synonim sześciennej struktury zamkniętej lub ccp występującej w metalach. Jednak fcc oznacza sześcienną siatkę Bravais skoncentrowaną na twarzy, która niekoniecznie jest gęsto upakowana, gdy motyw jest ustawiony na punktach sieci. Np. kraty diamentu i blendy cynku są fcc , ale nie są ściśle upakowane. Każdy jest podzielony na inne warianty wymienione poniżej. Chociaż komórki elementarne w tych kryształach są konwencjonalnie uważane za sześciany, prymitywne komórki elementarne często nimi nie są.
kraty Bravais
Trzy sieci Bravais w sześciennym układzie kryształów to:
| krata Bravais |
Prymitywny sześcienny |
Sześcienny wyśrodkowany na ciele |
Sześcienny wyśrodkowany na twarzy |
|---|---|---|---|
| Symbol Pearsona | cP | cI | cF |
| Komórka elementarna |

|

|

|
Prymitywna sieć sześcienna (cP) składa się z jednego punktu sieci na każdym rogu sześcianu; oznacza to, że każda prosta sześcienna komórka elementarna ma w sumie jeden punkt sieci. Każdy atom w punkcie sieci jest następnie równo dzielony między osiem sąsiednich kostek, a zatem komórka elementarna zawiera w sumie jeden atom ( 1 / 8 × 8).
Sieć sześcienna skoncentrowana na ciele (cI) ma jeden punkt sieci w środku komórki elementarnej oprócz ośmiu punktów narożnych. Ma łącznie dwa punkty siatki na komórkę elementarną ( 1 / 8 × 8 + 1).
Sieć sześcienna skoncentrowana na twarzy (cF) ma punkty sieciowe na ścianach sześcianu, z których każdy daje dokładnie połowę wkładu, oprócz narożnych punktów sieci, co daje łącznie 4 punkty sieci na komórkę elementarną ( 1 / 8 × 8 z rogów plus 1 ⁄ 2 × 6 z twarzy).
Sieć sześcienna skoncentrowana na twarzy jest blisko spokrewniona z systemem heksagonalnego ścisłego upakowania (hcp), w którym dwa systemy różnią się jedynie względnymi położeniami ich warstw heksagonalnych. Płaszczyzna [111] sieci sześciennej centrowanej na twarz jest siatką heksagonalną.
Próba stworzenia sześciennej sieci centrowanej na podstawie (tj. umieszczenie dodatkowego punktu sieci w środku każdej poziomej ściany) skutkuje prostą tetragonalną siatką Bravais .
Liczba koordynacyjna (CN) to liczba najbliższych sąsiadów centralnego atomu w strukturze. Każda kula w sieci cP ma liczbę koordynacyjną 6, w sieci cI 8, aw sieci cF 12.
Atomowy współczynnik upakowania (APF) to ułamek objętości zajmowany przez atomy. Sieć cP ma APF około 0,524, sieć cI ma APF około 0,680, a sieć cF ma APF około 0,740.
Klasy kryształów
Nazwy klas izometrycznych systemów kryształów , grupy punktowe (w notacji Schönfliesa , notacji Hermanna – Mauguina , orbifold i notacji Coxetera ), typ, przykłady, międzynarodowe tabele numerów grup przestrzennych krystalografii i grupy przestrzenne wymieniono w poniższej tabeli. Istnieje łącznie 36 sześciennych grup przestrzennych.
| NIE. | Grupa punktowa | Typ | Przykład | Grupy kosmiczne | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa | Schön. | Międzynarodowy | Kula. | Sternik. | Prymitywny | Wyśrodkowany na twarz | Skoncentrowany na ciele | |||
| 195–197 | tetartoidalny | T | 23 | 332 | [3,3] + | enancjomorficzny | Ullmannit , Chloran sodu | P23 | F23 | I23 |
| 198–199 | P2 1 3 | I2 1 3 | ||||||||
| 200–204 | Diploidalny | T godz |
2/m 3 (m 3 ) |
3*2 | [3 + ,4] | centrosymetryczny | Piryt | Pm 3 , Pn 3 | Fm 3 , Fd 3 | ja 3 |
| 205–206 | Pa 3 | Ia 3 | ||||||||
| 207–211 | żyroskopowy | O | 432 | 432 | [3,4] + | enancjomorficzny | Petzyt | P432 , P4 2 32 | F432, F4 1 32 | I432 |
| 212–214 | P4 3 32, P4 1 32 | I4 1 32 | ||||||||
| 215–217 | Sześciościenny | T d | 4 3m | *332 | [3,3] | Sfaleryt | P 4 3m | F4 3m _ | ja 4 3m | |
| 218–220 | P 4 3n | F 4 3c | ja 4 3d | |||||||
| 221–230 | sześciokątny | O godz |
4/m 3 2/m (m 3 m) |
*432 | [3,4] | centrosymetryczny | Galena , Halit | Pm 3 m, Pn 3 n, Pm 3 n , Pn 3 m | Fm 3 m , Fm 3 c, Fd 3 m, Fd 3 c | Im 3 m, Ia 3 d |
Inne terminy określające heksoktaedryczność to: klasa normalna, holoedryczna , ditesseralna klasa centralna, typ galeny .
Struktury jednoelementowe
Z reguły, ponieważ atomy w ciele stałym przyciągają się nawzajem, częściej występują bardziej ciasno upakowane układy atomów. (Jednak zdarzają się luźno upakowane układy, na przykład jeśli hybrydyzacja orbitalna wymaga pewnych kątów wiązań ). W związku z tym prymitywna sześcienna struktura, ze szczególnie niskim współczynnikiem upakowania atomów, jest z natury rzadka, ale występuje w polonie . Bcc i fcc , z ich wyższymi gęstościami, są dość powszechne w przyrodzie. Przykłady bcc obejmują żelazo , chrom , wolfram i niob . Przykłady fcc obejmują aluminium , miedź , złoto i srebro .
Inną ważną sześcienną strukturą krystaliczną jest sześcienna struktura diamentu, która może występować w węglu , krzemie , germanie i cynie . W przeciwieństwie do fcc i bcc ta struktura nie jest kratą, ponieważ zawiera wiele atomów w swojej pierwotnej komórce . Inne sześcienne struktury elementarne obejmują strukturę A15 występującą w wolframie oraz niezwykle skomplikowaną strukturę manganu .
Struktury wieloelementowe
Związki składające się z więcej niż jednego pierwiastka (np. związki binarne ) często mają struktury krystaliczne oparte na sześciennym układzie kryształów. Niektóre z bardziej powszechnych są wymienione tutaj. Struktury te można postrzegać jako dwie lub więcej przenikających się podsieci, w których każda podsieć zajmuje miejsca śródmiąższowe pozostałych.
Struktura chlorku cezu

Jedną strukturą jest „przenikająca się prymitywna sześcienna” struktura, zwana także strukturą „chlorku cezu”. Ta struktura jest często mylona z sześcienną strukturą skoncentrowaną na ciele, ponieważ układ atomów jest taki sam. Prawdziwa struktura jest pokazana na grafice przedstawiającej dwie pojedyncze prymitywne struktury sześcienne, które są nałożone na siebie z rogiem jednej struktury pośrodku sześcianu drugiej struktury. Pomaga przekonać się, że nie jest sześcienny skoncentrowany na ciele, ponieważ nie ma symetrii translacyjnej wzdłuż płaszczyzny ½, ½, ½, chlorek zostałby przekształcony w cez, a nie inny chlorek.
Działa to w ten sam sposób dla struktury NaCl opisanej w następnej sekcji. Jeśli usuniesz atomy Cl, pozostałe atomy Na nadal tworzą strukturę FCC, a nie prostą strukturę sześcienną.
W komórce elementarnej CsCl każdy jon znajduje się w środku sześcianu jonów przeciwnego rodzaju, więc liczba koordynacyjna wynosi osiem. Centralny kation jest skoordynowany z 8 anionami w rogach sześcianu, jak pokazano, i podobnie centralny anion jest skoordynowany z 8 kationami w rogach sześcianu. Alternatywnie, można by postrzegać tę sieć jako prostą sześcienną strukturę z drugorzędnym atomem w jej sześciennej pustce .
Oprócz samego chlorku cezu, struktura pojawia się również w niektórych innych halogenkach metali alkalicznych , gdy są wytwarzane w niskich temperaturach lub pod wysokim ciśnieniem. Ogólnie rzecz biorąc, jest bardziej prawdopodobne, że ta struktura zostanie utworzona z dwóch pierwiastków, których jony są mniej więcej tej samej wielkości (na przykład promień jonowy Cs + = 167 pm i Cl - = 181 pm).
Grupa przestrzenna struktury chlorku cezu (CsCl) nosi nazwę Pm 3 m (w notacji Hermanna – Mauguina ) lub „221” (w Międzynarodowych Tablicach Krystalograficznych). Oznaczenie Strukturbericht to „B2”.
Istnieje prawie sto związków międzymetalicznych ziem rzadkich , które krystalizują w strukturze CsCl, w tym wiele związków binarnych pierwiastków ziem rzadkich z magnezem i pierwiastkami z grup 11 , 12 i 13 . Inne związki o strukturze podobnej do chlorku cezu to CsBr , CsI , wysokotemperaturowy RbCl , AlCo, AgZn, BeCu, MgCe, RuAl i SrTl. [ potrzebne źródło ]
Struktura soli kamiennej
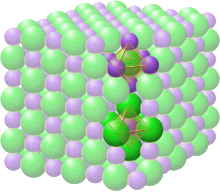
Grupa przestrzenna struktury soli kamiennej lub halitu (chlorku sodu) jest oznaczona jako Fm 3 m (w notacji Hermanna-Mauguina ) lub „225” (w Międzynarodowych Tablicach Krystalograficznych). Oznaczenie Strukturbericht to „B1”.
W strukturze soli kamiennej każdy z dwóch typów atomów tworzy oddzielną sześcienną siatkę skupioną na twarzy, przy czym te dwie sieci przenikają się, tworząc trójwymiarowy wzór szachownicy. Struktura soli kamiennej ma koordynację oktaedryczną : najbliżsi sąsiedzi każdego atomu składają się z sześciu atomów przeciwnego typu, rozmieszczonych jak sześć wierzchołków ośmiościanu foremnego . W chlorku sodu stosunek atomów sodu do chloru wynosi 1:1. Strukturę można również opisać jako sieć FCC z sodu z chlorem zajmującym każdą oktaedryczną pustkę lub odwrotnie.
Przykłady związków o tej strukturze obejmują sam chlorek sodu, wraz z prawie wszystkimi innymi halogenkami metali alkalicznych oraz „wiele tlenków metali dwuwartościowych, siarczków, selenków i tellurków”. Zgodnie z regułą stosunku promienia , prawdopodobieństwo powstania tej struktury jest większe, jeśli kation jest nieco mniejszy niż anion (stosunek promienia kationu do anionu wynosi od 0,414 do 0,732).
Odległość międzyatomowa (odległość między kationem a anionem lub połowa długości komórki elementarnej a ) w niektórych kryształach o strukturze soli kamiennej wynosi: 2,3 Å (2,3 × 10-10 m ) dla NaF, 2,8 Å dla NaCl i 3,2 Å dla SnTe. Większość wodorków i halogenków metali alkalicznych ma strukturę soli kamiennej, chociaż kilka ma zamiast tego strukturę chlorku cezu .
| wodorki | fluorki | chlorki | Bromki | jodki | |
|---|---|---|---|---|---|
| Lit | wodorek litu | Fluorek litu | Chlorek litu | bromek litu | Jodek litu |
| Sód | wodorek sodu | Fluorek sodu | Chlorek sodu | Bromek sodu | Jodek sodu |
| Potas | Wodorek potasu | Fluorek potasu | Chlorek potasu | Bromek potasu | Jodek potasu |
| Rubid | Wodorek rubidu | Fluorek rubidu | Chlorek rubidu | bromek rubidu | jodek rubidu |
| Cez | wodorek cezu | Fluorek cezu | (struktura CsCl) | ||
| tlenki | siarczki | selenki | Tellurydy | polonidy | |
|---|---|---|---|---|---|
| Magnez | Tlenek magnezu | Siarczek magnezu | Selenek magnezu | Tellurek magnezu | (struktura NiAs) |
| Wapń | Tlenek wapnia | Siarczek wapnia | Selenek wapnia | Tellurek wapnia | Polonid wapnia |
| Stront | Tlenek strontu | Siarczek strontu | selenek strontu | Tellurek strontu | polonid strontu |
| Bar | Tlenek baru | siarczek baru | Selenek baru | Tellurek baru | Polonek baru |
| Azotki | fosforki | arsenki | antymonidy | Bizmutydy | |
|---|---|---|---|---|---|
| Skand | Azotek skandu | Fosforek skandu | Arsenek skandu | Antymonek skandu | Bizmutyd skandu |
| Itr | Azotek itru | Fosforek itru | Arsenek itru | Antymonek itru | Bizmutydek itru |
| Lantan | Azotek lantanu | Fosforek lantanu | Arsenek lantanu | Antymonek lantanu | Bizmutyd lantanu |
| Cer | azotek ceru | fosforek ceru | Arsenek ceru | Antymonek ceru | Bizmutydek ceru |
| prazeodym | azotek prazeodymu | Fosforek prazeodymu | Arsenek prazeodymu | Antymonek prazeodymu | Bizmutyd prazeodymu |
| neodym | Azotek neodymu | Fosforek neodymu | Arsenek neodymu | Antymonek neodymu | Bizmutyd neodymu |
| Promet | ? | ? | ? | ? | ? |
| Samar | azotek samaru | Fosforek samaru | Arsenek samaru | Antymonek samaru | Bizmutyd samaru |
| Europ | azotek europu | fosforek europu | ( struktura Na2O2 ) _ | (nietrwały) | |
| Gadolin | Azotek gadolinu | Fosforek gadolinu | Arsenek gadolinu | Antymonek gadolinu | Bizmutyd gadolinu |
| Terb | Azotek terbu | Fosforek terbu | Arsenek terbu | Antymonek terbu | Bizmutyd terbu |
| Dysproz | Azotek dysprozu | Fosforek dysprozu | Arsenek dysprozu | Antymonek dysprozu | bizmutyd dysprozu |
| Holmium | azotek holmu | Fosforek holmu | Arsenek holmu | Antymonek holmu | Bizmutyd holmu |
| Erb | azotek erbu | Fosforek erbu | Arsenek erbu | Antymonek erbu | Bizmutyd erbu |
| Tul | azotek tulu | fosforek tulu | Arsenek tulu | Antymonek tulu | bizmutyd tulu |
| Iterb | Azotek iterbu | fosforek iterbu | Arsenek iterbu | Antymonek iterbu | (nietrwały) |
| lutet | Azotek lutetu | Fosforek lutetu | Arsenek lutetu | Antymonek lutetu | Bizmutyd lutetu |
| Aktyn | ? | ? | ? | ? | ? |
| Tor | Azotek toru | fosforek toru | Arsenek toru | Antymonek toru | (struktura CsCl) |
| Protaktyn | ? | ? | ? | ? | ? |
| Uran | Azotek uranu | Monofosforek uranu | Arsenek uranu | Antymonek uranu | bizmutydek uranu |
| Neptun | azotek neptunu | fosforek neptunu | Arsenek neptunu | Antymonek neptunu | Bizmutyd neptunu |
| Pluton | Azotek plutonu | fosforek plutonu | Arsenek plutonu | Antymonek plutonu | bizmutydek plutonu |
| ameryk | Azotek ameryku | Fosforek ameryku | Arsenek ameryku | Antymonek ameryku | Bizmutyd ameryku |
| Kiur | Azotek kuru | fosforek kuru | Arsenek kuru | Kurium antymonek | Bizmutyd kurium |
| Berkelium | azotek berkelu | fosforek berkelu | Arsenek Berkelium | ? | Bizmutyd Berkelium |
| Kaliforn | ? | ? | Arsenek kalifornu | ? | Bizmutyd kalifornu |
| tlenki | siarczki | selenki | Tellurydy | polonidy | |
|---|---|---|---|---|---|
| Skand | (nietrwały) | Monosiarczek skandu | |||
| Itr | Monosiarczek itru | ||||
| Lantan | Monosiarczek lantanu | ||||
| Cer | Monosiarczek ceru | Monoselenek ceru | Monotellurek ceru | ||
| prazeodym | Monosiarczek prazeodymu | Monoselenek prazeodymu | Monotelluryd prazeodymu | ||
| neodym | Monosiarczek neodymu | Monoselenek neodymu | Monotellurek neodymu | ||
| Promet | ? | ? | ? | ? | |
| Samar | Monosiarczek samaru | Monoselenek samaru | Monotelluryd samaru | Monoponid samaru | |
| Europ | Tlenek europu | Monosiarczek europu | Monoselenek europu | Monotelluryd europu | Monoponid europu |
| Gadolin | (nietrwały) | Monosiarczek gadolinu | |||
| Terb | Monosiarczek terbu | Monoponid terbu | |||
| Dysproz | Monosiarczek dysprozu | Monoponid dysprozu | |||
| Holmium | Monosiarczek holmu | Monoponid holmu | |||
| Erb | Monosiarczek erbu | ||||
| Tul | Monosiarczek tulu | Monolonek tulu | |||
| Iterb | Tlenek iterbu | Monosiarczek iterbu | Monoponid iterbu | ||
| lutet | (nietrwały) | Monosiarczek lutetu | Monoponid lutetu | ||
| Aktyn | ? | ? | ? | ? | |
| Tor | Monosiarczek toru | Monoselenek toru | (struktura CsCl) | ||
| Protaktyn | ? | ? | ? | ? | |
| Uran | Monosiarczek uranu | Monoselenek uranu | Monotellurek uranu | ||
| Neptun | Monosiarczek neptunu | Monoselenek neptunu | Monotellurek neptunu | ||
| Pluton | Monosiarczek plutonu | Monoselenek plutonu | Monotellurek plutonu | ||
| ameryk | Monosiarczek ameryku | Monoselenek ameryku | Monotelluryd ameryku | ||
| Kiur | Monosiarczek kuru | Monoselenek kuru | Monotelluryd kuru |
| Węgliki | Azotki | |
|---|---|---|
| Tytan | Węglik tytanu | Azotek tytanu |
| Cyrkon | Węglik cyrkonu | Azotek cyrkonu |
| Hafn | Węglik hafnu | azotek hafnu |
| Wanad | Węglik wanadu | Azotek wanadu |
| Niob | Węglik niobu | Azotek niobu |
| Tantal | Węglik tantalu | (struktura CoSn) |
| Chrom | (nietrwały) | Azotek chromu |
Wiele tlenków metali przejściowych ma również strukturę soli kamiennej ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). Taką strukturę mają również wczesne monowęgliki aktynoidalne ( ThC , PaC, UC , NpC, PuC ). Inne związki wykazujące strukturę podobną do soli kamiennej to TiB, ZrB, PbS , PbSe , PbTe , SnTe , AgF , AgCl i AgBr .
Struktura fluorytu
Podobnie jak struktura soli kamiennej, struktura fluorytu (AB2 ) jest również strukturą Fm3m , ale ma stosunek jonów 1:2. Struktura antyfluorytu jest prawie identyczna, z wyjątkiem pozycji anionów i kationów w strukturze. Są one oznaczone pozycjami Wyckoffa 4a i 8c, podczas gdy pozycje struktury soli kamiennej to 4a i 4b.
Struktura blendy cynkowej
Grupa przestrzenna struktury Zincblende nosi nazwę F 4 3m (w notacji Hermanna – Mauguina ) lub 216. Oznaczenie Strukturbericht to „B3”.
Struktura cynku (nazywana również „blendą cynku”) pochodzi od mineralnej blendy cynku ( sfalerytu ), jednej z form siarczku cynku (β-ZnS). Podobnie jak w przypadku struktury soli kamiennej, dwa typy atomów tworzą dwie przenikające się sześcienne sieci centrowane na ścianach. Jednak różni się od struktury soli kamiennej tym, jak dwie sieci są ustawione względem siebie. Struktura blendy cynkowej ma czworościenną koordynację : najbliżsi sąsiedzi każdego atomu składają się z czterech atomów przeciwnego typu, rozmieszczonych jak cztery wierzchołki czworościanu foremnego . W siarczku cynku stosunek cynku do siarki wynosi 1:1. W sumie układ atomów w strukturze blendy cynkowej jest taki sam jak w sześciennej diamentu , ale z naprzemiennymi typami atomów w różnych miejscach sieci. Strukturę można również opisać jako sieć cynku FCC z atomami siarki zajmującymi połowę czworościennych pustek lub odwrotnie.
Przykłady związków o tej strukturze obejmują samą blendę cynku, azotan ołowiu (II) , wiele złożonych półprzewodników (takich jak arsenek galu i tellurek kadmu ) oraz szeroką gamę innych związków dwuskładnikowych. [ Potrzebne źródło ] Pnictogenidy z grupy boru mają zwykle strukturę blendy cynku, chociaż azotki są bardziej powszechne w strukturze wurcytu , a ich formy blendy cynku są mniej znanymi odmianami polimorficznymi .
| fluorki | chlorki | Bromki | jodki | |
|---|---|---|---|---|
| Miedź | Fluorek miedzi(I). | Chlorek miedzi(I). | Bromek miedzi(I). | Jodek miedzi(I). |
| siarczki | selenki | Tellurydy | polonidy | |
|---|---|---|---|---|
| Beryl | Siarczek berylu | Selenek berylu | Tellurek berylu | polonek berylu |
| Cynk | Siarczek cynku | Selenek cynku | Tellurek cynku | Polonid cynku |
| Kadm | Siarczek kadmu | selenek kadmu | Tellurek kadmu | Polonek kadmu |
| Rtęć | Siarczek rtęci | Selenek rtęci | Tellurek rtęci | - |
Ta grupa jest również znana jako rodzina związków II-VI , z których większość można wytworzyć zarówno w postaci blendy cynkowej (sześciennej), jak i wurcytu (sześciokątnej).
| Azotki | fosforki | arsenki | antymonidy | |
|---|---|---|---|---|
| Bor | azotek boru * | fosforek boru | Arsenek boru | Antymonek boru |
| Aluminium | Azotek glinu * | Fosforek glinu | Arsenek glinu | Antymonek glinu |
| Gal | azotek galu * | Fosforek galu | Arsenku galu | Antymonek galu |
| Ind | azotek indu * | fosforek indu | Arsenek indu | Antymonek indu |
Ta grupa jest również znana jako rodzina związków III-V .

Struktura Heuslera
Struktura Heuslera, oparta na strukturze Cu 2 MnAl, jest powszechną strukturą dla związków trójskładnikowych zawierających metale przejściowe . Ma grupę przestrzenną Fm 3 m (nr 225), a oznaczenie Strukturbericht to L2 1 . Wraz z blisko spokrewnionymi związkami pół-Heuslera i odwrotnymi związkami Hueslera istnieją setki przykładów.
Struktura monokrzemku żelaza

Grupa przestrzenna struktury monokrzemku żelaza to P2 1 3 (nr 198), a oznaczenie Strukturbericht to B20. Jest to chiralna i czasami jest związana z właściwościami helimagnetycznymi . Istnieją cztery atomy każdego pierwiastka, co daje w sumie osiem atomów w komórce elementarnej.
Przykłady występują wśród krzemków i germanków metali przejściowych, a także kilku innych związków, takich jak palladek galu .
| krzemki | Germanidy | |
|---|---|---|
| Mangan | Monokrzemek manganu | Germanek manganu |
| Żelazo | Monokrzemek żelaza | Żelazo germanek |
| Kobalt | Monokrzemek kobaltu | Germanek kobaltu |
| Chrom | Krzemek chromu(IV). | Germanek chromu(IV). |
Struktura Weaire'a-Phelana
Weaire'a -Phelana ma symetrię Pm 3 n (223).
Ma trzy orientacje ułożonych w stos tetradekahedrów z komórkami pirytoedrycznymi w szczelinach. Występuje jako struktura krystaliczna w chemii , gdzie jest zwykle znana jako „ struktura klatratu typu I ”. Hydraty gazów utworzone przez metan, propan i dwutlenek węgla w niskich temperaturach mają strukturę, w której cząsteczki wody leżą w węzłach struktury Weaire-Phelana i są ze sobą połączone wiązaniami wodorowymi , a większe cząsteczki gazu są uwięzione w wielościennych klatkach.
Zobacz też
- Atomium : budynek będący modelem komórki elementarnej bcc o pionowej przekątnej ciała.
- Zamknięte opakowanie
- Dyslokacje
- Wzajemna krata
Dalsza lektura
- Hurlbut, Cornelius S.; Klein, Cornelis, 1985, Podręcznik mineralogii , wyd. 20, Wiley, ISBN 0-471-80580-7
Linki zewnętrzne
- Tworzenie struktury krystalicznej za pomocą Molview





