Pikrotoksyna
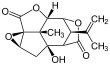
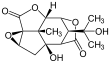
Pikrotoksyna (po lewej) i pikrotyna (po prawej)
| |||
| Dane kliniczne | |||
|---|---|---|---|
| Kod ATC |
|
||
| Identyfikatory | |||
| Numer CAS | |||
| Identyfikator klienta PubChem | |||
| IUPHAR/BPS | |||
| Bank Leków | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| CHEBI | |||
| CHEMBL | |||
| Pulpit nawigacyjny CompTox ( EPA ) | |||
| Karta informacyjna ECHA | 100.004.288 | ||
| Dane chemiczne i fizyczne | |||
| Model 3D ( JSmol ) | |||
| |||
| |||
|
| |||
Pikrotoksyna , znana również jako kokulina , jest trującym krystalicznym związkiem roślinnym. Po raz pierwszy został wyizolowany przez francuskiego farmaceutę i chemika Pierre'a François Guillaume Boullay (1777–1869) w 1812 r. Nazwa „pikrotoksyna” jest połączeniem greckich słów „picros” (gorzki) i „toxicon” (trucizna). Mieszanka dwóch różnych związków, pikrotoksyna występuje naturalnie w owocach rośliny Anamirta cocculus , chociaż może być również syntetyzowana chemicznie.
Ze względu na interakcje z neuroprzekaźnikiem hamującym GABA, pikrotoksyna działa pobudzająco i konwulsyjnie. Wpływa głównie na ośrodkowy układ nerwowy, powodując drgawki i porażenie oddechowe w odpowiednio wysokich dawkach.
Budowa chemiczna i synteza
Pikrotoksyna jest równomolową mieszaniną dwóch związków, pikrotoksyny (C 15 H 16 O 6 ; nr CAS 17617-45-7) i pikrotyny (C 15 H 18 O 7 ; nr CAS 21416-53-5). Z tych dwóch związków pikrotyna jest mniej aktywna.
Pikrotoksyna występuje naturalnie w owocach Anamirta cocculus , rośliny pnącej z Indii i innych części Azji Południowo-Wschodniej. Roślina znana jest z dużych łodyg z białego drewna i słodko pachnących kwiatów. Produkuje małe owoce pestkowe, Cocculus indicus , które są zwykle suszone. [ potrzebne źródło ]
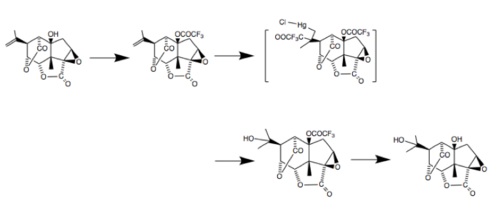
Obecnie istnieje aż pięć całkowitych syntez pikrotoksyniny – z których jedna została opublikowana dopiero w czerwcu 2020 r. przez laboratorium Shenvi w Scripps. Ta synteza, podobnie jak większość w przypadku tej cząsteczki, obejmowała użycie karwonu jako matrycy stereochemicznej. Strategia polegała na szybkim utworzeniu policyklicznego rdzenia, a następnie manipulowaniu stopniami utlenienia kluczowych atomów węgla w celu wytworzenia cząsteczki docelowej. Niektóre badania sugerują, że można to zrobić przez cyklofunkcjonalizację układów cykloalkenylowych. W warunkach kontrolowanych kinetycznie proces ten generalnie skutkuje egzo cyklizację i tworzy zmostkowane układy pierścieniowe, takie jak te występujące w pikrotoksynie. Ponadto zaproponowano kilka syntez pikrotoksyny i pikrotyny, dwóch cząsteczek tworzących pikrotoksynę. W 1980 roku odkryto proces przekształcania pikrotoksyny w pikrotynę. Ta synteza rozpoczyna się od traktowania pikrotoksyny bezwodnikiem trifluorooctowym w pirydynie w celu rozdzielenia składników.
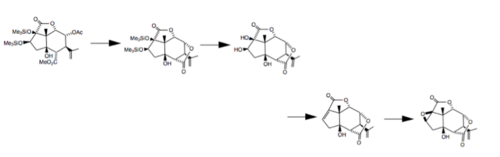
W 1988 roku naukowcy z Uniwersytetu Tohoku w Japonii ukończyli całkowitą stereoselektywną syntezę zarówno (-)-pikrotoksyniny, jak i (-)-pikrotyny, rozpoczynając od (+)-5β- hydroksykarwonu . W tej syntezie osiem centrów asymetrycznych przygotowano stereoselektywnie na skondensowanym cis układzie pierścieni hydrindanowych przy użyciu kilku różnych reakcji: przegrupowanie Claisena w celu wprowadzenia czwartorzędowego centrum, redukcja ketonu epoksydowego za pośrednictwem selenu organicznego i stereospecyficzna konstrukcja estru glicydowego . Ostatnie kroki tego procesu przedstawiono poniżej.
Pikrotoksyna była również stosowana jako materiał wyjściowy w kilku procesach syntezy, w tym do tworzenia dl -pikrotoksyny, która zachowuje pewne cechy szkieletu pikrotoksyny.
Mechanizm akcji
Niektóre włókna mięśniowe skorupiaków mają unerwienie pobudzające i hamujące. Pikrotoksyna blokuje hamowanie. Zaproponowano dwie różne, ale powiązane teorie dotyczące mechanizmu działania pikrotoksyny na synapsy . Jedna z teorii głosi, że działa jako niekonkurencyjny bloker kanałów dla kanałów chlorkowych receptora GABA A , w szczególności jonoforu chlorkowego aktywowanego kwasem gamma-aminomasłowym. Badanie z 2006 roku wykazało, że chociaż nie jest strukturalnie podobne do GABA, pikrotoksyna zapobiega przepływowi jonów przez kanały chlorkowe aktywowane przez GABA. Prawdopodobnie działa w obrębie samych kanałów jonowych, a nie w miejscach rozpoznawania GABA. Ponieważ hamuje kanały aktywowane przez GABA, leki wzmacniające GABA, takie jak barbiturany i benzodiazepiny, mogą być stosowane jako antidotum.
Inne badania sugerują, że toksyna działa zamiast tego jako niekonkurencyjny antagonista lub inhibitor receptorów GABA. Badanie przeprowadzone przez Newlanda i Cull-Candy wykazało, że pikrotoksyna w wystarczająco wysokich stężeniach zmniejszała amplitudę prądów GABA. Ich dane wskazywały, że jest mało prawdopodobne, aby pikrotoksyna działała po prostu jako bloker kanałów bramkowanych napięciem, chociaż zmniejszała częstotliwość otwierania kanałów. Odkryli raczej, że pikrotoksyna „wiąże się preferencyjnie z agonistą związanym z formą receptora”. Oznacza to, że nawet w obecności niskich stężeń pikrotoksyny odpowiedź neuronów na GABA jest zmniejszona.
Toksyczność
Pikrotoksyna działa stymulująco na ośrodkowy układ nerwowy i układ oddechowy. Jest wyjątkowo toksyczny dla ryb i ludzi, a także gryzoni i innych ssaków. Według Rejestru toksycznych skutków substancji chemicznych LDLo, czyli najniższa odnotowana dawka śmiertelna, wynosi 0,357 mg/kg. Objawy zatrucia pikrotoksyną obejmują kaszel, trudności w oddychaniu, ból głowy, zawroty głowy, splątanie, zaburzenia żołądkowo-jelitowe, nudności lub wymioty oraz zmiany częstości akcji serca i ciśnienia krwi. Chociaż jest to szczególnie niebezpieczne w przypadku połknięcia, skutki ogólnoustrojowe mogą również wynikać z wdychania lub wchłaniania do krwioobiegu przez zmiany skórne. Pikrotoksyna działa również konwulsyjnie. Stwierdzono, że w większych dawkach wywołuje drgawki kloniczne lub zaburzenia rytmu serca, przy czym szczególnie wysokie dawki ostatecznie okazują się śmiertelne, zwykle z powodu porażenia oddechowego.
Zastosowania kliniczne i inne zastosowania
Ze względu na swoją toksyczność pikrotoksyna jest obecnie najczęściej wykorzystywana jako narzędzie badawcze. Jednak ze względu na antagonistyczne działanie na receptory GABA był stosowany jako środek pobudzający ośrodkowy układ nerwowy. Wcześniej był również stosowany jako antidotum na zatrucia środkami działającymi depresyjnie na ośrodkowy układ nerwowy, zwłaszcza barbiturany .
Chociaż nie jest powszechnie stosowana, pikrotoksyna jest skuteczna zarówno jako pestycyd, jak i pedikulicyd . W XIX wieku używano go do przygotowania twardego multum, które dodawano do piwa, aby było bardziej odurzające. Od tego czasu przygotowanie to zostało zakazane.
Pomimo swojej potencjalnej toksyczności dla ssaków w wystarczająco dużych dawkach, pikrotoksyna jest czasami stosowana jako środek wzmacniający wydajność u koni. Jest klasyfikowany jako nielegalna „substancja klasy I” przez American Quarter Horse Association . Substancje sklasyfikowane jako „Klasa I” prawdopodobnie wpływają na wydajność i nie mają zastosowania terapeutycznego w medycynie koni. W 2010 roku trener koni Robert Dimitt został zawieszony po tym, jak jego koń, Stoli Signature, uzyskał pozytywny wynik testu na obecność tej substancji. Podobnie jak u ludzi, jest stosowany w celu przeciwdziałania zatruciom barbituranami.
Zobacz też
Dalsza lektura
- Ehrenberger K, Benkoe E, Felix D (1982). „Tłumiące działanie pikrotoksyny, antagonisty GABA, na spontaniczny oczopląs błędnika i zawroty głowy u człowieka”. Acta Oto-Laryngologica . 93 (1–6): 269–73. doi : 10.3109/00016488209130882 . PMID 7064710 .
- Dupont L, Dideberg O, Lamotte-Brasseur J, Angenot L (1976). „Structure cristalline et moléculaire de la picrotoxine, C 15 H 16 O 6 · C 15 H 18 O 7 ” . Acta Crystallographica B (w języku francuskim). 32 (11): 2987–2993. doi : 10.1107/S0567740876009424 .
- Olsen RW, DeLoreyTM (1999). „Fizjologia i farmakologia receptora GABA” . W Siegel GJ, Agranoff BW, Albers RW i in. (red.). Podstawowa neurochemia: aspekty molekularne, komórkowe i medyczne (wyd. 6). Filadelfia, PA, USA: Lippincott-Raven.