tetanospasmina
| Identyfikatory | |||||||
|---|---|---|---|---|---|---|---|
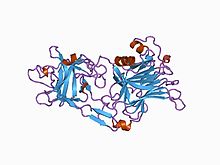 fragmentu C łańcucha ciężkiego toksyny tężcowej
| |||||||
| tetanospasminy (). | |||||||
| Organizm | |||||||
| Symbol | Namiot | ||||||
| UniProt | P04958 | ||||||
| |||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| tentoksylizyny | |||||||||
| nr WE | 3.4.24.68 | ||||||||
| nr CAS | 107231-12-9 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| |||||||||
Toksyna tężcowa ( TeNT ) jest niezwykle silną neurotoksyną wytwarzaną przez komórki wegetatywne Clostridium tetani w warunkach beztlenowych , wywołując tężec . Nie ma żadnej znanej funkcji dla Clostridia w środowisku glebowym, w którym są one normalnie spotykane. Jest również nazywany toksyną spazmogenną , tentoksylizyną , tetanospasminą lub neurotoksyną tężcową . LD50 _ zmierzono, że ta toksyna wynosi około 2,5–3 ng/kg, co daje jej drugie miejsce po powiązanej toksynie botulinowej (LD 50 2 ng/kg) jako najbardziej śmiercionośna toksyna na świecie. Jednak testy te są przeprowadzane wyłącznie na myszach, które mogą reagować na toksynę inaczej niż ludzie i inne zwierzęta.
C. tetani wytwarza również egzotoksynę tetanolizynę , hemolizynę, która powoduje niszczenie tkanek.
Dystrybucja
Toksyna tężcowa rozprzestrzenia się przez przestrzenie tkankowe do układu limfatycznego i naczyniowego . Wchodzi do układu nerwowego przez połączenia nerwowo-mięśniowe i migruje przez pnie nerwowe do ośrodkowego układu nerwowego (OUN) na drodze wstecznego transportu aksonalnego przy użyciu dynein .
Struktura
Białko toksyny tężcowej ma masę cząsteczkową 150 kDa . Ulega translacji z tetX jako jedno białko, które jest następnie cięte na dwie części: łańcuch ciężki lub łańcuch B o masie 100 kDa i łańcuch lekki lub łańcuch A o masie 50 kDa. Łańcuchy są połączone wiązaniem dwusiarczkowym .
- Łańcuch B wiąże się z disialo- gangliozydami (GD2 i GD1b) na błonie neuronu i zawiera domenę translokacji, która wspomaga ruch białka przez tę błonę i do neuronu.
- Łańcuch A, endopeptydaza cynkowa z rodziny M27 , atakuje białko błonowe związane z pęcherzykami (VAMP).
Gen TetX kodujący to białko znajduje się na plazmidzie PE88.
Kilka struktur domeny wiążącej i domeny peptydazy zostało rozwiązanych za pomocą krystalografii rentgenowskiej i zdeponowanych w PDB . Podsumowanie tych struktur jest dostępne na przykład za pomocą UniPDB Archived 2013-06-13 w aplikacji Wayback Machine w PDBe lub .
Mechanizm akcji
Mechanizm działania TeNT można podzielić i omówić w następujących krokach:
- Transport
-
- Specyficzne wiązanie w neuronach obwodowych
- Wsteczny transport aksonalny do interneuronów hamujących OUN
- Transcytoza z aksonu do interneuronów hamujących
- Działanie
Pierwsze trzy kroki przedstawiają drogę toksyny tężcowej z obwodowego układu nerwowego do miejsca, w którym jest ona pobierana do OUN i ma swój ostateczny efekt. Ostatnie trzy kroki dokumentują zmiany niezbędne do ostatecznego mechanizmu neurotoksyny.
Transport do interneuronów hamujących OUN rozpoczyna się od łańcucha B pośredniczącego w neurospecyficznym wiązaniu TeNT z błoną końcową nerwu. Wiąże się z polisialogangliozydami GT1b , podobnie jak neurotoksyna C. botulinum . Wiąże się również z innym słabo scharakteryzowanym białkowym zakotwiczonym w GPI, bardziej specyficznym dla TeNT. Zarówno gangliozyd, jak i białko zakotwiczone w GPI znajdują się w mikrodomenach lipidowych i oba są wymagane do określonego wiązania TeNT. Po związaniu neurotoksyna ulega endocytozie w nerwie i zaczyna przemieszczać się przez akson do neuronów rdzenia kręgowego. Następny krok, transcytoza z aksonu do interneuronu hamującego OUN, jest jedną z najmniej poznanych części działania TeNT. Zaangażowane są co najmniej dwa szlaki, jeden, który opiera się na recyklingu systemu pęcherzyków synaptycznych 2 (SV2), a drugi nie.
Gdy pęcherzyk znajdzie się w hamującym interneuronie, w jego translokacji pośredniczą pH i temperatura, w szczególności niskie lub kwaśne pH pęcherzyka i standardowe temperatury fizjologiczne. Po przemieszczeniu toksyny do cytosolu następuje chemiczna redukcja wiązania dwusiarczkowego w celu oddzielenia tioli, głównie przez enzym NADPH-reduktaza tioredoksyny-tioredoksyna . Łańcuch lekki może wtedy swobodnie rozszczepiać wiązanie Gln76-Phe77 synaptobrewiny. Rozszczepienie synaptobrewiny wpływa na stabilność rdzenia SNARE, ograniczając mu wejście w konformację niskoenergetyczną, która jest celem wiązania NSF. Synaptobrewina jest całką V-SNARE niezbędny do fuzji pęcherzyków z błonami. Ostatecznym celem TeNT jest rozszczepianie synaptobrewiny i nawet w niskich dawkach ma wpływ na zakłócanie egzocytozy neuroprzekaźników z hamujących interneuronów . Blokada neuroprzekaźników kwasu γ-aminomasłowego (GABA) i glicyny jest bezpośrednią przyczyną efektów fizjologicznych, które wywołuje TeNT. GABA hamuje neurony ruchowe, więc blokując GABA, toksyna tężcowa powoduje gwałtowny paraliż spastyczny. Działanie łańcucha A powstrzymuje również zaatakowane neurony przed uwalnianiem przekaźników pobudzających poprzez degradację białka synaptobrewina 2 . Łączną konsekwencją jest niebezpieczna nadreaktywność mięśni od najmniejszych bodźców czuciowych, ponieważ hamowane jest tłumienie odruchów motorycznych , co prowadzi do uogólnionych skurczów mięśni agonisty i antagonisty, określanych jako „skurcz tężcowy”.
Znaczenie kliniczne
Objawy kliniczne tężca powstają, gdy toksyna tężcowa blokuje impulsy hamujące, zakłócając uwalnianie neuroprzekaźników , w tym glicyny i kwasu gamma-aminomasłowego . Te hamujące neuroprzekaźniki hamują neurony ruchowe alfa . Przy zmniejszonym hamowaniu spoczynkowa szybkość wyładowań neuronu ruchowego alfa wzrasta, powodując sztywność, niepohamowane skurcze mięśni i skurcze. Charakterystyczne cechy to risus sardonicus (sztywny uśmiech), szczękościsk (powszechnie znany jako „szczęka szczękowa”) oraz opisthotonus (sztywny, wygięty w łuk). Mogą wystąpić napady padaczkowe , a także autonomiczny układ nerwowy . Wydaje się, że tetanospasmina zapobiega uwalnianiu neuroprzekaźników poprzez selektywne rozszczepianie składnika pęcherzyków synaptycznych zwanego synaptobrewiną II. Utrata hamowania wpływa również na przedzwojowe neurony współczulne w bocznej istocie szarej rdzenia kręgowego i powoduje nadpobudliwość współczulną i wysoki poziom krążących katecholamin . Nadciśnienie i tachykardia na przemian z może wystąpić niedociśnienie i bradykardia .
Skurcze tężcowe mogą występować w charakterystycznej postaci zwanej opisthotonos i być wystarczająco poważne, aby złamać długie kości. Krótsze nerwy są hamowane jako pierwsze, co prowadzi do charakterystycznych wczesnych objawów na twarzy i szczęce, risus sardonicus i szczękościsku .
Toksyna wiąże się z neuronami jest nieodwracalna [ nieudana weryfikacja ] , a funkcja nerwów może zostać przywrócona jedynie poprzez wzrost nowych zakończeń i synaps [ oryginalne badania? ] .
Odporność i szczepienie
Ze względu na swoją ekstremalną moc, nawet śmiertelna dawka tetanospasminy może być niewystarczająca do wywołania odpowiedzi immunologicznej. Naturalnie nabyte infekcje tężcem zwykle nie zapewniają odporności na kolejne infekcje. Immunizacja (która jest nietrwała i musi być powtarzana okresowo) zamiast tego wykorzystuje mniej śmiercionośny toksoid pochodzący z toksyny, jak w szczepionce przeciw tężcowi i niektórych szczepionkach skojarzonych (takich jak DTP ).
Linki zewnętrzne
- tetanospasmina w US National Library of Medicine Medical Subject Headings (MeSH)
-
 Media związane z neurotoksyną tężcową w Wikimedia Commons
Media związane z neurotoksyną tężcową w Wikimedia Commons - Tentoksylizyna w US National Library of Medicine Medical Subject Headings (MeSH)
-
Pellizzari R, Rossetto O, Schiavo G, Montecucco C (1999). „Tężec i neurotoksyny botulinowe: mechanizm działania i zastosowania terapeutyczne” . Filoz. Trans. R Soc. Londyn. B Biol. nauka . 354 (1381): 259–68. doi : 10.1098/rstb.1999.0377 . PMC 1692495 . PMID 10212474 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - Neurotoksyna w Toksykonie [ stały martwy link ]
- Podróż neurotoksyn tężcowych i botulinowych w neuronach
- W jaki sposób toksyny tężca i botuliny wiążą się z błonami neuronów?

