Współczynnik przewodu
|
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
|
Identyfikator klienta PubChem
|
|
|
|
| Nieruchomości | |
| C 130 H 250 O 15 | |
| Masa cząsteczkowa | 2 053 0,415 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|

Czynnik sznurowy lub dimykolan trehalozy to cząsteczka glikolipidu występująca w ścianie komórkowej Mycobacterium tuberculosis i podobnych gatunków. Jest głównym lipidem znajdującym się na zewnątrz M. tuberculosis . Czynnik pępowinowy wpływa na ułożenie M. tuberculosis w długie i smukłe formacje, stąd jego nazwa. Czynnik pępowinowy jest zjadliwy w stosunku do komórek ssaków i ma kluczowe znaczenie dla przeżycia M. tuberculosis u żywicieli, ale nie poza nimi. Zaobserwowano, że czynnik pępowinowy wpływa na odpowiedź immunologiczną , indukuje powstawanie ziarniniaków i hamuje wzrost guza . Uważa się , że lek przeciwprątkowy SQ109 hamuje poziom produkcji TDM i w ten sposób zakłóca jego montaż ściany komórkowej.
Struktura
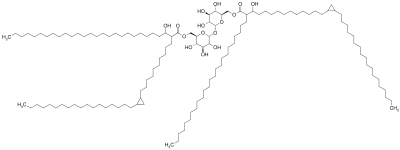
Cząsteczka czynnika pępowinowego składa się z cząsteczki cukru , trehalozy ( disacharydu ), składającej się z dwóch połączonych ze sobą cząsteczek glukozy . Trehaloza jest estryfikowana do dwóch reszt kwasu mykolowego. Jedna z dwóch reszt kwasu mikolowego jest przyłączona do szóstego węgla jednej glukozy, podczas gdy druga reszta kwasu mikolowego jest przyłączona do szóstego węgla drugiej glukozy. W związku z tym czynnik pępowinowy jest również nazywany trehalozo-6,6'-dimykolanem. Łańcuch węglowy reszt kwasu mikolowego ma różną długość w zależności od gatunku bakterii, w których się znajduje, ale ogólny zakres wynosi od 20 do 80 atomów węgla. Amfifilowy charakter czynnika kordowego prowadzi do różnych struktur, gdy wiele cząsteczek czynnika pępowinowego znajduje się w bliskiej odległości. Na hydrofobowej powierzchni spontanicznie tworzą krystaliczną monowarstwę. Ta krystaliczna monowarstwa jest niezwykle trwała i mocna; jest silniejszy niż jakikolwiek inny amfifil występujący w biologii. Ta monowarstwa tworzy się również na powierzchniach olej-woda, plastik-woda i powietrze-woda. W środowisku wodnym wolnym od powierzchni hydrofobowych czynnik kordowy tworzy micelę. Ponadto czynnik pępowinowy łączy się z lipoarabinomannanem (LAM), który znajduje się również na powierzchni M. tuberculosis , tworząc asymetryczną dwuwarstwę. Te właściwości powodują, że bakterie wytwarzające czynnik kordowy rosną w długie, przeplatające się włókna, nadając im wygląd podobny do liny lub sznurka, gdy są barwione i oglądane pod mikroskopem (stąd nazwa).
Dowód zjadliwości
Duża ilość czynnika pępowinowego występuje w zjadliwym M. tuberculosis , ale nie w niezjadliwym M. tuberculosis . Ponadto M. tuberculosis traci swoją zjadliwość, jeśli jego zdolność do wytwarzania cząsteczek czynnika pępowinowego jest zagrożona. W konsekwencji, gdy wszystkie lipidy zostaną usunięte z zewnętrznej powierzchni M. tuberculosis , przeżywalność bakterii w gospodarzu jest zmniejszona. Kiedy czynnik pępowinowy zostanie z powrotem dodany do tych komórek, M. tuberculosis przeżywa w tempie podobnym do swojego pierwotnego stanu. Czynnik pępowinowy zwiększa zjadliwość gruźlicy u myszy, ale ma minimalny wpływ na inne infekcje.
Funkcja biologiczna
Funkcja czynnika kordowego w dużym stopniu zależy od środowiska, w którym się znajduje, a zatem od jego konformacji. Jest to oczywiste, ponieważ czynnik pępowinowy jest szkodliwy, gdy jest wstrzykiwany z roztworem oleju, ale nie z roztworem soli, nawet w bardzo dużych ilościach. Czynnik pępowinowy chroni M. tuberculosis przed mechanizmami obronnymi żywiciela. W szczególności czynnik pępowinowy na powierzchni M. tuberculosis zapobiega fuzji między pęcherzykami fagosomalnymi zawierającymi komórki M. tuberculosis a lizosomami, które mogłyby je zniszczyć. Poszczególne składniki czynnika pępowinowego, cukry trehalozy i reszty kwasu mikolowego, nie są w stanie wykazać tej aktywności; cząsteczki czynnika pępowinowego muszą być w pełni nienaruszone. Aktywność esterazy ukierunkowana na czynnik pępowinowy powoduje lizę M. tuberculosis . Jednak M. tuberculosis muszą nadal być żywe, aby zapobiec tej fuzji; komórki zabite ciepłem z czynnikiem rdzeniowym nie są w stanie zapobiec trawieniu. Sugeruje to, że wymagana jest dodatkowa cząsteczka z M. tuberculosis . Niezależnie od tego, zdolność czynnika rdzeniowego do zapobiegania fuzji jest związana ze zwiększoną siłą hydratacji lub zawadą steryczną. Czynnik kordowy pozostaje na powierzchni M. tuberculosis , dopóki nie zwiąże się z kroplą lipidu, gdzie utworzy monowarstwę. Następnie, ponieważ czynnik kordowy jest w konfiguracji jednowarstwowej, ma inną funkcję; staje się śmiertelne lub szkodliwe dla organizmu żywiciela. Makrofagi mogą umrzeć w kontakcie z monowarstwami czynnika kordowego, ale nie wtedy, gdy czynnik kordowy występuje w innych konfiguracjach. Wraz ze wzrostem powierzchni monowarstwowej czynnika kordowego zwiększa się jego toksyczność. Wykazano, że długość łańcucha węglowego czynnika kordu również wpływa na toksyczność; dłuższy łańcuch wykazuje wyższą toksyczność. Ponadto wykazano , że fibrynogen adsorbuje się na monowarstwach czynnika pępowinowego i działa jako kofaktor jego efektów biologicznych.
Odpowiedzi gospodarza i cytokiny
Liczne reakcje o różnym działaniu wynikają z obecności czynnika pępowinowego w komórkach gospodarza. Po ekspozycji na czynnik pępowinowy przez 2 godziny, 125 genów w genomie myszy ulega regulacji w górę. Po 24 godzinach 503 geny są regulowane w górę, a 162 geny są regulowane w dół. Dokładne mechanizmy chemiczne działania czynnika kordowego nie są do końca znane. Jednak jest prawdopodobne, że kwasy mikolowe czynnika pępowinowego muszą przejść modyfikację cyklopropylową, aby doprowadzić do odpowiedzi układu odpornościowego gospodarza na początkową infekcję. Ponadto wiązania estrowe w czynniku kordowym są ważne ze względu na jego działanie toksyczne. Istnieją dowody na to, że czynnik pępowinowy jest rozpoznawany przez receptor Mincle , który znajduje się na makrofagach. Aktywowany receptor Mincle prowadzi do szlaku, który ostatecznie prowadzi do produkcji kilku cytokin . Te cytokiny mogą prowadzić do dalszej produkcji cytokin, które promują reakcje zapalne. Czynnik sznurowy, poprzez receptor Mincle, powoduje również rekrutację neutrofili, które również prowadzą do cytokin prozapalnych. Istnieją jednak również dowody na to, że za produkcję cytokin odpowiedzialny jest raczej receptor toll-like 2 (TLR2) w połączeniu z białkiem MyD-88 niż receptor Mincle.
Obecność czynnika pępowinowego zwiększa produkcję cytokin interleukiny-12 (IL-12), interleukiny-1 beta (IL-1β), interleukiny-6 (IL-6), czynnika martwicy nowotworów (TNFα) i białka zapalnego makrofagów-2 (MIP-2), z których wszystkie są prozapalnymi cytokinami ważnymi dla tworzenia się ziarniniaka. IL-12 jest szczególnie ważna w obronie przed M. tuberculosis ; bez tego M. tuberculosis rozprzestrzenia się bez przeszkód. IL-12 wyzwala produkcję większej ilości cytokin przez limfocyty T i komórki NK, jednocześnie prowadząc do dojrzałych komórek Th1, a tym samym prowadząc do odporności. Następnie, przy dostępnej IL-12, komórki Th1 i komórki NK wytwarzają cząsteczki interferonu gamma (IFN-γ), a następnie je uwalniają. Z kolei cząsteczki IFN-γ aktywują makrofagi.
Kiedy makrofagi są aktywowane przez czynnik pępowinowy, mogą tworzyć ziarniniaki wokół komórek M. tuberculosis . Aktywowane makrofagi i neutrofile powodują również wzrost czynnika wzrostu śródbłonka naczyniowego (VEGF), który jest ważny dla angiogenezy, etapu powstawania ziarniniaka. Ziarniniaki mogą powstawać zarówno z komórkami T, jak i bez nich, co wskazuje, że mogą być typu ciała obcego lub nadwrażliwości. Oznacza to, że czynnik pępowinowy może stymulować odpowiedź, działając jako obca cząsteczka lub powodując szkodliwe reakcje układu odpornościowego, jeśli gospodarz jest już uodporniony. Zatem czynnik pępowinowy może działać jako niespecyficzny czynnik drażniący lub antygen zależny od limfocytów T. Ziarniniaki otaczają M. tuberculosis , aby powstrzymać bakterie przed rozprzestrzenianiem się, ale pozwalają również bakteriom pozostać w gospodarzu. Stamtąd tkanka może ulec uszkodzeniu, a choroba może przenosić się dalej z czynnikiem pępowinowym. Alternatywnie, aktywowane makrofagi mogą zabijać M. tuberculosis poprzez reaktywne półprodukty azotowe w celu usunięcia infekcji.
Oprócz indukowania tworzenia się ziarniniaków, aktywowane makrofagi, które powstają w wyniku IL-12 i IFN-γ, są w stanie ograniczyć wzrost guza. Co więcej, wytwarzanie przez czynnik pępowinowy TNF-α, znanego również jako kachektyna, może również wywoływać kacheksję lub utratę wagi u gospodarzy. Czynnik pępowinowy również zwiększa aktywność NADazy u gospodarza, a tym samym obniża NAD; enzymy wymagające odpowiedniego zmniejszenia aktywności NAD. Czynnik kordowy jest zatem w stanie blokować fosforylację oksydacyjną i łańcuch transportu elektronów w błonach mitochondrialnych. Wykazano, że u myszy czynnik pępowinowy powoduje atrofię grasicy poprzez apoptozę; podobnie u królików wystąpił zanik grasicy i śledziony. Atrofia ta występuje w połączeniu z tworzeniem się ziarniniaków, a jeśli powstawanie ziarniniaków jest zaburzone, postęp atrofii jest również zaburzony.
Zastosowania i zastosowania naukowe
Zakażenie M. tuberculosis pozostaje poważnym problemem na świecie, a wiedza o czynniku pępowinowym może być przydatna w zwalczaniu tej choroby. Na przykład glikoproteina znana jako laktoferyna jest zdolna do łagodzenia produkcji cytokin i tworzenia się ziarniniaków wywołanych przez czynnik pępowinowy. Jednak czynnik pępowinowy może służyć jako użyteczny model dla wszystkich patogennych glikolipidów, a zatem może zapewnić wgląd w coś więcej niż tylko sam czynnik wirulencji. Skutecznym narzędziem do takich badań są kulki hydrofobowe pokryte czynnikiem kordowym; są w stanie odtworzyć odpowiedź organizmu na czynnik pępowinowy z M. tuberculosis . Koraliki Cord Factor są łatwo tworzone i stosowane do badań organizmów, a następnie łatwo odzyskiwane.
Możliwe jest tworzenie liposomów czynnika sznurowego poprzez emulsję wodną; te liposomy są nietoksyczne i mogą być używane do utrzymywania stałego dopływu aktywowanych makrofagów. Odpowiednio kontrolowany czynnik rdzeniowy może być potencjalnie przydatny w walce z rakiem, ponieważ IL-12 i IFN-γ są w stanie ograniczyć wzrost guzów.
