Clostridium difficile toksyna B
| Toksyna B | |||||||
|---|---|---|---|---|---|---|---|
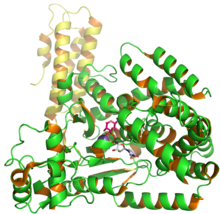 Struktura transferazy glukozylowej C. difficile Toksyna B przedstawiająca UDP i glukozę z wpisu PDB 2BVM.
| |||||||
| Identyfikatory | |||||||
| Organizm | |||||||
| Symbol | toxB | ||||||
| Alt. symbolika | tcdB | ||||||
| Entrez | 4914074 | ||||||
| WPB | 2BVM | ||||||
| RefSeq (Prot) | YP_001087135.1 | ||||||
| UniProt | P18177 | ||||||
| Inne dane | |||||||
| numer WE | 2.4.1.- | ||||||
| Chromosom | genom: 0,79 - 0,8 Mb | ||||||
| |||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| helikalnej domeny N-końcowej toksyny TcdB | |||||||||
| Symbol | TcdB_N | ||||||||
| Pfam | PF12918 | ||||||||
| |||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| domeny katalitycznej glikozylotransferazy TcdA/TcdB | |||||||||
| Symbol | TcdA_TcdB | ||||||||
| Pfam | PF12919 | ||||||||
| |||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| rodziny peptydazy C80 | |||||||||
| Symbol | Peptydaza_C80 | ||||||||
| Pfam | PF11713 | ||||||||
| InterPro | IPR020974 | ||||||||
| |||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| domen tworzących pory TcdA/TcdB | |||||||||
| Symbol | TcdA_TcdB_por | ||||||||
| Pfam | PF12920 | ||||||||
| TCDB | 1.C.57 | ||||||||
| Nadrodzina OPM | 199 | ||||||||
| Białko OPM | 6oq6 | ||||||||
| |||||||||
Toksyna B Clostridium difficile jest cytotoksyną wytwarzaną przez bakterie Clostridioides difficile , wcześniej znane jako Clostridium difficile . Jest to jeden z dwóch głównych rodzajów toksyn wytwarzanych przez C. difficile , drugi to pokrewna enterotoksyna ( toksyna A ). Oba są bardzo silne i śmiercionośne.
Struktura
Toksyna B (TcdB) jest cytotoksyną o masie cząsteczkowej 270 kDa i punkcie izoelektrycznym pl równym 4,1. Toksyna B ma cztery różne domeny strukturalne: katalityczną , proteazę cysteinową , translokację i wiązanie receptora . N -końcowa domena katalityczna glukozylotransferazy obejmuje reszty aminokwasowe 1–544, podczas gdy domena proteazy cysteinowej zawiera reszty 545–801. Ponadto region translokacji zawiera reszty aminokwasowe od 802 do 1664, podczas gdy region wiążący receptor jest częścią regionu C-końcowego i obejmuje reszty aminokwasowe od 1665 do 2366.
Aktywność glikozylacyjna toksyny B zachodzi w N-końcowym regionie katalitycznym (reszty 1–544). Ten region glikozyluje substraty niezależnie od jakiejkolwiek aktywności cytotoksycznej. Jednak niewielka delecja regionu wiążącego receptor powoduje osłabienie aktywności toksyny B. Region translokacji zawiera hydrofobową strukturę przypominającą łodygę, która może pomóc pozostałościom 958–1130 w tworzeniu błon obejmujących pory . Region wiążący receptor, który obejmuje C-końcowy region powtarzalny (CRR) zwiększa interakcję z błoną TcdB, ale nie uczestniczy w tworzeniu porów. Ponadto proteazy cysteinowej i translokacji mają złożone struktury, które odgrywają ważną rolę funkcjonalną w translokacji i wiązaniu receptora. Jednak usunięcie regionu translokacji aminokwasów zmniejsza aktywność cytotoksyczną 4-krotnie. Zarówno proteazy cysteinowe , jak i większość regionów translokacji zawiera białka hydrofobowe , które wykazują dostęp do TcdB i innych toksyn przechodzących przez błony komórkowe .
Domena wiążąca receptor
C -koniec TcdB (zielony region na ryc. 2) zawiera region znany jako połączone powtarzalne oligopeptydy (CROP), który zawiera reszty aminokwasowe 1831–2366. Te CROP składają się z 19–24 krótkich powtórzeń (SR) aminokwasów, około 31 długich powtórzeń (LR) aminokwasów, toksyny A i toksyny B. Region CROP TcdB składa się z 19 SR i 4 LR. Ten region SR i LR umożliwia tworzenie motywów wiążących ścianę komórkową, które pomagają wiązać ugrupowania cukrowe na powierzchni komórek.
Oczyszczenie
W celu oczyszczenia toksyny B z kultur komórkowych C. difficile stosuje się pożywkę mózgowo-sercową , ponieważ sprzyja ona syntezie toksyny B. Metoda filtracyjna ułatwia oczyszczanie toksyny B z supernatantu C. difficile . Stężenie toksyny w supernatancie jest proporcjonalne do liczby komórek organizmu. W wielu badaniach zaproponowano, że większość toksyn jest uwalniana albo w późnej fazie logarytmicznej , albo we wczesnych fazach stacjonarnych , stąd toksyna B jest w sposób ciągły wydzielana przez komórki. Chociaż istnieje wiele metod stosowanych w różnych badaniach w oczyszczaniu toksyny B, większość badań wykorzystuje metody obejmujące stężenia ultrafiltrowanego siarczanu amonu lub wytrącanie zamiast filtracji żelowej lub chromatografii jonowymiennej . Ponadto skuteczność metody chromatografii jonowymiennej pomaga rozróżnić TcdA i TcdB.
Funkcjonować
Gdy katalityczna reszta treoninowa glukozylotransferazy dezaktywuje rodzinę małych GTPaz , np. rodzinę Rho ; Rac i Cdc42 wewnątrz komórek docelowych zaburzają mechanizmy transdukcji sygnału , co prowadzi do dysfunkcji cytoszkieletu aktynowego , połączenia komórka - komórka i apoptozy (ryc. 5). Rho indukuje aktywność włókien stresowych aktyny . Białka Rac kontrolują aktywność marszczenia błon i neutrofili oksydazy NADPH . Cdc42 reguluje tworzenie włókien F-aktyny w filopodiach .
Cytotoksyczność
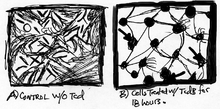
Kilka badań wykazało, że obecność TcdB w komórkach ssaków prowadzi do szybkich zmian w morfologii komórki i sygnalizacji komórkowej . W krótkim czasie komórki mają wygląd płytki nazębnej z małymi dawkami TcdB i TcdA. Ponadto śmierć komórek jest głównym wpływem tych toksyn po zatruciu komórek . Badanie przeprowadzone przez Donta i wsp. wykazało, że TcdB ma poważny wpływ na inne komórki ssaków, takie jak komórki jajnika chomika chińskiego , ludzkie komórki nabłonka szyjki macicy, komórki nadnerczy myszy , hepatocyty szczura i astrocyty szczura (ryc. 3).
Aktywność cytotoksyczna opiera się na typach komórek, które mogą wahać się od 4-krotnego do 200-krotnego. Ogólnie rzecz biorąc, gdy komórki są zakażone TcdB, nie tylko tracą integralność strukturalną, ale także zmniejszają się włókna F-aktyny . Zaokrąglanie komórek przez TcdB trwa nie dłużej niż 2 godziny (ryc. 4), ale jeśli chodzi o śmierć komórki , może to zająć około 24 godzin. W odniesieniu do biegunki związanej z Clostridium difficile (CDAD), skutki cytopatii są bardziej krytyczne niż rzeczywista śmierć komórki, ponieważ gdy komórki tracą integralność filamentu aktynowego cytoszkieletu , tracą również swoją normalną funkcję.

Wpływ na małe GTPazy
Przyczyną cytotoksycznego działania TcdB w komórce gospodarza jest głównie pośredniczenie w endocytozie receptora [ potrzebne źródło ] . Kwaśne endosomy umożliwiają toksynie B wejście do cytozolu . Zjawisko to odbywa się poprzez wiążący region receptora , który umożliwia toksynie wnikanie do komórek gospodarza [ potrzebne źródło ] . Poprzez dostępność cytozolu komórek gospodarza , TcdB dezaktywuje małe GTPazy ( ryc. 5), np. członków rodziny Rho Rac i Cdc42 w procesie glikozylacji treoniny 35 w Cdc42 i Rac oraz treoniny 37 w Rho. Te GTPazy Rho znajdują się wszechobecnie w cytozolu komórek eukariotycznych , które są odpowiedzialne za organizację cytoszkieletu aktynowego , ponieważ toksyny w cytozolu powodują kondensację włókien aktynowych w wyniku zaokrąglania komórek i pęcherzyków błonowych (ryc. 3), co ostatecznie prowadzi do apoptozy . TcdB powoduje krytyczne zmiany w dynamice i morfologii komórki . Figura 3 przedstawia prawdopodobny wpływ toksyny B na powierzchnię komórki; pęcherzyki błonowe (czarne strzałki). Ponadto TcdB dezaktywuje GTPazy Rho. W konsekwencji dochodzi do przerwania połączeń komórka-komórka, co zwiększa nabłonkową przepuszczalność toksyny B i gromadzenie się płynu w świetle. Jest to jeden z głównych czynników wywołujących biegunkę związaną z Clostridium difficile (CDAD) (ryc. 5).

Ponadto szybkość hydrolizy UDP-glukozy przez TcdB jest około pięciokrotnie większa niż TcdA. Kilka badań wykazało, że Rho wykazuje potranslacyjną poprzez prenylację i karboksymetylację, która zachodzi po cytoplazmatycznej stronie błony komórkowej , stąd wymiana GTP na GDP . Kiedy TcdB wiąże się z Rho i innymi małymi GTPazami , GTP hydrolizuje do GDP , co prowadzi do związanego z GTP (aktywnego) do związanego z GDP (nieaktywnego) (ryc. 5). Ponadto ta aktywność wymiany jest regulowana przez guaniny w cytozolu komórki.
Zakłócenia na ścieżkach sygnałowych
Regulacja komórkowa Rho, Rac i Cdc42 ma wpływ poza sąsiedztwo włókien aktynowych cytoszkieletu (ryc. 4). Te małe GTPazy są włączone do cyklu komórkowego , który reguluje sygnały za pośrednictwem kinaz kinaz białkowych aktywowanych mitogenem (MAPKK) . Niektóre fizjologiczne części komórek, które nie są zaangażowane w włókna aktynowe , mogą nie powodować natychmiastowego zaokrąglenia komórek lub śmierci komórki , ale w dalszej aktywności szlaku mogą prowadzić do pogorszenia jakości włókien aktynowych i ostatecznie do śmierci komórki .
W 1993 roku badanie przeprowadzone przez Shoshana i wsp. wykazało, że komórki z TcdB zmieniły aktywność fosfolipazy A2 . Było to zdarzenie niezależne od przerwania cytoszkieletu aktynowego . Shoshan i wsp. wykazali również, że TcdB hamuje aktywność sygnalizacyjną receptora przez dezaktywację białek Rho poprzez fosfolipazę D.
Tworzenie się porów
TcdB dostaje się do wnętrza komórki poprzez endocytozę za pośrednictwem klatryny . Kiedy toksyna B jest częścią cytozolu , glukozylotransferaza przechodzi przez błonę endosomalną , co obniża pH, indukuje translokację i ostatecznie prowadzi do zmian morfologicznych reszt regionu translokacji (958-1130 ). Regiony hydrofobowe są osadzone w błonie gospodarza, tworząc pory, które umożliwiają przejście domen glukozylotransferazy . Gdy komórki są zakażone TcdB w kwaśnym środowisku, osłabia toksyny i powoduje zmiany kształtu (ryc. 6). W konsekwencji kwaśnego pH, TcdB wykazuje wyraźne różnice w pierwotnej fluorescencji tryptofanu , wrażliwości proteaz i powierzchni hydrofobowych . Inna grupa wykazała, że zakwaszenie prowadzi do zmian konformacyjnych toksyny i, co ważniejsze, pomaga w tworzeniu się porów. Domniemany translokacji (ryc. 2) składa się z około 801–1400 aminokwasów, z których reszty 958–1130 są hydrofobowe i odpowiadają za tworzenie się porów przezbłonowych. W większości badań wykorzystano szczep TcdB 630 w celu wykazania aktywności tworzenia porów przez C. difficile .
Indukowane przez pH
Aby sprawdzić, czy skutki proteolitycznego rozszczepienia TcdB mają miejsce na powierzchni komórki, czy też w kwaśnych endosomach , w badaniach wykorzystano bafilomycynę A1 , o której wiadomo, że blokuje H typu v . + -ATPazy endosomów Zmniejsza to kwasowość w endosomach. Fizjologiczny szlak wychwytu TcdB zapobiega aktywności cytopatycznej TcdB. Gdy komórki znajdowały się w kwaśnym (pH 4,0) przez 5 minut po związaniu TcdB z powierzchnią komórki w temperaturze 37 stopni Celsjusza, zaobserwowano przegrupowania i zaokrąglenia kształtu. Jednakże, gdy zaokrąglone komórki inkubowano przez dodatkową godzinę w obojętnym pH (7,0) z podobnymi parametrami, nie zaobserwowano zaokrąglenia komórek. Oba badania wykazały, że toksyna B ma właściwość rozszczepienia proteolitycznego , co ma kluczowe znaczenie dla dostępu do cytozolu . Posiadanie kwaśnego pH endosomu prowadzi do zmian topologicznych TcdB (ryc. 6).
Genetyka
Gen kodujący białko TcdB, tcdB , znajduje się w regionie chromosomalnym o długości 19,6 kb . Jest to znane jako locus patogenności lub PaLoc (ryc. 2) . Otwarta ramka odczytu (ORF) dla tcdB ma długość 7098 nukleotydów . Należy wspomnieć, że oprócz głównych genów toksyn w regionie PaLoc istnieją trzy inne dodatkowe geny , które kodują region PaLoc: tcdR (L), tcdC (R) i tcdE w środku. Geny te pomagają regulować ekspresję TcdA i TcdB. Pomagają również wydzielać lub uwalniać toksyny z komórki. Gen kodujący tcdE , zlokalizowany pomiędzy tcdB i tcdA, jest analogiczny do białek holinowych , dlatego sugeruje się, że tcdE działa jako gen ułatwiający , który zwiększa uwalnianie lub sekrecję TcdA i TcdB, w konsekwencji zwiększając przepuszczalność błony komórkowej gospodarza .
Wykrywanie toksyn
Istnieją różne rozmiary plazmidów C. difficile . Wykryte masy cząsteczkowe mieszczą się w zakresie od 2,7x106 do 100x106 , ale rozmiary plazmidów nie wykazują korelacji z toksycznością . W celu wykrycia poziomu toksyny B w C. difficile klinicyści szeroko wykorzystują testy hodowli komórkowej pochodzące z próbek kału pacjentów z PMC . Test na hodowli komórkowej jest uważany za „złoty standard” w wykrywaniu toksyczności u C. difficile , ponieważ niewielka ilość toksyny B może spowodować zaokrąglenie komórek (ryc. 4), dlatego główną zaletą laboratoriów klinicznych jest korelacje z CDAD spowodowane przez TcdB. Chociaż aktywność cytotoksyczną dużych toksyn Clostridium (LCT) stwierdzono w próbkach kału pacjentów PMC, aktywność toksyny B miała bardziej szkodliwe działanie cytotoksyczne w porównaniu z toksyną A. Dlatego aktywność toksyny A jest osłabiona, gdy nie jest izolowana z toksyny B. Wykrywanie toksyczności C. difficile jest niezwykle czułe, jednak użycie testu na hodowli komórkowej pozwala laboratoriom klinicznym sprostać wyzwaniu; użycie dawki tak małej jak 1 pg/ml toksyny B wystarczy, aby spowodować zaokrąglenie komórek. Jest to główna zaleta stosowania testu tkankowego do wykrywania toksyczności u pacjentów z PMC . Chociaż laboratoria kliniczne próbowały zastosować test immunoenzymatyczny (ELISA) do mikropłytek testowych i inne techniki do wykrywania aktywności cytotoksycznej toksyny B w kale pacjentów z PMC , wyniki nie są tak dokładne, jak te, w których testy na hodowlach komórkowych były użyte.
Czynnik produkcji
Badania wykazały, że po dodaniu środka przeciwdrobnoustrojowego , np. klindamycyny , do pożywki hodowlanej, aktywność cytotoksyczna w hodowlach C. difficile wzrasta 4–8-krotnie. Ponadto, znając rolę antybiotyków w przyczynach PMC, wiele wcześniejszych badań koncentrowało się na skutkach wytwarzania toksyn przez środki przeciwdrobnoustrojowe . W rezultacie badania pozwoliły stwierdzić, że subinhibicyjny charakter wankomycyny i penicyliny zwiększa wytwarzanie toksyn w kulturach C. difficile . Ilości wytwarzanych toksyn były skorelowane ze zużyciem pożywki dla organizmów. Inne badanie wykazało, że wysoki poziom produkcji toksyn TcdB obserwowano w złożonych podłożach, takich jak bulion infuzyjny mózgu i serca . Wyizolowano wysoce zjadliwe toksyny . I odwrotnie, przy izolacji słabo zjadliwych szczepów wytwarzano niskie poziomy toksyn . Pokazuje to zatem, że produkcja toksyn była współregulowana. Chociaż mechanizm udziału środowiska w modulowaniu sygnałów wyrażających toksyny nie jest poznany, badania in vitro wykazały, że ekspresja toksyn jest wzmacniana przez represję kataboliczną i stres, np. antybiotyki . Inne badanie wykazało, że ograniczenie biotyny w dobrze scharakteryzowanym podłożu zwiększa produkcję TcdB 64-krotnie i TcdA 35-krotnie. Dokonano tego z C. difficile i dawkami biotyny tak małymi jak 0,05 nM. Kilka innych wczesnych badań argumentowało przeciwko teorii, że produkcja toksyny ma cokolwiek wspólnego ze stresem lub represją kataboliczną toksyny TcdA lub TcdB. Ponadto wiele badań mówi, że głównym powodem różnic między innymi badaniami jest to, że wytwarzanie toksyn nie występuje we wszystkich izolatach C. difficile .
Znaczenie kliniczne
Wiele wczesnych badań sugerowało, że toksyna A (znana również jako TcdA) jest głównym białkiem toksyny powodującym biegunkę związaną z antybiotykami (AAD); jednak naukowcy w ciągu ostatniej dekady wykazali, że toksyna B (lub TcdB) odgrywa ważniejszą rolę w chorobie, niż ktokolwiek przewidywał. Dzięki tej wiedzy toksyna B została zidentyfikowana jako główny wirulencji , który powoduje otwieranie ścisłych połączeń komórek nabłonka jelitowego , co umożliwia toksynie zwiększenie przepuszczalności naczyń i wywołanie krwotoku . W związku z tym prowadzi to do , że czynnik martwicy nowotworu α (TNF α) i prozapalne interleukiny są głównymi czynnikami sprawczymi rzekomobłoniastego zapalenia jelita grubego (PMC) i biegunki związanej z antybiotykami (AAD).
Zaangażowanie toksyny A i – co najważniejsze – toksyny B jest kluczowym elementem determinującym chorobę wywołaną przez C. difficile . Laboratoria kliniczne zidentyfikowały te toksyny w kale pacjentów na podstawie testów przeciwciał i cytotoksyczności . Wykazano, że te toksyny bakteryjne są związane z krwotoczną Clostridium sordellii (TcsH), śmiertelną toksyną (TcsL) i toksyną alfa Clostridium novyi (Tcn α), co czyni tę kohortę dużą rodziną toksyn Clostridium. Z powodu podobieństw tych toksyn z innymi, naukowcy sklasyfikowali je jako rodzinę dużych toksyn Clostridium (LCT).
Mechanizm działania bezlotoksumabu z TcdB
Bezlotoksumab jest ludzkim przeciwciałem monoklonalnym przeznaczonym do zapobiegania nawrotom zakażeń Clostridium difficile. Na podstawie rentgenowskiej krystalizowanej struktury N-końca TcdB zidentyfikowano, że toksyna składa się z trzech domen: domeny glukozylotransferazy (GTD), proteazy cysteinowej i domeny połączonego powtarzalnego oligopeptydu (CROP). Bezlotoksumab specyficznie wiąże się z dwoma homologicznymi miejscami w domenie CROP TcdB. Analiza strukturalna za pomocą krystalografii rentgenowskiej wskazuje, że wiązanie przeciwciała częściowo zamyka domniemane kieszenie wiążące węglowodany. Zgodnie z tą ideą, bezlotoksumab blokuje wiązanie TcdB z komórkami ssaków.
Rola w rzekomobłoniastym zapaleniu jelita grubego
we wczesnych stadiach choroby PMC TcdA jest silniejszy niż TcdB. Wywnioskowano to z eksperymentów in vivo, w których produkcja toksyn TcdA była bardziej dotkliwa niż TcdB w przypadku antybiotykowego zapalenia jelita grubego. Później kilka badań wykazało, że TcdB odgrywa główną rolę w chorobie PMC i ADD. Badanie wykazało, że chociaż C. difficile nie wytwarza TcdA, nadal wykazuje objawy choroby. Ponadto późniejsze badania wykazały, że oczyszczona postać TcdB jest bardziej śmiercionośną enterotoksyną w porównaniu z TcdA, a także, że nabłonek jelitowy jest poważnie uszkodzony i powoduje ostrą odpowiedź zapalną. Dzięki lepszemu zrozumieniu toksyny naukowcy byli w stanie stwierdzić, że TcdB jest głównym czynnikiem wirulencji , który powoduje CDI w porównaniu z TcdA. Jednakże, gdy TcdA jest obecny w jelicie, pomaga ułatwić działanie TcdB, aby mieć szerszy wpływ, w konsekwencji wpływając na wiele układów narządów. Ponadto, gdy chomiki były szczepione przeciwko TcdA, okazało się, że chomiki nie były w pełni chronione przed C. difficile , co doprowadziło badania do wniosku, że TcdB jest bardzo śmiercionośny i silny. Co więcej, wstrzyknięcie małej dawki TcdA ze śmiertelną dawką TcdB dożylnie lub dootrzewnowo okazało się wystarczające do spowodowania śmierci zwierzęcia. Dlatego TcdA działa jako czynnik ułatwiający wyjście TcdB z jelita.