Dendrotoksyna
Dendrotoksyny to klasa presynaptycznych neurotoksyn wytwarzanych przez węże mamba ( Dendroaspis ) , które blokują określone podtypy bramkowanych napięciem kanałów potasowych w neuronach , zwiększając w ten sposób uwalnianie acetylocholiny w połączeniach nerwowo-mięśniowych . Ze względu na ich wysoką siłę działania i selektywność wobec kanałów potasowych, dendrotoksyny okazały się niezwykle przydatne jako farmakologiczne do badania struktury i funkcji tych białek kanałów jonowych .
Efekty funkcjonalne w układzie nerwowym
Wykazano, że dendrotoksyny blokują określone podtypy bramkowanych napięciem kanałów potasowych (K + ) w tkance nerwowej. [ potrzebne źródło ] W układzie nerwowym bramkowane napięciem kanały K + kontrolują pobudliwość nerwów i mięśni poprzez kontrolowanie spoczynkowego potencjału błonowego i repolaryzację błony podczas potencjałów czynnościowych . Wykazano, że dendrotoksyna wiąże węzły Ranviera neuronów ruchowych i blokuje aktywność tych kanałów potasowych. W ten sposób dendrotoksyny wydłużają czas trwania potencjałów czynnościowych i zwiększają uwalnianie acetylocholiny w złączu nerwowo-mięśniowym, co może skutkować nadpobudliwością mięśniową i objawami drgawkowymi.
Struktura dendrotoksyny
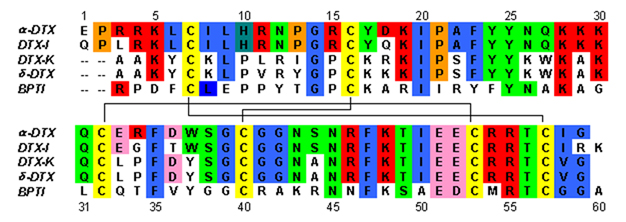
Dendrotoksyny to białka ~7 kDa składające się z pojedynczego łańcucha peptydowego o długości około 57-60 aminokwasów . Wyizolowano kilka homologów alfa-dendrotoksyny, z których wszystkie mają nieco inną sekwencję. Jednak architektura molekularna i konformacja fałdowania tych białek są bardzo podobne. Dendrotoksyny mają bardzo krótką 3 10 -helisę w pobliżu N-końca peptydu, podczas gdy dwuzwojowa helisa alfa występuje w pobliżu C-końca . Dwuniciowa antyrównoległa β-kartka zajmuje centralną część struktury molekularnej. Te dwie nici β są połączone zniekształconym regionem zakrętu β, który uważa się za ważny dla aktywności wiązania białka. Wszystkie dendrotoksyny są usieciowane przez trzy mostki dwusiarczkowe , które dodają stabilności białku i znacznie przyczyniają się do jego konformacji strukturalnej. Reszty cysteiny tworzące te wiązania dwusiarczkowe zostały zachowane wśród wszystkich członków rodziny dendrotoksyn i znajdują się w C7-C57, C16-C40 i C32-C53 (numeracja według alfa-dendrotoksyny).
Dendrotoksyny są strukturalnie homologiczne do inhibitorów proteazy serynowej typu Kunitza , w tym bydlęcego inhibitora trypsyny trzustkowej (BPTI). Wykazano, że alfa-dendrotoksyna i BPTI mają 35% identyczności sekwencji, a także identyczne wiązania dwusiarczkowe. Pomimo homologii strukturalnej między tymi dwoma białkami, dendrotoksyny nie wydają się wykazywać żadnej mierzalnej aktywności hamującej proteazy, takiej jak BPTI. Wydaje się, że ta utrata aktywności wynika z braku kluczowych reszt aminokwasowych, które powodują różnice strukturalne, które utrudniają kluczowe interakcje niezbędne dla aktywności proteazy obserwowanej w BPTI.
Dendrotoksyny to podstawowe białka, które w obojętnym pH posiadają dodatni ładunek netto . Większość dodatnio naładowanych reszt aminokwasowych dendrotoksyn znajduje się w dolnej części struktury, tworząc kationową po jednej stronie białka. Dodatni ładunek wynika z lizyny (Lys) i argininy (Arg), które są skoncentrowane w trzech głównych regionach białka: w pobliżu N-końca (Arg3, Arg4, Lys5), w pobliżu C-końca (Arg54, Arg55) i w wąski region zakrętu β (Lys28, Lys29, Lys30). Uważa się, że te dodatnio naładowane reszty mogą odgrywać kluczową rolę w aktywności wiązania dendrotoksyn, ponieważ mogą wchodzić w potencjalne interakcje z miejscami anionowymi (aminokwasy naładowane ujemnie) w porach kanałów potasowych.
Aktywność biologiczna
Farmakologia
Pojedyncza cząsteczka dendrotoksyny wiąże się odwracalnie z kanałem potasowym, aby wywierać działanie hamujące. Sugeruje się, że w tej interakcji pośredniczą elektrostatyczne między dodatnio naładowanymi resztami aminokwasowymi w domenie kationowej dendrotoksyny i ujemnie naładowanymi resztami w porach kanału jonowego . Uważa się, że kanały potasowe, podobnie jak inne kanały kationoselektywne, mają chmurę ładunków ujemnych, które poprzedzają otwarcie porów kanału, które pomagają przewodzić jony potasu przez ścieżkę przenikania. Powszechnie uważa się (choć nie udowodniono), że cząsteczki dendrotoksyny wiążą się z anionowymi w pobliżu zewnątrzkomórkowej powierzchni kanału i fizycznie zatykają pory, zapobiegając w ten sposób przewodnictwu jonów. Jednak Imredy i MacKinnon zasugerowali, że delta-dendrotoksyna może mieć miejsce wiązania poza centrum na ich docelowych białkach i może hamować kanał poprzez zmianę struktury kanału, zamiast fizycznego blokowania porów.
Biologicznie ważne pozostałości
W wielu badaniach próbowano określić, które reszty aminokwasowe są ważne dla aktywności wiązania dendrotoksyn z ich docelowymi kanałami potasowymi. Harvey i in. zastosowali modyfikacje specyficzne dla reszt, aby zidentyfikować reszty naładowane dodatnio, które były kluczowe dla aktywności blokującej dendrotoksyny-I. Poinformowali, że acetylacja Lys5 w pobliżu regionu N-końcowego i Lys29 w regionie beta-zwrotu doprowadziła do znacznego zmniejszenia powinowactwa wiązania DTX-I. Podobne wyniki uzyskano w przypadku dendrotoksyny-K przy użyciu ukierunkowanej mutagenezy w celu zastąpienia dodatnio naładowanych reszt lizyny i argininy obojętnymi alaninami . Te wyniki, wraz z wieloma innymi, sugerują, że dodatnio naładowane lizyny w N-końcowej połowie, szczególnie Lys5 w 310-helisie, odgrywają bardzo ważną rolę w wiązaniu dendrotoksyny z docelowymi kanałami potasowymi. Reszty lizyny w regionie zakrętu β dały bardziej mylące wyniki, wydają się być biologicznie krytyczne w niektórych homologach dendrotoksyny i nie są konieczne w przypadku innych. Ponadto mutacja całego trypletu lizyny (K28-K29-K30) do Ala-Ala-Gly w alfa-DTX spowodowała bardzo niewielką zmianę w aktywności biologicznej.
Istnieje ogólna zgoda co do tego, że konserwowana reszta lizyny w pobliżu N-końca (Lys5 w alfa-DTX) ma kluczowe znaczenie dla aktywności biologicznej wszystkich dendrotoksyn, podczas gdy dodatkowe reszty, takie jak te w regionie zwrotu beta, mogą odgrywać pewną rolę w specyficzności dendrotoksyn poprzez pośredniczenie w interakcjach poszczególnych toksyn z ich indywidualnymi miejscami docelowymi. To nie tylko pomaga wyjaśnić ścisłą specyficzność niektórych dendrotoksyn dla różnych podtypów bramkowanych napięciem kanałów K + , ale także wyjaśnia różnice w sile działania dendrotoksyn dla wspólnych kanałów K + . Na przykład Wang i in. wykazało, że w interakcji dendrotoksyny-K z KV 1.1 pośredniczą jej reszty lizyny zarówno na N-końcu, jak iw regionie β-zakrętu, podczas gdy alfa-dendrotoksyna wydaje się oddziaływać z celem wyłącznie przez N-koniec. Ta mniej ekspansywna domena interaktywna może pomóc wyjaśnić, dlaczego alfa-dendrotoksyna jest mniej dyskryminująca, podczas gdy dendrotoksyna-K jest ściśle selektywna dla KV 1.1 .
Zastosowania w badaniach
Kanały potasowe neuronów kręgowców wykazują wysoki stopień różnorodności, który umożliwia neuronom precyzyjne dostrojenie ich właściwości sygnalizacji elektrycznej poprzez ekspresję różnych kombinacji podjednostek kanałów potasowych. Ponadto, ponieważ regulują przepływ jonów przez błony biologiczne, są ważne w wielu aspektach regulacji komórkowej i transdukcji sygnału różnych typów komórek. Dlatego kanały potasowe bramkowane napięciem są celem dla szerokiej gamy silnych toksyn biologicznych z takich organizmów, jak węże, skorpiony , ukwiały i stożki . Zatem oczyszczanie jadu doprowadziło do izolacji toksyn peptydowych, takich jak dendrotoksyny, które stały się użytecznymi narzędziami farmakologicznymi do badania kanałów potasowych. Ze względu na swoją siłę działania i selektywność wobec różnych podtypów kanałów potasowych, dendrotoksyny stały się przydatne jako sondy molekularne do badań strukturalnych i funkcjonalnych tych białek. Może to pomóc w lepszym zrozumieniu ról odgrywanych przez poszczególne typy kanałów, a także w farmakologicznej klasyfikacji tych różnych typów kanałów. Ponadto dostępność znakowanych radioaktywnie dendrotoksyn zapewnia narzędzie do badań przesiewowych innych źródeł w poszukiwaniu nowych toksyn kanału potasowego, takich jak toksyny kanału potasowego klasy kalicludine w ukwiałach. Wreszcie informacje strukturalne dostarczane przez dendrotoksyny mogą dostarczyć wskazówek do syntezy terapeutycznych , które mogą być ukierunkowane na określone klasy kanałów potasowych. Dendrotoksyna I została również wykorzystana do oczyszczenia i scharakteryzowania białka kanału K +, z którym się wiąże, za pomocą różnych testów wiązania i technik chromatografii.
- ^ Gasparini S, Danse JM, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, CL de Medeiros C, Rowan EG, Harvey AL i Me'nez A (1998). Wyznaczenie miejsca funkcjonalnego alfa-dendrotoksyny: Funkcjonalne topografie dendrotoksyn są różne, ale mają wspólny konserwatywny rdzeń z innymi toksynami blokującymi kanały potasowe KV 1 . Journal of Biological Chemistry 273:25393-25403
- ^ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Strukturalna podstawa aktywności biologicznej dendrotoksyny-I, silnego blokera kanału potasowego. Biopolimery 54:44-57
- ^ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Struktura molekularna, analiza konformacyjna i badania struktury-aktywności dendrotoksyny i jej homologów z wykorzystaniem mechaniki molekularnej i technik dynamiki molekularnej. Journal of Medicinal Chemistry . 39:2141-2155
- ^ Imredy JP i MacKinnon R (2000). Energetyczne i strukturalne interakcje między delta-dendrotoksyną a bramkowanym napięciem kanałem potasowym. Journal of Molecular Biology 296:1283-1294
- ^ Harvey AL, Rowan EG, Vatanpour H, Engstrom A, Westerlund B, Karlsson E (1997). Zmiany aktywności biologicznej po acetylacji dendrotoksyny I z Dendroaspis polylepis (mamby czarnej). 35 :1263-1273
- ^ Wang FC, Bell N, Reid P, Smith LA, McIntosh P, Robertson B i Dolly JO (1999). Identyfikacja reszt w dendrotoksynie K odpowiedzialnych za jej rozróżnianie między neuronalnymi kanałami K + zawierającymi podjednostki KV 1.1 i 1.2 alfa. European Journal of Biochemistry 263:222-229
- ^ Yoshida S i Matsumoto S (2005). Wpływ alfa-dendrotoksyny na prądy K + i potencjały czynnościowe w neuronach zwoju nerwu trójdzielnego dorosłych szczurów opornych na tetrodotoksynę. Journal of Pharmacology and Experimental Therapeutics 314:437-445
- Bibliografia _ Łazduński, M. (1988-07-01). „Oczyszczanie i struktura podjednostek przypuszczalnego białka kanału K + zidentyfikowanego na podstawie jego właściwości wiązania dendrotoksyny I”. Obrady Narodowej Akademii Nauk . 85 (13): 4919–4923. Bibcode : 1988PNAS...85.4919R . doi : 10.1073/pnas.85.13.4919 . ISSN 0027-8424 . PMC80549 . _ PMID 2455300 .
Linki zewnętrzne
- dendrotoksyna w US National Library of Medicine Medical Subject Headings (MeSH)