Potencjał czynnościowy

Potencjał czynnościowy występuje, gdy potencjał błonowy określonej lokalizacji komórki szybko rośnie i spada. Ta depolaryzacja powoduje następnie podobną depolaryzację sąsiednich miejsc. Potencjały czynnościowe występują w kilku typach komórek zwierzęcych , zwanych komórkami pobudliwymi , do których należą neurony , komórki mięśniowe i niektóre komórki roślinne . Niektóre wydzielania wewnętrznego , takie jak komórki beta trzustki i niektóre komórki przedniego płata przysadki mózgowej, są również komórkami pobudliwymi.
W neuronach potencjały czynnościowe odgrywają główną rolę w komunikacji komórka-komórka, zapewniając - lub w odniesieniu do przewodzenia solnego , wspomagając - propagację sygnałów wzdłuż aksonu neuronu w kierunku butonów synaptycznych znajdujących się na końcach aksonu; sygnały te mogą następnie łączyć się z innymi neuronami w synapsach lub z komórkami motorycznymi lub gruczołami. W innych typach komórek ich główną funkcją jest aktywacja procesów wewnątrzkomórkowych. Na przykład w komórkach mięśniowych potencjał czynnościowy jest pierwszym krokiem w łańcuchu zdarzeń prowadzących do skurczu. W komórkach beta trzustki powodują wydzielanie insuliny . Potencjały czynnościowe w neuronach są również znane jako „ impulsy nerwowe ” lub „ kolce ”, a sekwencja czasowa potencjałów czynnościowych generowanych przez neuron nazywana jest „ ciągiem impulsów ”. Często mówi się, że neuron, który emituje potencjał czynnościowy lub impuls nerwowy, „odpala”.
Potencjały czynnościowe są generowane przez specjalne typy kanałów jonowych bramkowanych napięciem, osadzonych w błonie plazmatycznej komórki . Kanały te są zamykane, gdy potencjał błony zbliża się do (ujemnego) potencjału spoczynkowego komórki, ale szybko zaczynają się otwierać, jeśli potencjał błony wzrasta do dokładnie określonego napięcia progowego, depolaryzując potencjał transbłonowy. Kiedy kanały się otwierają, umożliwiają przepływ sodu do wewnątrz , co zmienia gradient elektrochemiczny, co z kolei powoduje dalszy wzrost potencjału błony do zera. To z kolei powoduje otwarcie większej liczby kanałów, wytwarzając większy prąd elektryczny przez błonę komórkową i tak dalej. Proces przebiega gwałtownie, dopóki wszystkie dostępne kanały jonowe nie zostaną otwarte, co powoduje duży wzrost potencjału błonowego. Szybki napływ jonów sodu powoduje odwrócenie polaryzacji błony plazmatycznej, a następnie kanały jonowe szybko się dezaktywują. Gdy kanały sodowe się zamykają, jony sodu nie mogą już dostać się do neuronu, a następnie są aktywnie transportowane z powrotem z błony plazmatycznej. Następnie aktywowane są kanały potasowe i następuje przepływ jonów potasu na zewnątrz, przywracając gradient elektrochemiczny do stanu spoczynku. Po wystąpieniu potencjału czynnościowego następuje przejściowe przesunięcie ujemne, zwane hiperpolaryzacją następczą .
W komórkach zwierzęcych istnieją dwa podstawowe rodzaje potencjałów czynnościowych. Jeden typ jest generowany przez kanały sodowe bramkowane napięciem , a drugi przez kanały wapniowe bramkowane napięciem . Potencjały czynnościowe oparte na sodzie zwykle trwają mniej niż jedną milisekundę, ale potencjały czynnościowe oparte na wapniu mogą trwać 100 milisekund lub dłużej. [ potrzebne źródło ] W niektórych typach neuronów powolne skoki wapnia zapewniają siłę napędową dla długiego wybuchu szybko emitowanych skoków sodu. Z drugiej strony, w komórkach mięśnia sercowego początkowy szybki skok sodu stanowi „primer” do sprowokowania szybkiego początku skoku wapnia, który następnie powoduje skurcz mięśni.
Przegląd
Prawie wszystkie błony komórkowe zwierząt, roślin i grzybów utrzymują różnicę napięcia między zewnętrzną i wewnętrzną częścią komórki, zwaną potencjałem błonowym . Typowe napięcie na błonie komórki zwierzęcej wynosi −70 mV. Oznacza to, że wnętrze ogniwa ma ujemne napięcie w stosunku do otoczenia. W większości typów komórek potencjał błonowy zwykle pozostaje dość stały. Niektóre typy ogniw są jednak elektrycznie aktywne w tym sensie, że ich napięcie zmienia się w czasie. W niektórych typach komórek aktywnych elektrycznie, w tym w neuronach i komórkach mięśniowych, wahania napięcia często przybierają postać gwałtownego skoku w górę (dodatniego), po którym następuje gwałtowny spadek. Te cykle w górę iw dół są znane jako potencjały czynnościowe . W niektórych typach neuronów cały cykl w górę iw dół odbywa się w ciągu kilku tysięcznych sekundy. W komórkach mięśniowych typowy potencjał czynnościowy trwa około jednej piątej sekundy. W komórkach roślinnych potencjał czynnościowy może trwać trzy sekundy lub dłużej.
Właściwości elektryczne komórki są określone przez strukturę jej błony. Błona komórkowa składa się z dwuwarstwy lipidowej cząsteczek, w których osadzone są większe cząsteczki białka. Dwuwarstwa lipidowa jest wysoce odporna na ruch jonów naładowanych elektrycznie, dzięki czemu pełni funkcję izolatora. Natomiast duże białka osadzone w błonie zapewniają kanały, przez które jony mogą przechodzić przez błonę. Potencjały czynnościowe są napędzane przez białka kanałowe, których konfiguracja przełącza się między stanem zamkniętym i otwartym w zależności od różnicy napięcia między wnętrzem a zewnętrzem komórki. Te wrażliwe na napięcie białka są znane jako kanały jonowe bramkowane napięciem .
Proces w typowym neuronie

Wszystkie komórki w tkankach zwierzęcych są spolaryzowane elektrycznie – innymi słowy, utrzymują różnicę napięcia w błonie plazmatycznej komórki , znaną jako potencjał błonowy . Ta polaryzacja elektryczna wynika ze złożonej interakcji między strukturami białkowymi osadzonymi w błonie, zwanymi pompami jonowymi i kanałami jonowymi . W neuronach typy kanałów jonowych w błonie zwykle różnią się w różnych częściach komórki, nadając dendrytom , aksonom i ciału komórki różne właściwości elektryczne. W rezultacie niektóre części błony neuronu mogą być pobudliwe (zdolne do generowania potencjałów czynnościowych), podczas gdy inne nie. Ostatnie badania wykazały, że najbardziej pobudliwą częścią neuronu jest część za wzgórkiem aksonu (miejscem, w którym akson opuszcza ciało komórki), nazywana początkowym segmentem aksonu , ale akson i ciało komórki są również pobudliwe w większości przypadków. sprawy.
Każdy pobudliwy fragment błony ma dwa ważne poziomy potencjału błony: potencjał spoczynkowy , czyli wartość, którą potencjał błony utrzymuje tak długo, jak nic nie zaburza komórki, oraz wyższą wartość, zwaną potencjałem progowym . We wzgórku aksonu typowego neuronu potencjał spoczynkowy wynosi około –70 miliwoltów (mV), a potencjał progowy około –55 mV. depolaryzację lub hiperpolaryzację błony ; to znaczy powodują wzrost lub spadek potencjału błony. Potencjały czynnościowe są wyzwalane, gdy zgromadzi się wystarczająca ilość depolaryzacji, aby doprowadzić potencjał błony do wartości progowej. Kiedy potencjał czynnościowy jest wyzwalany, potencjał błonowy gwałtownie wystrzeliwuje w górę, a następnie równie gwałtownie wystrzeliwuje z powrotem w dół, często kończąc się poniżej poziomu spoczynkowego, gdzie pozostaje przez pewien czas. Kształt potencjału czynnościowego jest stereotypowy; oznacza to, że wzrost i spadek mają zwykle w przybliżeniu taką samą amplitudę i przebieg czasowy dla wszystkich potencjałów czynnościowych w danej komórce. (Wyjątki omówiono w dalszej części artykułu). W większości neuronów cały proces trwa około jednej tysięcznej sekundy. Wiele typów neuronów stale emituje potencjały czynnościowe z szybkością do 10–100 na sekundę. Jednak niektóre typy są znacznie cichsze i mogą trwać kilka minut lub dłużej bez emitowania jakichkolwiek potencjałów czynnościowych.
Podstawa biofizyczna
Potencjały czynnościowe wynikają z obecności w błonie komórkowej specjalnych typów kanałów jonowych bramkowanych napięciem . Kanał jonowy bramkowany napięciem to białko transbłonowe, które ma trzy kluczowe właściwości:
- Jest w stanie przyjąć więcej niż jedną konformację.
- Przynajmniej jedna z konformacji tworzy kanał przez membranę, który jest przepuszczalny dla określonych rodzajów jonów.
- Na przejście między konformacjami ma wpływ potencjał błonowy.
Zatem kanał jonowy bramkowany napięciem jest zwykle otwarty dla niektórych wartości potencjału błony i zamknięty dla innych. Jednak w większości przypadków związek między potencjałem błony a stanem kanału jest probabilistyczny i obejmuje opóźnienie czasowe. Kanały jonowe przełączają się między konformacjami w nieprzewidywalnych czasach: Potencjał błony określa szybkość przejść i prawdopodobieństwo na jednostkę czasu każdego rodzaju przejścia.
Kanały jonowe bramkowane napięciem są zdolne do wytwarzania potencjałów czynnościowych, ponieważ mogą powodować dodatnie pętle sprzężenia zwrotnego: potencjał błony kontroluje stan kanałów jonowych, ale stan kanałów jonowych kontroluje potencjał błony. Zatem w niektórych sytuacjach wzrost potencjału błonowego może spowodować otwarcie kanałów jonowych, powodując w ten sposób dalszy wzrost potencjału błonowego. Potencjał czynnościowy występuje, gdy ten pozytywny cykl sprzężenia zwrotnego ( cykl Hodgkina ) przebiega gwałtownie. Czas i trajektoria amplitudy potencjału czynnościowego są określone przez właściwości biofizyczne bramkowanych napięciem kanałów jonowych, które go wytwarzają. Istnieje kilka rodzajów kanałów zdolnych do wytworzenia pozytywnego sprzężenia zwrotnego niezbędnego do wygenerowania potencjału czynnościowego. Kanały sodowe bramkowane napięciem są odpowiedzialne za szybkie potencjały czynnościowe zaangażowane w przewodnictwo nerwowe. Wolniejsze potencjały czynnościowe w komórkach mięśniowych i niektórych typach neuronów są generowane przez kanały wapniowe bramkowane napięciem. Każdy z tych typów występuje w wielu wariantach, o różnej wrażliwości na napięcie i różnej dynamice czasowej.
Najintensywniej badanym rodzajem zależnych od napięcia kanałów jonowych są kanały sodowe biorące udział w szybkim przewodnictwie nerwowym. Są one czasami znane jako kanały sodowe Hodgkina-Huxleya, ponieważ zostały po raz pierwszy scharakteryzowane przez Alana Hodgkina i Andrew Huxleya w ich nagrodzonych Nagrodą Nobla badaniach biofizyki potencjału czynnościowego, ale wygodniej można je nazwać kanałami Na V. („V” oznacza „napięcie”.) Kanał Na V ma trzy możliwe stany, znane jako dezaktywowany , aktywowany i nieaktywny . Kanał jest przepuszczalny tylko dla jonów sodu, gdy jest w aktywnym . Gdy potencjał błony jest niski, kanał spędza większość czasu w dezaktywowanym (zamkniętym). Jeśli potencjał błony zostanie podniesiony powyżej pewnego poziomu, kanał wykazuje zwiększone prawdopodobieństwo przejścia do aktywnego (otwartego). Im wyższy potencjał błony, tym większe prawdopodobieństwo aktywacji. Gdy kanał zostanie aktywowany, ostatecznie przejdzie do nieaktywnego (zamkniętego). Ma tendencję do pozostawania nieaktywnym przez pewien czas, ale jeśli potencjał błony ponownie spadnie, kanał ostatecznie przejdzie z powrotem do stanu dezaktywowanego . Podczas potencjału czynnościowego większość kanałów tego typu przechodzi cykl dezaktywowany → aktywowany → nieaktywny → dezaktywowany . Jest to jednak tylko średnie zachowanie populacji – pojedynczy kanał może w zasadzie dokonać dowolnej zmiany w dowolnym momencie. Jednak prawdopodobieństwo przejścia kanału ze nieaktywnego bezpośrednio do stanu aktywnego jest bardzo niskie: kanał w stanie nieaktywnym jest refrakcyjny, dopóki nie przejdzie z powrotem do stanu dezaktywowanego .
Rezultatem tego wszystkiego jest to, że kinetyka kanałów Na V jest regulowana przez macierz przejść, której szybkości są zależne od napięcia w skomplikowany sposób. Ponieważ same te kanały odgrywają główną rolę w określaniu napięcia, obliczenie globalnej dynamiki systemu może być dość trudne. Hodgkin i Huxley podeszli do problemu, opracowując zestaw równań różniczkowych dla parametrów rządzących stanami kanałów jonowych, znanych jako równania Hodgkina-Huxleya . Równania te zostały szeroko zmodyfikowane w późniejszych badaniach, ale stanowią punkt wyjścia dla większości teoretycznych badań biofizyki potencjału czynnościowego.
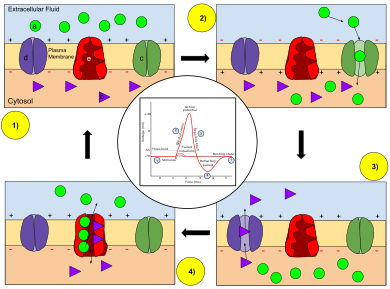
Ruch jonów podczas potencjału czynnościowego. Legenda: a) Jon sodu (Na + ). b) Jon potasu (K + ). c) kanał sodowy. d) kanał potasowy. e) Pompa sodowo-potasowa. W etapach potencjału czynnościowego zmienia się przepuszczalność błony neuronu. W stanie spoczynku (1) jony sodu i potasu mają ograniczoną zdolność przechodzenia przez błonę, a neuron ma wewnątrz ładunek ujemny netto. Po wyzwoleniu potencjału czynnościowego depolaryzacja ( 2) neuronu aktywuje kanały sodowe, umożliwiając jonom sodu przejście przez błonę komórkową do komórki, co skutkuje dodatnim ładunkiem netto w neuronie w stosunku do płynu pozakomórkowego. Po osiągnięciu szczytowego potencjału czynnościowego neuron rozpoczyna repolaryzację (3), w której kanały sodowe zamykają się, a kanały potasowe otwierają, umożliwiając jonom potasu przejście przez błonę do płynu pozakomórkowego, przywracając potencjał błony do wartości ujemnej. Na koniec następuje okres refrakcji (4), podczas którego zależne od napięcia kanały jonowe są dezaktywowane , podczas gdy jony Na + i K + wracają do rozkładu stanu spoczynku na błonie (1), a neuron jest gotowy do powtórzenia proces dla następnego potencjału czynnościowego.
Gdy potencjał błony wzrasta, kanały jonowe sodu otwierają się, umożliwiając wejście jonów sodu do komórki. Po tym następuje otwarcie kanałów jonowych potasu , które umożliwiają wyjście jonów potasu z komórki. Napływ jonów sodu do wewnątrz zwiększa stężenie dodatnio naładowanych kationów w komórce i powoduje depolaryzację, w której potencjał komórki jest wyższy niż potencjał spoczynkowy komórki . Kanały sodowe zamykają się na szczycie potencjału czynnościowego, podczas gdy potas nadal opuszcza komórkę. Wypływ jonów potasu zmniejsza potencjał błonowy lub hiperpolaryzuje komórkę. Przy niewielkim wzroście napięcia od spoczynku prąd potasu przewyższa prąd sodowy i napięcie powraca do normalnej wartości spoczynkowej, zwykle -70 mV. Jeśli jednak napięcie wzrośnie powyżej krytycznego progu, zazwyczaj o 15 mV powyżej wartości spoczynkowej, dominuje prąd sodowy. Powoduje to niekontrolowany stan, w którym dodatnie sprzężenie zwrotne z prądu sodowego aktywuje jeszcze więcej kanałów sodowych. W ten sposób komórka odpala , wytwarzając potencjał czynnościowy. Częstotliwość, z jaką neuron wywołuje potencjały czynnościowe, jest często określana jako szybkość odpalania lub szybkość odpalania neuronów .
Prądy wytwarzane przez otwieranie kanałów bramkowanych napięciem w przebiegu potencjału czynnościowego są zwykle znacznie większe niż początkowy prąd stymulujący. Zatem amplituda, czas trwania i kształt potencjału czynnościowego są w dużej mierze zdeterminowane właściwościami błony pobudliwej, a nie amplitudą lub czasem trwania bodźca. Ta właściwość potencjału czynnościowego typu „wszystko albo nic” odróżnia go od stopniowanych potencjałów , takich jak potencjały receptora , potencjały elektrotoniczne , podprogowe oscylacje potencjału błonowego i potencjały synaptyczne , które skalują się wraz z wielkością bodźca. W wielu typach komórek i przedziałach komórek istnieją różne typy potencjałów czynnościowych, określone przez typy kanałów bramkowanych napięciem, kanały przeciekowe , rozkłady kanałów, stężenia jonów, pojemność membrany, temperaturę i inne czynniki.
Głównymi jonami zaangażowanymi w potencjał czynnościowy są kationy sodu i potasu; jony sodu wchodzą do komórki, a jony potasu opuszczają, przywracając równowagę. Stosunkowo niewiele jonów musi przejść przez membranę, aby napięcie membrany zmieniło się drastycznie. Jony wymieniane podczas potencjału czynnościowego powodują zatem pomijalną zmianę wewnętrznego i zewnętrznego stężenia jonów. Nieliczne jony, które krzyżują się, są ponownie wypompowywane przez ciągłe działanie pompy sodowo-potasowej , która wraz z innymi transporterami jonów utrzymuje normalny stosunek stężeń jonów w poprzek błony. Kationy wapnia i aniony chlorkowe biorą udział w kilku typach potencjałów czynnościowych, takich jak odpowiednio potencjał czynnościowy serca i potencjał czynnościowy w jednokomórkowych algach Acetabularia .
Chociaż potencjały czynnościowe są generowane lokalnie na skrawkach pobudliwej błony, powstałe prądy mogą wyzwalać potencjały czynnościowe na sąsiednich odcinkach błony, przyspieszając propagację przypominającą domino. W przeciwieństwie do biernego rozprzestrzeniania się potencjałów elektrycznych ( potencjał elektrotoniczny ), potencjały czynnościowe są generowane na nowo wzdłuż pobudliwych odcinków błony i rozchodzą się bez zaniku. Mielinizowane odcinki aksonów nie są pobudliwe i nie wytwarzają potencjałów czynnościowych, a sygnał jest propagowany biernie jako potencjał elektrotoniczny . Regularnie rozmieszczone niemielinizowane łaty, zwane węzłami Ranviera , generują potencjały czynnościowe w celu wzmocnienia sygnału. Ten rodzaj propagacji sygnału, znany jako przewodzenie solne , zapewnia korzystny kompromis między prędkością sygnału a średnicą aksonu. Depolaryzacja zakończeń aksonów na ogół wyzwala uwalnianie neuroprzekaźnika do szczeliny synaptycznej . Ponadto w dendrytach neuronów piramidalnych , które są wszechobecne w korze nowej, zarejestrowano wstecznie propagujące się potencjały czynnościowe . Uważa się, że odgrywają one rolę w plastyczności zależnej od czasu skoku .
W modelu pojemności membranowej Hodgkina-Huxleya prędkość transmisji potencjału czynnościowego była niezdefiniowana i założono, że sąsiednie obszary uległy depolaryzacji w wyniku interferencji uwolnionych jonów z sąsiednimi kanałami. Pomiary dyfuzji jonów i promieni wykazały od tego czasu, że nie jest to możliwe. [ potrzebne źródło ] Co więcej, sprzeczne pomiary zmian entropii i synchronizacji zakwestionowały model pojemnościowy jako działający samodzielnie. [ Potrzebne źródło ] Alternatywnie, hipoteza adsorpcji Gilberta Linga zakłada, że potencjał błonowy i potencjał czynnościowy żywej komórki wynika z adsorpcji ruchomych jonów w miejscach adsorpcji komórek.
Dojrzewanie właściwości elektrycznych potencjału czynnościowego
neuronu do generowania i propagowania potencjału czynnościowego zmienia się w trakcie rozwoju . To, jak bardzo potencjał błonowy neuronu w wyniku impulsu prądowego, jest funkcją rezystancji wejściowej błony . W miarę wzrostu komórki do membrany dodawanych jest więcej kanałów , co powoduje spadek rezystancji wejściowej. Dojrzały neuron podlega również krótszym zmianom potencjału błonowego w odpowiedzi na prądy synaptyczne. bocznego jądra kolankowatego fretki mają dłuższą stałą czasową i większe odchylenie napięcia w P0 niż w P30. Jedną z konsekwencji malejącego czasu trwania potencjału czynnościowego jest to, że wierność sygnału może zostać zachowana w odpowiedzi na stymulację o wysokiej częstotliwości. Niedojrzałe neurony są bardziej podatne na depresję synaptyczną niż wzmocnienie po stymulacji o wysokiej częstotliwości.
We wczesnym rozwoju wielu organizmów potencjał czynnościowy jest początkowo przenoszony przez prąd wapniowy , a nie przez prąd sodowy . Kinetyka otwierania i zamykania kanałów wapniowych podczas rozwoju jest wolniejsza niż kinetyka bramkowanych napięciem kanałów sodowych, które przenoszą potencjał czynnościowy w dojrzałych neuronach. Dłuższe czasy otwarcia kanałów wapniowych mogą prowadzić do potencjałów czynnościowych, które są znacznie wolniejsze niż w przypadku dojrzałych neuronów. Xenopus początkowo mają potencjały czynnościowe, które trwają 60–90 ms. Podczas rozwoju czas ten zmniejsza się do 1 ms. Są dwa powody tego drastycznego spadku. Po pierwsze, prąd skierowany do wewnątrz jest przenoszony głównie przez kanały sodowe. Po drugie, opóźniony prostownik , prąd kanału potasowego , wzrasta do 3,5-krotności swojej początkowej siły.
Aby przejście od potencjału czynnościowego zależnego od wapnia do potencjału czynnościowego zależnego od sodu mogło przebiegać, do błony muszą zostać dodane nowe kanały. Jeśli neurony Xenopus są hodowane w środowisku z syntezy RNA lub syntezy białek , zapobiega się temu przejściu. Nawet aktywność elektryczna samej komórki może odgrywać rolę w ekspresji kanału. Jeśli potencjały czynnościowe w miocytach Xenopus są zablokowane, zapobiega się lub opóźnia typowy wzrost gęstości prądu sodu i potasu.
To dojrzewanie właściwości elektrycznych obserwuje się u różnych gatunków. Prądy sodowe i potasowe Xenopus drastycznie wzrastają po przejściu neuronu przez końcową fazę mitozy . Gęstość prądu sodowego neuronów korowych szczura wzrasta o 600% w ciągu pierwszych dwóch tygodni po urodzeniu.
Neurotransmisja
Anatomia neuronu
| Neuron |
|---|
Potencjał czynnościowy wspiera kilka typów komórek, takich jak komórki roślinne, komórki mięśniowe i wyspecjalizowane komórki serca (w których występuje potencjał czynnościowy serca ) . Jednak główną komórką pobudliwą jest neuron , który ma również najprostszy mechanizm potencjału czynnościowego.
Neurony są komórkami pobudliwymi elektrycznie, składającymi się na ogół z jednego lub więcej dendrytów, pojedynczej somy , pojedynczego aksonu i jednego lub więcej zakończeń aksonu . Dendryty to wypustki komórkowe, których podstawową funkcją jest odbieranie sygnałów synaptycznych. Ich wypustki, zwane kolcami dendrytycznymi , mają za zadanie wychwytywać neuroprzekaźniki uwalniane przez neuron presynaptyczny. Mają wysokie stężenie kanałów jonowych bramkowanych ligandem . Te kolce mają cienką szyjkę łączącą bulwiasty występ z dendrytem. Gwarantuje to, że zmiany zachodzące wewnątrz kręgosłupa z mniejszym prawdopodobieństwem wpłyną na sąsiednie kolce. Kolce dendrytyczne mogą, z rzadkimi wyjątkami (patrz LTP ), działać jako niezależna jednostka. Dendryty rozciągają się od somy, w której znajduje się jądro i wiele „normalnych” organelli eukariotycznych . W przeciwieństwie do kolców, powierzchnia somy jest wypełniona kanałami jonowymi aktywowanymi napięciem. Kanały te pomagają przesyłać sygnały generowane przez dendryty. Z somy wyłania się wzgórek aksonu . Region ten charakteryzuje się bardzo wysokim stężeniem kanałów sodowych aktywowanych napięciem. Ogólnie uważa się, że jest to strefa inicjacji impulsu dla potencjałów czynnościowych, tj. strefa wyzwalania . Wiele sygnałów generowanych w kolcach i przesyłanych przez somę zbiega się tutaj. Bezpośrednio za wzgórkiem aksonu znajduje się akson. Jest to cienka cylindryczna wypukłość oddalająca się od somy. Akson jest izolowany mielinową . Mielina składa się z komórek Schwanna (w obwodowym układzie nerwowym) lub oligodendrocytów (w ośrodkowym układzie nerwowym), z których oba są typami komórek glejowych . Chociaż komórki glejowe nie są zaangażowane w przekazywanie sygnałów elektrycznych, komunikują się i zapewniają neuronom ważne wsparcie biochemiczne. Mówiąc dokładniej, mielina wielokrotnie owija się wokół segmentu aksonu, tworząc grubą warstwę tłuszczową, która zapobiega przedostawaniu się jonów do aksonu lub ucieczce z niego. Izolacja ta zapobiega znacznemu zanikowi sygnału, jak również zapewnia większą prędkość sygnału. Ta izolacja ma jednak to ograniczenie, że na powierzchni aksonu nie mogą znajdować się żadne kanały. Występują więc regularnie rozmieszczone płaty membrany, które nie posiadają izolacji. Te węzły Ranviera można uznać za „mini pagórki aksonów”, ponieważ ich celem jest wzmocnienie sygnału, aby zapobiec znacznemu zanikowi sygnału. Na najdalszym końcu akson traci swoją izolację i zaczyna rozgałęziać się na kilka zakończeń aksonu . Te zakończenia presynaptyczne lub butony synaptyczne są wyspecjalizowanym obszarem w obrębie aksonu komórki presynaptycznej, który zawiera neuroprzekaźniki zamknięte w małych sferach związanych z błoną, zwanych pęcherzykami synaptycznymi .
Inicjacja
Przed rozważeniem propagacji potencjałów czynnościowych wzdłuż aksonów i ich zakończenia na gałkach synaptycznych, warto rozważyć metody, za pomocą których potencjały czynnościowe mogą zostać zainicjowane we wzgórku aksonu . Podstawowym wymaganiem jest podniesienie napięcia membrany na pagórku powyżej progu odpalenia. Istnieje kilka sposobów, w jakie może wystąpić ta depolaryzacja.

Dynamika
Potencjały czynnościowe są najczęściej inicjowane przez pobudzające potencjały postsynaptyczne z neuronu presynaptycznego. Zazwyczaj neuroprzekaźnika są uwalniane przez neuron presynaptyczny . Te neuroprzekaźniki następnie wiążą się z receptorami na komórce postsynaptycznej. To wiązanie otwiera różne typy kanałów jonowych . To otwarcie ma dalszy wpływ na zmianę lokalnej przepuszczalności błony komórkowej , a tym samym potencjału błony. Jeśli wiązanie zwiększa napięcie (depolaryzuje błonę), synapsa jest pobudzająca. Jeśli jednak wiązanie obniża napięcie (hiperpolaryzuje membranę), ma charakter hamujący. Niezależnie od tego, czy napięcie jest zwiększane, czy zmniejszane, zmiana rozprzestrzenia się pasywnie do pobliskich obszarów membrany (zgodnie z opisem równania kabla i jego udoskonaleń). Zazwyczaj bodziec napięciowy zanika wykładniczo wraz z odległością od synapsy i czasem od związania neuroprzekaźnika. Pewna część napięcia pobudzającego może dotrzeć do wzgórka aksonu i może (w rzadkich przypadkach) zdepolaryzować błonę na tyle, aby wywołać nowy potencjał czynnościowy. Bardziej typowo, potencjały pobudzające z kilku synaps muszą działać razem prawie w tym samym czasie , aby wywołać nowy potencjał czynnościowy. Ich wspólne wysiłki mogą jednak zostać udaremnione przez przeciwdziałanie hamującym potencjałom postsynaptycznym .
Neuroprzekaźnictwo może również zachodzić przez synapsy elektryczne . Ze względu na bezpośrednie połączenie między pobudliwymi komórkami w postaci połączeń szczelinowych , potencjał czynnościowy może być przesyłany bezpośrednio z jednej komórki do drugiej w dowolnym kierunku. Swobodny przepływ jonów między komórkami umożliwia szybką transmisję bez pośrednictwa chemicznego. Kanały prostownicze zapewniają, że potencjały czynnościowe poruszają się tylko w jednym kierunku przez synapsę elektryczną. [ potrzebne źródło ] Synapsy elektryczne znajdują się we wszystkich układach nerwowych, w tym w ludzkim mózgu, chociaż stanowią one wyraźną mniejszość.
Zasada „wszystko albo nic”.
że amplituda potencjału czynnościowego jest niezależna od ilości prądu, który go wytworzył. Innymi słowy, większe prądy nie tworzą większych potencjałów czynnościowych. Dlatego mówi się, że potencjały czynnościowe są typu „wszystko albo nic” , ponieważ albo występują w pełni, albo nie występują wcale. Kontrastuje to z potencjałami receptorów , których amplitudy zależą od intensywności bodźca. W obu przypadkach częstotliwość potencjałów czynnościowych jest skorelowana z intensywnością bodźca.
Pomimo klasycznego poglądu na potencjał czynnościowy jako stereotypowy, jednolity sygnał, który dominował w dziedzinie neuronauki przez wiele dziesięcioleci, nowsze dowody sugerują, że potencjały czynnościowe są bardziej złożonymi zdarzeniami, które rzeczywiście mogą przekazywać informacje nie tylko poprzez swoją amplitudę, ale także czas trwania i fazę, czasami nawet do odległości, które pierwotnie nie były uważane za możliwe.
Neurony czuciowe
W neuronach czuciowych sygnał zewnętrzny, taki jak ciśnienie, temperatura, światło lub dźwięk, jest sprzężony z otwieraniem i zamykaniem kanałów jonowych , co z kolei zmienia przepuszczalność jonową błony i jej napięcie. Te zmiany napięcia mogą ponownie być pobudzające (depolaryzujące) lub hamujące (hiperpolaryzujące), aw niektórych neuronach czuciowych ich połączone efekty mogą depolaryzować wzgórek aksonu na tyle, aby wywołać potencjały czynnościowe. Niektóre przykłady u ludzi obejmują neuron receptora węchowego i ciałko Meissnera , które są kluczowe odpowiednio dla zmysłu węchu i dotyku . Jednak nie wszystkie neurony czuciowe przekształcają swoje sygnały zewnętrzne w potencjały czynnościowe; niektóre nie mają nawet aksonu. Zamiast tego mogą przekształcić sygnał w uwolnienie neuroprzekaźnika lub w ciągłe stopniowane potencjały , z których każdy może stymulować kolejne neurony do wyzwalania potencjału czynnościowego. Na przykład w ludzkim uchu komórki rzęsate przekształcają dochodzący dźwięk w otwieranie i zamykanie mechanicznie bramkowanych kanałów jonowych , co może powodować uwalnianie cząsteczek neuroprzekaźników . W podobny sposób w siatkówce człowieka początkowe komórki fotoreceptorowe i następna warstwa komórek (składająca się z komórek dwubiegunowych i komórek poziomych ) nie wytwarzają potencjałów czynnościowych; tylko niektóre komórki amakrynowe i trzecia warstwa, komórki zwojowe , wytwarzają potencjały czynnościowe, które następnie przemieszczają się w górę nerwu wzrokowego .
Potencjały stymulatora
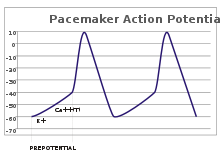
W neuronach czuciowych potencjały czynnościowe wynikają z zewnętrznego bodźca. Jednak niektóre pobudliwe komórki nie wymagają takiego bodźca do wystrzelenia: spontanicznie depolaryzują wzgórek aksonu i potencjały czynnościowe odpalają w regularnym tempie, jak wewnętrzny zegar. Ślady napięcia takich komórek są znane jako potencjały stymulatora . Dobrym przykładem są komórki stymulatora serca węzła zatokowo-przedsionkowego w sercu . Chociaż takie potencjały stymulatora mają naturalny rytm , można go regulować za pomocą bodźców zewnętrznych; na przykład częstość akcji serca może być zmieniana przez środki farmaceutyczne, a także sygnały z nerwów współczulnych i przywspółczulnych . Zewnętrzne bodźce nie powodują powtarzalnego odpalania komórki, a jedynie zmieniają jej synchronizację. W niektórych przypadkach regulacja częstotliwości może być bardziej złożona, prowadząc do wzorców potencjałów czynnościowych, takich jak pękanie .
Fazy
Przebieg potencjału czynnościowego można podzielić na pięć części: fazę narastania, fazę szczytu, fazę opadania, fazę podskoku i okres refrakcji. W fazie wzrostu potencjał błonowy ulega depolaryzacji (staje się bardziej dodatni). Punkt, w którym depolaryzacja , nazywany jest fazą szczytową. Na tym etapie potencjał błonowy osiąga maksimum. Po tym następuje faza upadku. Na tym etapie potencjał błony staje się bardziej ujemny, powracając do potencjału spoczynkowego. Faza niedoskoku lub po hiperpolaryzacji to okres, w którym potencjał błony chwilowo staje się bardziej naładowany ujemnie niż w spoczynku (hiperpolaryzacja). Wreszcie czas, w którym kolejny potencjał czynnościowy jest niemożliwy lub trudny do wystrzelenia, nazywany jest okresem refrakcji , który może nakładać się na inne fazy.
Przebieg potencjału czynnościowego jest określony przez dwa sprzężone efekty. Po pierwsze, czułe Vm na napięcie kanały jonowe otwierają się i zamykają w odpowiedzi na zmiany napięcia membrany . Zmienia to przepuszczalność membrany dla tych jonów. Vm , zgodnie z równaniem Goldmana , ta zmiana przepuszczalności zmienia potencjał równowagi E m , a tym samym napięcie membrany . Zatem potencjał błony wpływa na przepuszczalność, która z kolei wpływa na potencjał błony. Stwarza to możliwość pozytywnego sprzężenia zwrotnego , które jest kluczową częścią wznoszącej się fazy potencjału czynnościowego. Czynnikiem komplikującym jest to, że pojedynczy kanał jonowy może Vm mieć wiele wewnętrznych „bramek”, które reagują na zmiany w przeciwny sposób lub z różną szybkością. Na przykład, chociaż podniesienie V m otwiera większość bramek w wrażliwym na napięcie kanale sodowym, zamyka również „ bramkę dezaktywacji” kanału, choć wolniej. Stąd, gdy Vm . nagle wzrasta, kanały sodowe otwierają się początkowo, ale potem zamykają z powodu wolniejszej inaktywacji
Napięcia i prądy potencjału czynnościowego we wszystkich jego fazach zostały dokładnie modelowane przez Alana Lloyda Hodgkina i Andrew Huxleya w 1952 r., za co otrzymali oni Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 1963 r. Jednak ich model uwzględnia tylko dwa rodzaje kanałów jonowych wrażliwych na napięcie i przyjmuje kilka założeń na ich temat, np. że ich wewnętrzne bramki otwierają się i zamykają niezależnie od siebie. W rzeczywistości istnieje wiele rodzajów kanałów jonowych i nie zawsze otwierają się one i zamykają niezależnie.
Faza stymulacji i wzrostu
Typowy potencjał czynnościowy zaczyna się na Vm wzgórku aksonu przy wystarczająco silnej depolaryzacji, np. bodziec zwiększający . Ta depolaryzacja jest często spowodowana wstrzyknięciem dodatkowych kationów sodu do komórki; kationy te mogą pochodzić z wielu różnych źródeł, takich jak synapsy chemiczne , neurony czuciowe lub potencjały stymulatorów .
płynie zewnątrzkomórkowym występuje wysokie stężenie jonów sodu i chlorków w porównaniu z płynem wewnątrzkomórkowym , podczas gdy w płynie wewnątrzkomórkowym występuje wysokie stężenie jonów potasu w porównaniu z płynem zewnątrzkomórkowym. Różnica stężeń, która powoduje przemieszczanie się jonów z wysokiego do niskiego stężenia , oraz efekty elektrostatyczne (przyciąganie przeciwnych ładunków) są odpowiedzialne za ruch jonów do iz neuronu. Wnętrze neuronu ma ładunek ujemny, w stosunku do zewnętrznej części komórki, z ruchu K + na zewnątrz komórki. Błona neuronu jest bardziej przepuszczalna dla K + niż dla innych jonów, co pozwala temu jonowi na selektywne przemieszczanie się z komórki w dół gradientu stężeń. Ten gradient stężeń wraz z kanałami wycieku potasu obecnymi na błonie neuronu powoduje wypływ jonów potasu, powodując, że potencjał spoczynkowy jest bliski E K ≈ –75 mV. Ponieważ jony Na + znajdują się w wyższych stężeniach poza komórką, różnice w stężeniu i napięciu kierują je do komórki, gdy kanały Na + są otwarte. Depolaryzacja otwiera zarówno kanały sodowe, jak i potasowe w błonie, umożliwiając przepływ jonów odpowiednio do iz aksonu. Jeśli depolaryzacja jest niewielka (powiedzmy, zwiększając Vm . od -70 mV do -60 mV), zewnętrzny prąd potasowy przeważa nad wewnętrznym prądem sodowym, a membrana repolaryzuje się z powrotem do swojego normalnego potencjału spoczynkowego około -70 mV Jeśli jednak depolaryzacja jest wystarczająco duża, wewnętrzny prąd sodowy wzrasta bardziej niż zewnętrzny prąd potasowy i powstaje stan niekontrolowany ( dodatnie sprzężenie zwrotne ): im większy jest prąd wewnętrzny, tym bardziej wzrasta Vm . , co z kolei jeszcze bardziej zwiększa wewnętrzny prąd aktualny. Wystarczająco silna depolaryzacja (wzrost V m ) powoduje otwarcie wrażliwych na napięcie kanałów sodowych; rosnąca przepuszczalność dla sodu V m do napięcia równowagi sodu E Na ≈ +55 mV. Rosnące napięcie z kolei powoduje otwarcie jeszcze większej liczby kanałów sodowych, co popycha V m jeszcze dalej w kierunku E Na . To dodatnie Vm sprzężenie zwrotne trwa, dopóki kanały sodowe nie zostaną całkowicie otwarte, a zbliży się do E Na . Gwałtowny wzrost Vm rosnącej i przepuszczalności sodu odpowiada fazie potencjału czynnościowego.
Krytyczne napięcie progowe dla tego niekontrolowanego stanu wynosi zwykle około -45 mV, ale zależy to od niedawnej aktywności aksonu. Komórka, która właśnie wystrzeliła potencjał czynnościowy, nie może natychmiast wyzwolić kolejnego, ponieważ kanały Na + nie odzyskały stanu inaktywowanego. Okres, w którym żaden nowy potencjał czynnościowy nie może zostać wyzwolony, nazywany jest okresem refrakcji bezwzględnej . W dłuższych czasach, po odzyskaniu niektórych, ale nie wszystkich kanałów jonowych, akson może zostać pobudzony do wytworzenia innego potencjału czynnościowego, ale z wyższym progiem, wymagającym znacznie silniejszej depolaryzacji, np. do -30 mV. Okres, w którym potencjały czynnościowe są niezwykle trudne do wywołania, nazywany jest okresem refrakcji względnej .
Faza szczytowa
Pozytywne sprzężenie zwrotne fazy wznoszącej zwalnia i zatrzymuje się, gdy kanały jonowe sodu stają się maksymalnie otwarte. W szczycie potencjału czynnościowego przepuszczalność sodu jest maksymalna, a napięcie błony Vm jest prawie równe równowagowemu napięciu sodu E Na . Jednak to samo podwyższone napięcie, które początkowo otworzyło kanały sodowe, również powoli je zamyka, zamykając ich pory; kanały sodowe stają się nieaktywne . Obniża to przepuszczalność błony dla sodu w stosunku do potasu, co powoduje powrót napięcia błony do wartości spoczynkowej. Jednocześnie podwyższone napięcie otwiera wrażliwe na napięcie kanały potasowe; wzrost przepuszczalności błony przez potas kieruje Vm w K kierunku E . W połączeniu te zmiany przepuszczalności sodu i potasu powodują Vm , repolaryzację błony i wytwarzanie „fazy opadania” potencjału czynnościowego.
Po hiperpolaryzacji
Depolaryzowane napięcie otwiera dodatkowe zależne od napięcia kanały potasowe, a niektóre z nich nie zamykają się od razu, gdy membrana powraca do normalnego napięcia spoczynkowego. Ponadto w odpowiedzi na napływ jonów wapnia podczas potencjału czynnościowego otwierają się kolejne kanały potasowe . Wewnątrzkomórkowe stężenie jonów potasu jest przejściowo niezwykle niskie, co sprawia Vm , że napięcie błony jest jeszcze bliższe równowagowemu napięciu potasu EK . Potencjał błony spada poniżej spoczynkowego potencjału błony. W związku z tym występuje niedoskok lub hiperpolaryzacja , określana jako hiperpolaryzacja następcza , która utrzymuje się, dopóki przepuszczalność potasu przez błonę nie powróci do swojej zwykłej wartości, przywracając potencjał błony do stanu spoczynku.
Okres refrakcji
Po każdym potencjale czynnościowym następuje okres refrakcji , który można podzielić na okres refrakcji bezwzględnej , podczas którego nie można wywołać kolejnego potencjału czynnościowego, oraz okres refrakcji względnej , podczas którego wymagany jest bodziec silniejszy niż zwykle. Te dwa okresy refrakcji są spowodowane zmianami stanu cząsteczek kanałów sodowych i potasowych. Zamykając się po potencjale czynnościowym, kanały sodowe wchodzą w stan „nieaktywny” , w którym nie można ich otworzyć niezależnie od potencjału błonowego - powoduje to okres refrakcji bezwzględnej. Nawet po przejściu wystarczającej liczby kanałów sodowych z powrotem do stanu spoczynku, często zdarza się, że część kanałów potasowych pozostaje otwarta, co utrudnia depolaryzację potencjału błony, a tym samym powoduje powstanie względnego okresu refrakcji. Ponieważ gęstość i podtypy kanałów potasowych mogą się znacznie różnić między różnymi typami neuronów, czas trwania względnego okresu refrakcji jest bardzo zmienny.
Bezwzględny okres refrakcji jest w dużej mierze odpowiedzialny za jednokierunkową propagację potencjałów czynnościowych wzdłuż aksonów. W dowolnym momencie łatka aksonu za aktywnie wybijającą się częścią jest refrakcyjna, ale łatka z przodu, która nie była ostatnio aktywowana, może być stymulowana przez depolaryzację z potencjału czynnościowego.
Propagacja
Potencjał czynnościowy generowany na wzgórku aksonu rozchodzi się jako fala wzdłuż aksonu. Prądy płynące do wewnątrz w punkcie na aksonie podczas potencjału czynnościowego rozprzestrzeniają się wzdłuż aksonu i depolaryzują sąsiednie odcinki jego błony. Jeśli jest wystarczająco silna, ta depolaryzacja wywołuje podobny potencjał czynnościowy w sąsiednich łatach błony. Ten podstawowy mechanizm zademonstrował Alan Lloyd Hodgkin w 1937 roku. Po zmiażdżeniu lub schłodzeniu segmentów nerwowych i zablokowaniu w ten sposób potencjałów czynnościowych, wykazał, że potencjał czynnościowy docierający z jednej strony bloku może wywołać inny potencjał czynnościowy po drugiej, pod warunkiem, że zablokowany segment był wystarczająco krótki.
Gdy potencjał czynnościowy pojawi się w skrawku błony, plaster błony potrzebuje czasu na regenerację, zanim będzie mógł ponownie wystrzelić. Na poziomie molekularnym ten bezwzględny okres refrakcji odpowiada czasowi potrzebnemu kanałom sodowym aktywowanym napięciem na powrót do stanu inaktywacji, tj. powrót do stanu zamkniętego. Istnieje wiele rodzajów kanałów potasowych aktywowanych napięciem w neuronach. Niektóre z nich dezaktywują się szybko (prądy typu A), a inne powoli lub wcale; ta zmienność gwarantuje, że zawsze będzie dostępne źródło prądu do repolaryzacji, nawet jeśli niektóre kanały potasowe są inaktywowane z powodu poprzedzającej depolaryzacji. Z drugiej strony, wszystkie neuronalne kanały sodowe aktywowane napięciem dezaktywują się w ciągu kilku milisekund podczas silnej depolaryzacji, co uniemożliwia następną depolaryzację, dopóki znaczna część kanałów sodowych nie powróci do stanu zamkniętego. Chociaż ogranicza to częstotliwość strzelania, bezwzględny okres refrakcji zapewnia, że potencjał czynnościowy porusza się tylko w jednym kierunku wzdłuż aksonu. Prądy napływające z powodu potencjału czynnościowego rozchodzą się w obu kierunkach wzdłuż aksonu. Jednak tylko niewypalona część aksonu może odpowiedzieć potencjałem czynnościowym; część, która właśnie wystrzeliła, nie reaguje, dopóki potencjał czynnościowy nie znajdzie się bezpiecznie poza zasięgiem i nie może ponownie stymulować tej części. W zwykłym przewodnictwie ortodromicznym potencjał czynnościowy rozchodzi się od wzgórka aksonu w kierunku gałek synaptycznych (końców aksonu); propagacja w przeciwnym kierunku - znana jako przewodnictwo antydromowe - jest bardzo rzadka. Jeśli jednak laboratoryjny akson jest stymulowany w środku, obie połówki aksonu są „świeże”, tj. niewypalone; wtedy zostaną wygenerowane dwa potencjały czynnościowe, jeden wędrujący w kierunku wzgórka aksonu, a drugi w kierunku gałek synaptycznych.
Przewodnictwo mielinowe i solne

Aby umożliwić szybkie i sprawne przekazywanie sygnałów elektrycznych w układzie nerwowym, niektóre aksony neuronów są pokryte osłonkami mielinowymi . Mielina jest wielowarstwową błoną otaczającą akson segmentami oddzielonymi odstępami zwanymi węzłami Ranviera . Jest produkowany przez wyspecjalizowane komórki: komórki Schwanna wyłącznie w obwodowym układzie nerwowym oraz oligodendrocyty wyłącznie w ośrodkowym układzie nerwowym . Osłonka mielinowa zmniejsza pojemność błony i zwiększa opór błony w odstępach międzywęzłowych, umożliwiając w ten sposób szybki, solankowy ruch potencjałów czynnościowych od węzła do węzła. Mielinizacja występuje głównie u kręgowców , ale analogiczny system odkryto u kilku bezkręgowców, takich jak niektóre gatunki krewetek . Nie wszystkie neurony kręgowców są mielinizowane; na przykład aksony neuronów tworzących autonomiczny układ nerwowy na ogół nie są mielinizowane.
Mielina zapobiega przedostawaniu się jonów do lub opuszczaniu aksonu wzdłuż mielinowanych segmentów. Z reguły mielinizacja zwiększa szybkość przewodzenia potencjałów czynnościowych i czyni je bardziej energooszczędnymi. Niezależnie od tego, czy jest słony, czy nie, średnia prędkość przewodzenia potencjału czynnościowego waha się od 1 metra na sekundę (m / s) do ponad 100 m / s i generalnie rośnie wraz ze średnicą aksonów.
Potencjały czynnościowe nie mogą rozprzestrzeniać się przez błonę w mielinowanych odcinkach aksonu. Jednak prąd jest przenoszony przez cytoplazmę, co wystarcza do depolaryzacji pierwszego lub drugiego kolejnego węzła Ranviera . Zamiast tego prąd jonowy z potencjału czynnościowego w jednym węźle Ranviera wywołuje inny potencjał czynnościowy w następnym węźle; to pozorne „przeskakiwanie” potencjału czynnościowego z węzła do węzła jest znane jako przewodzenie solne . Chociaż mechanizm przewodzenia solnego został zasugerowany w 1925 roku przez Ralpha Lillie, pierwsze eksperymentalne dowody na przewodzenie solne pochodzą od Ichiji Tasaki i Taiji Takeuchi oraz od Andrew Huxleya i Roberta Stämpfliego. Z kolei w niemielinizowanych aksonach potencjał czynnościowy wywołuje inny w błonie bezpośrednio przylegającej i porusza się w sposób ciągły w dół aksonu jak fala.

Mielina ma dwie ważne zalety: dużą szybkość przewodzenia i efektywność energetyczną. W przypadku aksonów większych niż minimalna średnica (w przybliżeniu 1 mikrometr ), mielinizacja zwiększa prędkość przewodzenia potencjału czynnościowego, zazwyczaj dziesięciokrotnie. I odwrotnie, dla danej prędkości przewodzenia włókna mielinowe są mniejsze niż ich niezmielinizowane odpowiedniki. Na przykład potencjały czynnościowe poruszają się z mniej więcej taką samą prędkością (25 m / s) w mielinowanym aksonie żaby i niemielinizowanym aksonie olbrzymim kałamarnicy , ale akson żaby ma mniej więcej 30-krotnie mniejszą średnicę i 1000-krotnie mniejszy przekrój poprzeczny. . Ponadto, ponieważ prądy jonowe są ograniczone do węzłów Ranviera, znacznie mniej jonów „przecieka” przez błonę, oszczędzając energię metaboliczną. Oszczędność ta jest znaczącą zaletą selektywną , ponieważ ludzki układ nerwowy zużywa około 20% energii metabolicznej organizmu.
Długość mielinowanych segmentów aksonów jest ważna dla powodzenia przewodzenia solnego. Powinny być tak długie, jak to możliwe, aby zmaksymalizować prędkość przewodzenia, ale nie tak długie, aby docierający sygnał był zbyt słaby, aby wywołać potencjał czynnościowy w następnym węźle Ranviera. W naturze segmenty mielinowe są na ogół wystarczająco długie, aby pasywnie propagowany sygnał mógł podróżować przez co najmniej dwa węzły, zachowując jednocześnie wystarczającą amplitudę, aby wystrzelić potencjał czynnościowy w drugim lub trzecim węźle. Zatem współczynnik bezpieczeństwa przewodzenia solnego jest wysoki, umożliwiając transmisję do węzłów omijających w przypadku urazu. Jednak potencjały czynnościowe mogą kończyć się przedwcześnie w niektórych miejscach, w których współczynnik bezpieczeństwa jest niski, nawet w neuronach bez mieliny; typowym przykładem jest punkt rozgałęzienia aksonu, w którym dzieli się on na dwa aksony.
Niektóre choroby degradują mielinę i upośledzają przewodnictwo solne, zmniejszając prędkość przewodzenia potencjałów czynnościowych. Najbardziej znanym z nich jest stwardnienie rozsiane , w którym rozpad mieliny upośledza skoordynowany ruch.
Teoria kabli

Przepływ prądów w aksonie można opisać ilościowo za pomocą teorii kabli i jej rozwinięć, takich jak model przedziałowy. Teoria kabli została opracowana w 1855 roku przez Lorda Kelvina w celu modelowania transatlantyckiego kabla telegraficznego i okazała się istotna dla neuronów przez Hodgkina i Rushtona w 1946 roku. W prostej teorii kabli neuron jest traktowany jako elektrycznie pasywny, idealnie cylindryczny kabel transmisyjny, który można opisać równaniem różniczkowym cząstkowym
gdzie V ( x , t ) to napięcie na błonie w czasie t i pozycji x wzdłuż długości neuronu, a λ i τ to charakterystyczne skale długości i czasu, w których te napięcia zanikają w odpowiedzi na bodziec . Odnosząc się do schematu obwodu po prawej stronie, skale te można określić na podstawie rezystancji i pojemności na jednostkę długości.
Te skale czasu i długości można wykorzystać do zrozumienia zależności prędkości przewodzenia od średnicy neuronu we włóknach bezmielinowych. Na przykład skala czasu τ rośnie zarówno wraz z rezystancją membrany rm , cm jak i pojemnością . Wraz ze wzrostem pojemności więcej ładunku musi zostać przeniesione, aby wytworzyć dane napięcie przezbłonowe (zgodnie z równaniem Q = CV ); wraz ze wzrostem rezystancji mniej ładunku jest przenoszone w jednostce czasu, co powoduje wolniejsze równoważenie. W podobny sposób, jeśli opór wewnętrzny na jednostkę długości r i jest mniejszy w jednym aksonie niż w innym (np. ponieważ promień pierwszego jest większy), długość zaniku przestrzennego λ wydłuża się, a prędkość przewodzenia potencjału czynnościowego powinien wzrosnąć. Zwiększenie rezystancji transbłonowej r m obniża średni prąd „upływowy” przez membranę, powodując również wydłużenie λ , zwiększając prędkość przewodzenia.
Zakończenie
Synapsy chemiczne
Ogólnie rzecz biorąc, potencjały czynnościowe, które docierają do gałek synaptycznych, powodują uwolnienie neuroprzekaźnika do szczeliny synaptycznej. Neuroprzekaźniki to małe cząsteczki, które mogą otwierać kanały jonowe w komórce postsynaptycznej; większość aksonów ma ten sam neuroprzekaźnik na wszystkich końcach. Pojawienie się potencjału czynnościowego otwiera wrażliwe na napięcie kanały wapniowe w błonie presynaptycznej; napływ wapnia powoduje, że pęcherzyki wypełnione neuroprzekaźnikiem migrują na powierzchnię komórki i uwalniają swoją zawartość do szczeliny synaptycznej . Ten złożony proces jest hamowany przez neurotoksyny tetanospasminę i toksynę botulinową , które są odpowiedzialne odpowiednio za tężec i zatrucie jadem kiełbasianym .

Synapsy elektryczne
Niektóre synapsy rezygnują z „pośrednika” neuroprzekaźnika i łączą ze sobą komórki presynaptyczne i postsynaptyczne. Kiedy potencjał czynnościowy dociera do takiej synapsy, prądy jonowe wpływające do komórki presynaptycznej mogą przekroczyć barierę dwóch błon komórkowych i dostać się do komórki postsynaptycznej przez pory zwane koneksonami . Zatem prądy jonowe presynaptycznego potencjału czynnościowego mogą bezpośrednio stymulować komórkę postsynaptyczną. Synapsy elektryczne umożliwiają szybszą transmisję, ponieważ nie wymagają powolnej dyfuzji neuroprzekaźników przez szczelinę synaptyczną. Dlatego synapsy elektryczne są używane wszędzie tam, gdzie kluczowa jest szybka reakcja i koordynacja czasowa, na przykład w odruchach ucieczki , siatkówce kręgowców i sercu .
Połączenia nerwowo-mięśniowe
Szczególnym przypadkiem synapsy chemicznej jest złącze nerwowo-mięśniowe , w którym akson neuronu ruchowego kończy się na włóknie mięśniowym . W takich przypadkach uwalnianym neuroprzekaźnikiem jest acetylocholina , która wiąże się z receptorem acetylocholiny, integralnym białkiem błony komórkowej (sarcolemma ) włókna mięśniowego. Jednak acetylocholina nie pozostaje związana; raczej dysocjuje i jest hydrolizowany przez enzym, acetylocholinoesterazę , znajdujący się w synapsie. Enzym ten szybko redukuje bodziec dostarczany do mięśnia, co umożliwia delikatną regulację stopnia i czasu skurczu mięśnia. Niektóre trucizny inaktywują acetylocholinoesterazę, aby zapobiec tej kontroli, takie jak czynniki nerwowe sarin i tabun oraz insektycydy diazinon i malation .
Inne typy komórek
Potencjały czynnościowe serca

Potencjał czynnościowy serca różni się od potencjału czynnościowego neuronów tym, że ma wydłużone plateau, w którym membrana jest utrzymywana pod wysokim napięciem przez kilkaset milisekund przed jak zwykle repolaryzacją przez prąd potasowy. To plateau jest spowodowane wolniejszym wapniowych i utrzymywaniem napięcia błonowego w pobliżu ich potencjału równowagi, nawet po inaktywacji kanałów sodowych.
Potencjał czynnościowy serca odgrywa ważną rolę w koordynowaniu skurczów serca. Komórki serca węzła zatokowo-przedsionkowego zapewniają potencjał stymulatora , który synchronizuje pracę serca. Potencjały czynnościowe tych komórek rozchodzą się do i przez węzeł przedsionkowo-komorowy (węzeł AV), który normalnie jest jedyną drogą przewodzenia między przedsionkami a komorami . Potencjały czynnościowe z węzła AV przemieszczają się przez wiązkę Hisa , a stamtąd do włókien Purkinjego . I odwrotnie, anomalie w potencjale czynnościowym serca – czy to z powodu wrodzonej mutacji, czy urazu – mogą prowadzić do patologii u ludzi, zwłaszcza arytmii . Kilka leków przeciwarytmicznych działa na potencjał czynnościowy serca, takich jak chinidyna , lidokaina , beta-adrenolityki i werapamil .
Potencjały czynnościowe mięśni
Potencjał czynnościowy w normalnej komórce mięśnia szkieletowego jest podobny do potencjału czynnościowego w neuronach. Potencjały czynnościowe wynikają z depolaryzacji błony komórkowej (sarkolemmy ) , która otwiera wrażliwe na napięcie kanały sodowe; ulegają one inaktywacji, a membrana jest repolaryzowana przez zewnętrzny prąd jonów potasu. Potencjał spoczynkowy przed potencjałem czynnościowym wynosi zwykle -90 mV, nieco bardziej ujemny niż w przypadku typowych neuronów. Potencjał czynnościowy mięśnia trwa około 2–4 ms, okres refrakcji bezwzględnej wynosi około 1–3 ms, a prędkość przewodzenia wzdłuż mięśnia wynosi około 5 m/s. Potencjał czynnościowy uwalnia wapnia , które uwalniają tropomiozynę i umożliwiają skurcz mięśnia. Potencjały czynnościowe mięśni są wywoływane przez pojawienie się przedsynaptycznego potencjału czynnościowego neuronów w złączu nerwowo-mięśniowym , które jest częstym celem dla neurotoksyn .
Potencjały czynnościowe roślin
Komórki roślin i grzybów są również pobudliwe elektrycznie. Podstawowa różnica w stosunku do potencjałów czynnościowych zwierząt polega na tym, że depolaryzacja w komórkach roślinnych nie odbywa się przez pobieranie dodatnich jonów sodu, ale przez uwalnianie ujemnych chlorkowych . W 1906 roku JC Bose opublikował pierwsze pomiary potencjałów czynnościowych roślin, które wcześniej odkryli Burdon-Sanderson i Darwin. Wzrost cytoplazmatycznych jonów wapnia może być przyczyną uwalniania anionów do komórki. To sprawia, że wapń jest prekursorem ruchów jonów, takich jak napływ ujemnych jonów chlorkowych i wypływ dodatnich jonów potasu, co widać w liściach jęczmienia.
Początkowy napływ jonów wapnia powoduje również niewielką depolaryzację komórkową, powodując otwarcie kanałów jonowych bramkowanych napięciem i umożliwiając propagację pełnej depolaryzacji przez jony chlorkowe.
Niektóre rośliny (np. Dionaea muscipula ) wykorzystują kanały bramkowane sodem do sterowania ruchami i zasadniczo „liczenia”. Dionaea muscipula , znana również jako muchołówka, występuje na subtropikalnych terenach podmokłych w Północnej i Południowej Karolinie. Gdy gleba jest uboga w składniki odżywcze, pułapka na muchy opiera się na diecie owadów i zwierząt. Pomimo badań nad rośliną, brakuje zrozumienia molekularnych podstaw muchołówek i ogólnie roślin mięsożernych.
Jednak przeprowadzono wiele badań nad potencjałami czynnościowymi i ich wpływem na ruch i mechanizm zegarowy w pułapce na muchy Wenus. Zacznijmy od tego, że spoczynkowy potencjał błonowy muchołówki (-120mV) jest niższy niż w komórkach zwierzęcych (zwykle -90mV do -40mV). Niższy potencjał spoczynkowy ułatwia aktywację potencjału czynnościowego. Tak więc, gdy owad ląduje w pułapce rośliny, uruchamia podobny do włosów mechanoreceptor. Receptor ten następnie aktywuje potencjał czynnościowy, który trwa około 1,5 ms. Ostatecznie powoduje to wzrost dodatnich jonów wapnia w komórce, nieznacznie ją depolaryzując.
Jednak pułapka na muchy nie zamyka się po jednym spuście. Zamiast tego wymaga aktywacji 2 lub więcej włosów. Jeśli tylko jeden włos zostanie wyzwolony, aktywacja jest fałszywie dodatnia. Ponadto drugi włos musi zostać aktywowany w określonym przedziale czasu (0,75 s - 40 s), aby został zarejestrowany przy pierwszej aktywacji. W ten sposób zaczyna się gromadzenie wapnia i powoli spada od pierwszego spustu. Kiedy drugi potencjał czynnościowy zostanie wystrzelony w określonym przedziale czasu, osiąga próg wapnia, aby zdepolaryzować komórkę, zamykając pułapkę na ofierze w ciągu ułamka sekundy.
Wraz z późniejszym uwolnieniem dodatnich jonów potasu potencjał czynnościowy w roślinach wiąże się z osmotyczną utratą soli (KCl). Podczas gdy potencjał czynnościowy zwierząt jest osmotycznie obojętny, ponieważ równe ilości wchodzącego sodu i wychodzącego potasu znoszą się wzajemnie osmotycznie. Wydaje się, że interakcja relacji elektrycznych i osmotycznych w komórkach roślinnych wynika z osmotycznej funkcji pobudliwości elektrycznej u wspólnych jednokomórkowych przodków roślin i zwierząt w zmieniających się warunkach zasolenia. Co więcej, obecna funkcja szybkiej transmisji sygnału jest postrzegana jako nowsze osiągnięcie metazoan w bardziej stabilnym środowisku osmotycznym. Jest prawdopodobne, że znana funkcja sygnalizacyjna potencjałów czynnościowych w niektórych roślinach naczyniowych (np. Mimosa pudica ) powstała niezależnie od tej w komórkach pobudliwych metazoan.
W przeciwieństwie do fazy wzrostu i piku, faza opadania i następcza hiperpolaryzacja wydają się zależeć głównie od kationów, które nie są wapniem. Aby zainicjować repolaryzację, komórka wymaga ruchu potasu z komórki poprzez bierny transport na błonie. Różni się to od neuronów, ponieważ ruch potasu nie dominuje nad spadkiem potencjału błonowego; W rzeczywistości, aby w pełni repolaryzować, komórka roślinna potrzebuje energii w postaci ATP, aby pomóc w uwalnianiu wodoru z komórki – wykorzystując transporter powszechnie znany jako H+-ATPaza.
Rozmieszczenie taksonomiczne i zalety ewolucyjne
Potencjały czynnościowe występują w organizmach wielokomórkowych , w tym w roślinach , bezkręgowcach , takich jak owady , i kręgowcach, takich jak gady i ssaki . Gąbki wydają się być głównym typem wielokomórkowych eukariotów , które nie przenoszą potencjałów czynnościowych, chociaż niektóre badania sugerują, że organizmy te mają również formę sygnalizacji elektrycznej. Potencjał spoczynkowy, jak również wielkość i czas trwania potencjału czynnościowego, nie zmieniały się zbytnio wraz z ewolucją, chociaż prędkość przewodzenia zmienia się dramatycznie w zależności od średnicy aksonów i mielinizacji.
| Zwierzę | Typ komórki | Potencjał spoczynkowy (mV) | Wzrost AP (mV) | Czas trwania AP (ms) | Prędkość przewodzenia (m/s) |
|---|---|---|---|---|---|
| Kalmary ( Loligo ) | Gigantyczny akson | −60 | 120 | 0,75 | 35 |
| Dżdżownica ( Lumbricus ) | Mediana gigantycznego włókna | −70 | 100 | 1.0 | 30 |
| Karaluch ( Periplaneta ) | Gigantyczne włókno | −70 | 80–104 | 0,4 | 10 |
| Żaba ( Rana ) | Akson nerwu kulszowego | -60 do -80 | 110–130 | 1.0 | 7–30 |
| Kot ( Felis ) | Neuron ruchowy rdzenia kręgowego | -55 do -80 | 80–110 | 1–1,5 | 30–120 |
Biorąc pod uwagę jego zachowanie w trakcie ewolucji, potencjał czynnościowy wydaje się zapewniać ewolucyjne korzyści. Jedną z funkcji potencjałów czynnościowych jest szybka sygnalizacja dalekiego zasięgu w organizmie; prędkość przewodzenia może przekroczyć 110 m/s, co stanowi jedną trzecią prędkości dźwięku . Dla porównania, cząsteczka hormonu przenoszona we krwi porusza się w dużych tętnicach z prędkością około 8 m/s. Częścią tej funkcji jest ścisła koordynacja zdarzeń mechanicznych, takich jak skurcz serca. Druga funkcja to obliczenia związane z jej generowaniem. Będąc sygnałem typu „wszystko albo nic”, który nie zanika wraz z odległością transmisji, potencjał czynnościowy ma podobne zalety jak elektronika cyfrowa . Integracja różnych sygnałów dendrytycznych na wzgórku aksonu i ich progowanie w celu utworzenia złożonego ciągu potencjałów czynnościowych to kolejna forma obliczeń, która została wykorzystana biologicznie do utworzenia centralnych generatorów wzorców i naśladowana w sztucznych sieciach neuronowych .
Uważa się, że wspólny prokariotyczny/eukariotyczny przodek, który żył prawdopodobnie cztery miliardy lat temu, miał kanały bramkowane napięciem. Ta funkcja prawdopodobnie w pewnym późniejszym momencie miała krzyżowe cele, aby zapewnić mechanizm komunikacji. Nawet współczesne bakterie jednokomórkowe mogą wykorzystywać potencjały czynnościowe do komunikowania się z innymi bakteriami w tym samym biofilmie.
metody eksperymentalne

Badanie potencjałów czynnościowych wymagało opracowania nowych metod eksperymentalnych. Wstępne prace, przed 1955 r., prowadzili głównie Alan Lloyd Hodgkin i Andrew Fielding Huxley , którzy wraz z Johnem Carewem Ecclesem otrzymali w 1963 r. Nagrodę Nobla w dziedzinie fizjologii lub medycyny za wkład w opis jonowej podstawy nerwów. przewodzenie. Skoncentrowano się na trzech celach: wyizolowaniu sygnałów z pojedynczych neuronów lub aksonów, opracowaniu szybkiej, czułej elektroniki oraz zmniejszeniu elektrod na tyle, aby można było zarejestrować napięcie wewnątrz pojedynczej komórki.
Pierwszy problem został rozwiązany poprzez badanie olbrzymich aksonów znajdujących się w neuronach kałamarnicy ( Loligo forbesii i Doryteuthis pealeii , klasyfikowanych wówczas jako Loligo pealeii ). Te aksony mają tak dużą średnicę (około 1 mm, czyli 100 razy więcej niż typowy neuron), że można je zobaczyć gołym okiem, co ułatwia ich ekstrakcję i manipulację. Jednak nie są one reprezentatywne dla wszystkich komórek pobudliwych i zbadano wiele innych systemów z potencjałami czynnościowymi.
Drugi problem został rozwiązany dzięki kluczowemu opracowaniu zacisku napięcia , który umożliwił eksperymentatorom badanie prądów jonowych leżących u podstaw potencjału czynnościowego w izolacji i wyeliminował kluczowe źródło szumu elektronicznego , prąd I C związany z pojemnością C membrany . Ponieważ prąd jest równy C razy szybkość zmian napięcia transmembranowego Vm , rozwiązaniem było . Vm zaprojektowanie obwodu, który utrzymywałby stałe (zerowa szybkość zmian) niezależnie od prądów przepływających przez membranę Zatem prąd wymagany do utrzymania stałej wartości Vm jest bezpośrednim odbiciem prądu przepływającego przez membranę. Inne postępy w elektronice obejmowały zastosowanie klatek Faradaya i elektroniki o wysokiej impedancji wejściowej , dzięki czemu sam pomiar nie wpływał na mierzone napięcie.
Trzeci problem, polegający na uzyskaniu elektrod wystarczająco małych, aby rejestrować napięcia w pojedynczym aksonie bez zakłócania go, został rozwiązany w 1949 r. Wraz z wynalezieniem szklanej elektrody mikropipety, która została szybko przyjęta przez innych badaczy. Udoskonalenia tej metody umożliwiają wytwarzanie końcówek elektrod o średnicy nawet 100 Å (10 nm ), co również zapewnia wysoką impedancję wejściową. Potencjały czynnościowe można również rejestrować za pomocą małych metalowych elektrod umieszczonych tuż obok neuronu, za pomocą neurochipów zawierających EOSFET lub optycznie za pomocą barwników wrażliwych na Ca 2+ lub na napięcie.

elektrody mikropipetowe mierzą sumę prądów przepływających przez wiele kanałów jonowych, badanie właściwości elektrycznych pojedynczego kanału jonowego stało się możliwe w latach 70 . Za to odkrycie otrzymali Nagrodę Nobla w dziedzinie fizjologii lub medycyny. Patch-clamping potwierdził, że kanały jonowe mają dyskretne stany przewodnictwa, takie jak otwarty, zamknięty i nieaktywny.
obrazowania optycznego w celu pomiaru potencjałów czynnościowych za pomocą jednoczesnych rejestracji w wielu miejscach lub z rozdzielczością ultraprzestrzenną. Za pomocą czułych na napięcie barwników optycznie zarejestrowano potencjały czynnościowe z niewielkiego skrawka błony kardiomiocytów .
neurotoksyny

Kilka neurotoksyn , zarówno naturalnych, jak i syntetycznych, ma blokować potencjał czynnościowy. Tetrodotoksyna z rozdymkowatych i saksytoksyna z Gonyaulax ( rodzaj bruzdnic odpowiedzialnych za „ czerwone przypływy ”) blokują potencjały czynnościowe poprzez hamowanie wrażliwego na napięcie kanału sodowego; podobnie dendrotoksyna z węża mamby czarnej hamuje wrażliwy na napięcie kanał potasowy. Takie inhibitory kanałów jonowych służą ważnym celom badawczym, umożliwiając naukowcom dowolne „wyłączanie” określonych kanałów, izolując w ten sposób udział innych kanałów; mogą być również przydatne do oczyszczania kanałów jonowych metodą chromatografii powinowactwa lub do oznaczania ich stężenia. Jednak takie inhibitory wytwarzają również skuteczne neurotoksyny i rozważano ich użycie jako broni chemicznej . Neurotoksyny skierowane na kanały jonowe owadów są skutecznymi insektycydami ; jednym z przykładów jest syntetyczna permetryna , która przedłuża aktywację kanałów sodowych zaangażowanych w potencjały czynnościowe. Kanały jonowe owadów są na tyle różne od ich ludzkich odpowiedników, że u ludzi występuje niewiele skutków ubocznych.
Historia

Rolę elektryczności w układach nerwowych zwierząt po raz pierwszy zaobserwował u preparowanych żab Luigi Galvani , który badał ją w latach 1791-1797. Wyniki Galvaniego zainspirowały Alessandro Voltę do opracowania stosu woltaicznego — najwcześniejszej znanej baterii elektrycznej — za pomocą której studiował elektryczność zwierząt (takich jak węgorze elektryczne ) i reakcje fizjologiczne na przyłożone napięcie prądu stałego .
XIX-wieczni naukowcy badali propagację sygnałów elektrycznych w całych nerwach (tj. wiązkach neuronów ) i wykazali, że tkanka nerwowa składa się z komórek , a nie z połączonej sieci rurek ( retikulum ). Carlo Matteucci kontynuował badania Galvaniego i wykazał, że błony komórkowe mają na sobie napięcie i mogą wytwarzać prąd stały . Praca Matteucciego zainspirowała niemieckiego fizjologa Emila du Bois-Reymonda , który odkrył potencjał czynnościowy w 1843 r. Szybkość przewodzenia potencjałów czynnościowych została po raz pierwszy zmierzona w 1850 r. przez przyjaciela du Bois-Reymonda, Hermanna von Helmholtza . Aby ustalić, że tkanka nerwowa składa się z oddzielnych komórek, hiszpański lekarz Santiago Ramón y Cajal i jego uczniowie wykorzystali plamę opracowaną przez Camillo Golgiego , aby odsłonić niezliczone kształty neuronów, które skrupulatnie odtworzyli. Za swoje odkrycia Golgi i Ramón y Cajal otrzymali w 1906 roku Nagrodę Nobla w dziedzinie fizjologii . Ich praca rozwiązała długotrwały spór w neuroanatomii XIX wieku; Sam Golgi opowiadał się za sieciowym modelem układu nerwowego.

Wiek XX był znaczącą erą dla elektrofizjologii. W 1902 i ponownie w 1912 Julius Bernstein wysunął hipotezę, że potencjał czynnościowy wynika ze zmiany przepuszczalności błony aksonalnej dla jonów. Hipoteza Bernsteina została potwierdzona przez Kena Cole'a i Howarda Curtisa, którzy wykazali, że przewodnictwo błony wzrasta podczas potencjału czynnościowego. W 1907 roku Louis Lapicque zasugerował, że potencjał czynnościowy generował się po przekroczeniu progu, co później zostało pokazane jako iloczyn dynamicznych układów przewodnictwa jonowego. W 1949 roku Alan Hodgkin i Bernard Katz udoskonalili hipotezę Bernsteina, biorąc pod uwagę, że błona aksonalna może mieć różną przepuszczalność dla różnych jonów; w szczególności wykazali kluczową rolę przepuszczalności sodu dla potencjału czynnościowego. Dokonali pierwszego rzeczywistego zapisu zmian elektrycznych w błonie neuronalnej, które pośredniczą w potencjale czynnościowym. Ta linia badań zakończyła się w pięciu artykułach Hodgkina, Katza i Andrew Huxleya z 1952 roku , w których zastosowali technikę zaciskania napięcia w celu określenia zależności przepuszczalności błony aksonów dla jonów sodu i potasu od napięcia i czasu, na podstawie których byli w stanie ilościowo zrekonstruować potencjał czynnościowy. Hodgkin i Huxley skorelowali właściwości swojego modelu matematycznego z dyskretnymi kanałami jonowymi , które mogą istnieć w kilku różnych stanach, w tym „otwarty”, „zamknięty” i „nieaktywny”. Ich hipotezy zostały potwierdzone w połowie lat 70. i 80. przez Erwina Nehera i Berta Sakmanna , którzy opracowali technikę patch clampingu do badania stanów przewodnictwa poszczególnych kanałów jonowych. W XXI wieku naukowcy zaczynają rozumieć strukturalne podstawy tych stanów przewodnictwa i selektywności kanałów dla ich rodzajów jonów, poprzez struktury krystaliczne o rozdzielczości atomowej, pomiary odległości fluorescencji i badania krio -mikroskopii elektronowej .
Julius Bernstein był również pierwszym, który wprowadził równanie Nernsta dla potencjału spoczynkowego przez błonę; zostało to uogólnione przez Davida E. Goldmana do tytułowego równania Goldmana w 1943 r. Pompę sodowo-potasową zidentyfikowano w 1957 r., a jej właściwości stopniowo wyjaśniano, czego kulminacją było określenie jej struktury o rozdzielczości atomowej za pomocą krystalografii rentgenowskiej . Struktury krystaliczne powiązanych pomp jonowych zostały również rozwiązane, dając szerszy obraz działania tych maszyn molekularnych .
Modele ilościowe

Modele matematyczne i obliczeniowe są niezbędne do zrozumienia potencjału czynnościowego i oferują prognozy, które można przetestować na podstawie danych eksperymentalnych, zapewniając rygorystyczny test teorii. Najważniejszym i najdokładniejszym z wczesnych modeli neuronowych jest model Hodgkina-Huxleya , który opisuje potencjał czynnościowy za pomocą połączonego zestawu czterech równań różniczkowych zwyczajnych (ODE). Chociaż model Hodgkina-Huxleya może być uproszczeniem z kilkoma ograniczeniami w porównaniu z realistyczną błoną nerwową, jaka istnieje w naturze, jego złożoność zainspirowała kilka jeszcze bardziej uproszczonych modeli, takich jak model Morrisa-Lecara i model FitzHugh - Nagumo , z których oba mają tylko dwa sprzężone ODE. Właściwości modeli Hodgkina – Huxleya i FitzHugha – Nagumo oraz ich pokrewnych, takich jak model Bonhoeffera – Van der Pol, zostały dobrze zbadane w matematyce, obliczeniach i elektronice. Jednak proste modele potencjału generatora i potencjału czynnościowego nie są w stanie dokładnie odtworzyć bliskiej wartości progowej szybkości i kształtu impulsów nerwowych, szczególnie dla mechanoreceptorów, takich jak ciałko Paciniego . Bardziej nowoczesne badania koncentrowały się na większych i bardziej zintegrowanych systemach; łącząc modele potencjału czynnościowego z modelami innych części układu nerwowego (takich jak dendryty i synapsy), badacze mogą badać obliczenia neuronowe i proste odruchy , takie jak odruchy ucieczki i inne kontrolowane przez centralne generatory wzorców .
Zobacz też
Notatki
- ^ Ogólnie rzecz biorąc, chociaż ten prosty opis inicjacji potencjału czynnościowego jest dokładny, nie wyjaśnia on zjawisk, takich jak blok wzbudzenia (zdolność do zapobiegania wzbudzaniu przez neurony potencjałów czynnościowych poprzez stymulację ich dużymi skokami prądu) oraz zdolność do wywoływania potencjałów czynnościowych przez krótko hiperpolaryzując membranę. Jednak analizując dynamikę systemu kanałów sodowych i potasowych w plastrze błony za pomocą modeli obliczeniowych , zjawiska te można łatwo wyjaśnić.
- ^ Zauważ, że te włókna Purkinjego są włóknami mięśniowymi i nie są spokrewnione z komórkami Purkinjego , które są neuronami znajdującymi się w móżdżku .
przypisy
artykuły prasowe
Książki
- Anderson JA, Rosenfeld E, wyd. (1988). Neurocomputing: podstawy badań . Cambridge, Massachusetts: The MIT Press. ISBN 978-0-262-01097-9 . LCCN 87003022 . OCLC 15860311 .
- Bernsteina J. (1912). Elektrobiologie, die Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage dargestellt [ Biologia elektryczna, nauka o procesach elektrycznych w organizmach reprezentowanych współcześnie ]. Brunszwik: Vieweg und Sohn. LCCN 12027986 . OCLC 11358569 .
- Bower JM, Beeman D (1995). Księga GENESIS: eksploracja realistycznych modeli neuronowych za pomocą systemu GEneral NEural SIMulation . Santa Clara, Kalifornia: TELOS. ISBN 978-0-387-94019-9 . LCCN 94017624 . OCLC 30518469 .
- Brazier MA (1961). Historia aktywności elektrycznej mózgu . Londyn: Pitman. LCCN 62001407 . OCLC 556863 .
- Bullock TH , Horridge GA (1965). Struktura i funkcja w układach nerwowych bezkręgowców . Seria książek z biologii. San Francisco: WH Freeman. LCCN 65007965 . OCLC 558128 .
- Bullock TH , Orkand R, Grinnell A (1977). Wprowadzenie do układów nerwowych . Seria książek z biologii. San Francisco: WH Freeman. ISBN 978-0-7167-0030-2 . LCCN 76003735 . OCLC 2048177 .
- Pole J, wyd. (1959). Podręcznik fizjologii: krytyczna, wszechstronna prezentacja wiedzy i pojęć fizjologicznych: Część 1: Neurofizjologia . Tom. 1. Waszyngton, DC: Amerykańskie Towarzystwo Fizjologiczne. LCCN 60004587 . OCLC 830755894 .
- Ganong, WF (1991). Przegląd fizjologii medycznej . Ganong's Review of Medical Physiology (wyd. 15). Norwalk, Connecticut: Appleton i Lange. ISBN 978-0-8385-8418-7 . ISSN 0892-1253 . LCCN 87642343 . OCLC 23761261 .
- Guckenheimer J, Holmes P, wyd. (1986). Oscylacje nieliniowe, układy dynamiczne i bifurkacje pól wektorowych . Stosowane nauki matematyczne. Tom. 42 (wyd. 2). Nowy Jork: Springer Verlag. ISBN 978-0-387-90819-9 . OCLC 751129941 .
- Hoppenssteadt FC (1986). Wprowadzenie do matematyki neuronów . Studia Cambridge z biologii matematycznej. Tom. 6. Cambridge: Cambridge University Press. ISBN 978-0-521-31574-6 . LCCN 85011013 . OCLC 12052275 .
- Junge D (1981). Pobudzenie nerwów i mięśni (wyd. 2). Sunderland, Massachusetts: Sinauer Associates. ISBN 978-0-87893-410-2 . LCCN 80018158 . OCLC 6486925 .
- Kettenmann H, Grantyn R, wyd. (1992). Praktyczne metody elektrofizjologiczne: przewodnik po badaniach in vitro w neurobiologii kręgowców . Nowy Jork: Wiley. ISBN 978-0-471-56200-9 . LCCN 92000179 . OCLC 25204689 .
- Keynes RD , Aidley DJ (1991). Nerwy i mięśnie (wyd. 2). Cambridge: Cambridge University Press. ISBN 978-0-521-41042-7 . LCCN 90015167 . OCLC 25204483 .
- Koch C , Segev I, wyd. (1989). Metody modelowania neuronów: od synaps do sieci . Cambridge, Massachusetts: The MIT Press. ISBN 978-0-262-11133-1 . LCCN 88008279 . OCLC 18384545 .
- Lavallée M, Schane OF, Hébert NC, wyd. (1969). szklane mikroelektrody . Nowy Jork: Wiley. ISBN 978-0-471-51885-3 . LCCN 68009252 . OCLC 686 .
- McCulloch WS (1988). Ucieleśnienia umysłu . Cambridge, Massachusetts: The MIT Press. ISBN 978-0-262-63114-3 . LCCN 88002987 . OCLC 237280 .
- McHenry LC, garnizon FH (1969). Historia neurologii Garrisona . Springfield, Illinois: Charles C. Thomas. OCLC 429733931 .
- Silverthorn DU (2010). Fizjologia człowieka: podejście zintegrowane (wyd. 5). San Francisco: Pearsona. ISBN 978-0-321-55980-7 . LCCN 2008050369 . OCLC 268788623 .
- Spanswick RM, Lucas WJ, Dainty J, wyd. (1980). Transport membranowy roślin: aktualne problemy koncepcyjne . Rozwój biologii roślin . Tom. 4. Amsterdam: Elsevier Biomedical Press. ISBN 978-0-444-80192-0 . LCCN 79025719 . OCLC 5799924 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, Williams SM (2001). „Uwolnienie przekaźników z pęcherzyków synaptycznych” . Neuronauka (wyd. 2). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-742-4 . LCCN 00059496 . OCLC 806472664 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, White LE (2008). Neuronauka (wyd. 4). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-697-7 . LCCN 2007024950 . OCLC 144771764 .
- Reeke GN, Poznański RR, Sporns O, Rosenberg JR, Lindsay KA, wyd. (2005). Modelowanie w neuronaukach: od systemów biologicznych do robotyki neuromimetycznej . Boca Raton, Floryda: Taylor i Francis. ISBN 978-0-415-32868-5 . LCCN 2005298022 . OCLC 489024131 .
- Schmidt-Nielsen K (1997). Fizjologia zwierząt: adaptacja i środowisko (wyd. 5). Cambridge: Cambridge University Press. ISBN 978-0-521-57098-5 . LCCN 96039295 . OCLC 35744403 .
- Schwann HP, wyd. (1969). Inżynieria biologiczna . Międzyuczelniana Seria Elektroniki. Tom. 9. Nowy Jork: McGraw-Hill. ISBN 978-0-07-055734-5 . LCCN 68027513 . OCLC 51993 .
- Stevens CF (1966). Neurofizjologia: elementarz . Nowy Jork: John Wiley and Sons. ISBN 9780471824367 . LCCN 66015872 . OCLC 1175605 .
- Waxman SG, wyd. (2007). Neurologia Molekularna . Burlington, Massachusetts: Elsevier Academic Press. ISBN 978-0-12-369509-3 . LCCN 2008357317 . OCLC 154760295 .
- Worden FG, Swazey JP, Adelman G, wyd. (1975). Neurosciences, Paths of Discovery . Cambridge, Massachusetts: The MIT Press. ISBN 978-0-262-23072-8 . LCCN 75016379 . OCLC 1500233 .
strony internetowe
Dalsza lektura
- Aidley DJ, Stanfield PR (1996). Kanały jonowe: cząsteczki w działaniu . Cambridge: Cambridge University Press. ISBN 978-0-521-49882-1 .
- Niedźwiedź MF, Connors BW, Paradiso MA (2001). Neuronauka: eksploracja mózgu . Baltimore: Lippincott. ISBN 0-7817-3944-6 .
- Glina JR (maj 2005). „Ponowna pobudliwość aksonalna” . Postęp w biofizyce i biologii molekularnej . 88 (1): 59–90. doi : 10.1016/j.pbiomolbio.2003.12.004 . PMID 15561301 .
- Deutsch S, Micheli-Tzanakou E (1987). Systemy neuroelektryczne . Nowy Jork: New York University Press. ISBN 0-8147-1782-9 .
- Hille B (2001). Kanały jonowe membran pobudliwych (wyd. 3). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-321-1 .
- Johnston D, Wu SM (1995). Podstawy neurofizjologii komórkowej . Cambridge, Massachusetts: Bradford Book, The MIT Press. ISBN 0-262-10053-3 .
- Kandel ER , Schwartz JH, Jessell TM (2000). Zasady nauki neuronowej (wyd. 4). Nowy Jork: McGraw-Hill. ISBN 0-8385-7701-6 .
- Millera C. (1987). „Jak działają białka kanałów jonowych”. W Kaczmarek LK, Levitan IB (red.). Neuromodulacja: biochemiczna kontrola pobudliwości neuronów . Nowy Jork: Oxford University Press. s. 39–63. ISBN 978-0-19-504097-5 .
- Nelson DL, Cox MM (2008). Lehninger Zasady biochemii (wyd. 5). Nowy Jork: WH Freeman. ISBN 978-0-7167-7108-1 .
Linki zewnętrzne
- Przepływ jonowy w potencjałach czynnościowych w Blackwell Publishing
- Propagacja potencjału czynnościowego w mielinowanych i niemielinizowanych aksonach w Blackwell Publishing
- Generacja AP w komórkach serca i generacja AP w komórkach nerwowych
- Potencjał błony spoczynkowej z Life: The Science of Biology , autorstwa WK Purves, D Sadava, GH Orians i HC Heller, wydanie 8, Nowy Jork: WH Freeman, ISBN 978-0-7167-7671-0 .
- Ruch jonowy i napięcie Goldmana dla dowolnych stężeń jonów na Uniwersytecie w Arizonie
- Kreskówka ilustrująca potencjał czynnościowy
- Propagacja potencjału czynnościowego
- Produkcja potencjału czynnościowego: symulacje napięcia i prądu [ permanent dead link ]
- Oprogramowanie typu open source do symulacji potencjałów czynnościowych neuronów i serca na stronie SourceForge.net
- Wprowadzenie do potencjału czynnościowego , Neuroscience Online (elektroniczny podręcznik neuronauki autorstwa UT Houston Medical School)
- Khan Academy: potencjał elektrotoniczny i czynnościowy Zarchiwizowano 2 lipca 2014 r. w Wayback Machine





