Bramkowanie (elektrofizjologia)
W elektrofizjologii termin bramkowanie odnosi się do otwierania ( aktywacji ) lub zamykania (przez dezaktywację lub inaktywację) kanałów jonowych . Ta zmiana konformacji jest odpowiedzią na zmiany napięcia transbłonowego.
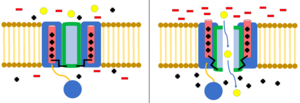
Kiedy kanały jonowe są w stanie „zamkniętym” (nie przewodzącym), są nieprzepuszczalne dla jonów i nie przewodzą prądu elektrycznego. Kiedy kanały jonowe są w stanie otwartym, przewodzą prąd elektryczny, umożliwiając przejście przez nie określonych rodzajów jonów, a tym samym przez błonę plazmatyczną komórki . Bramkowanie to proces, w którym kanał jonowy przechodzi ze stanu otwartego do zamkniętego.
Różnorodne zmiany komórkowe mogą wyzwalać bramkowanie, w zależności od kanału jonowego, w tym zmiany napięcia na błonie komórkowej (kanały jonowe bramkowane napięciem ), substancje chemiczne oddziałujące z kanałem jonowym (kanały jonowe bramkowane ligandem ), zmiany temperatury, rozciąganie lub deformacja błony komórkowej, dodanie grupy fosforanowej do kanału jonowego ( fosforylacja ) i interakcja z innymi cząsteczkami w komórce (np. białkami G ). Szybkość, z jaką którykolwiek z tych procesów bramkowania zachodzi w odpowiedzi na te wyzwalacze, jest znana jako kinetyka bramkowania . Niektóre leki i wiele toksyn kanałów jonowych działa jako „modyfikatory bramkowania” kanałów jonowych bramkowanych napięciem, zmieniając kinetykę bramkowania.
Bramkowane napięciem kanały jonowe potencjału czynnościowego są często opisywane jako mające cztery procesy bramkowania: aktywację, dezaktywację, inaktywację i reaktywację (zwaną także „odzyskiwaniem po inaktywacji”). Aktywacja to proces otwierania bramki aktywacyjnej, który następuje w odpowiedzi na to, że napięcie wewnątrz błony komórkowej ( potencjał błony ) staje się bardziej dodatnie w stosunku do zewnętrznej strony komórki ( depolaryzacja ), a „dezaktywacja” jest procesem przeciwnym do bramka aktywacyjna zamyka się w odpowiedzi na to, że wnętrze błony staje się bardziej ujemne (repolaryzacja). „Inaktywacja” to zamknięcie bramki inaktywacji i następuje w odpowiedzi na to, że napięcie wewnątrz membrany staje się bardziej dodatnie, ale wolniej niż aktywacja. „Reaktywacja” jest przeciwieństwem dezaktywacji i jest procesem ponownego otwierania bramy inaktywacji.
Te zależne od napięcia zmiany funkcji są krytyczne dla dużej liczby procesów zachodzących w komórkach pobudliwych i niepobudzalnych.
Aktywacja
Kanały jonowe bramkowane napięciem
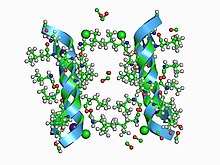
Kanały jonowe bramkowane napięciem otwierają się i zamykają w odpowiedzi na potencjał elektryczny w błonie komórkowej. Części domeny kanału działają jak czujniki napięcia. Gdy zmienia się potencjał błony, powoduje to zmiany sił elektrostatycznych , które przesuwają te domeny wykrywające napięcie. Zmienia to konformację innych elementów kanału do pozycji otwartej lub zamkniętej. Kiedy przechodzą z pozycji zamkniętej do pozycji otwartej, nazywa się to „aktywacją”. Kanały jonowe bramkowane napięciem leżą u podstaw wielu elektrycznych zachowań komórki, w tym potencjałów czynnościowych, spoczynkowych potencjałów błonowych i transmisji synaptycznej.
Kanały jonowe bramkowane napięciem są często specyficzne dla jonów, w tym Na + , K + , Ca 2+ i Cl − . Każdy z tych jonów odgrywa ważną rolę w zachowaniu elektrycznym komórki. Bramki mają również unikalne właściwości z ważnymi implikacjami fizjologicznymi. Na przykład kanały Na + otwierają się i zamykają szybko, podczas gdy bramki K + otwierają się i zamykają znacznie wolniej. Różnica prędkości między tymi kanałami leży u podstaw faz depolaryzacji i repolaryzacji potencjału czynnościowego.
Na + kanały
sodowe bramkowane napięciem (Na + ) są istotne, jeśli chodzi o propagację potencjałów czynnościowych w neuronach i innych komórkach pobudliwych, głównie są wykorzystywane do propagacji potencjału czynnościowego w aksonach, włóknach mięśniowych i nerwowym przedziale somatodendrytycznym. Kanały sodowe (Na + ) to jedne z głównych kanałów jonowych odpowiedzialnych za potencjały czynnościowe. Ponieważ są złożone, składają się z większych podjednostek α, które są następnie łączone w pary z dwiema mniejszymi podjednostkami β. Zawierają segmenty transbłonowe znane jako S1-6. Naładowane segmenty S4 to czujniki napięcia kanałów. Pod wpływem pewnej minimalnej różnicy potencjałów segmenty S4 poruszają się po błonie. Powoduje to ruch łącznika S4-S5, co powoduje skręcenie łącznika S5-S6 i otwarcie kanału.
K + kanały
potasowe (K + ) odgrywają dużą rolę w ustalaniu spoczynkowego potencjału błonowego. Kiedy błona komórkowa ulega depolaryzacji, wewnątrzkomórkowa część kanału zostaje naładowana dodatnio, co powoduje, że konfiguracja otwarta kanału staje się bardziej stabilna niż konfiguracja zamknięta. Istnieje kilka modeli aktywacji kanałów potasowych:
- ślizgowej helisy zakłada, że kanał potasowy otwiera się w wyniku ruchu śrubowego jego spirali S4.
- Model łopatkowy zakłada , że helisy S3 i S4 kanału tworzą „łopatki”, które poruszają się przez zdepolaryzowaną membranę i odciągają helisę S5 od otworu kanału.
- Model transportu zakłada, że skupione pole elektryczne powoduje, że naładowane cząstki poruszają się w poprzek kanału przy niewielkim ruchu helisy S4.
- Model skoordynowanego ruchu helis zakłada, że obie helisy S4 i S5 obracają się, a łącznik S4-S5 powoduje ruch helisy S6, otwierając kanał.
- Model konsensusu to średnia z powyższych modeli, która pomaga pogodzić je z danymi eksperymentalnymi.
Około 2+ kanałów
wapniowe (Ca 2+ ) regulują uwalnianie neuroprzekaźników w synapsach, kontrolują kształt potencjałów czynnościowych wytwarzanych przez kanały sodowe, aw niektórych neuronach generują potencjały czynnościowe. Kanały wapniowe składają się z sześciu helis transbłonowych. S4 działa jak czujnik napięcia, obracając się, gdy jest wystawiony na działanie pewnych potencjałów membranowych, otwierając w ten sposób kanał.
Neuroprzekaźniki są początkowo przechowywane i syntetyzowane w pęcherzykach w synapsie neuronu. Kiedy w komórce pojawia się potencjał czynnościowy, sygnał elektryczny dociera do końcówki presynaptycznej, a depolaryzacja powoduje otwarcie kanałów wapniowych, uwalniając wapń, który przemieszcza się zgodnie z gradientem elektrochemicznym. Ten napływ wapnia następnie powoduje, że pęcherzyki neuroprzekaźnika łączą się z błoną presynaptyczną. Jony wapnia inicjują interakcję białek obowiązkowych kofaktorów z białkami SNARE, tworząc kompleks SNARE. Te kompleksy SNARE pośredniczą w fuzji pęcherzyków poprzez przyciąganie do siebie błon, przepuszczając neuroprzekaźniki do szczeliny synaptycznej. Cząsteczki neuroprzekaźników mogą następnie sygnalizować następną komórkę za pośrednictwem receptorów na błonie postsynaptycznej. Receptory te mogą działać jako kanały jonowe lub GPCR (receptory sprzężone z białkiem G). Ogólnie neuroprzekaźnik może powodować reakcję pobudzającą lub hamującą, w zależności od tego, co dzieje się na receptorze.
Cl - Kanały
Kanały chlorkowe to kolejna grupa kanałów jonowych bramkowanych napięciem, z których są mniej poznane. Są zaangażowane w procesy, takie jak mięśnie gładkie szkieletu i serca, regulacja objętości komórek, cykl komórkowy i apoptoza. Jedną z głównych rodzin białek chlorkowych są białka CLC – wspólne kanały i transportery dla podstawowych procesów fizjologicznych u ssaków. Kanały CLC działają jako wolno bramkowane kanały; jony wodoru są wymieniane na napływ jonów chlorkowych, umożliwiając anionom przemieszczanie się przez ich gradient elektrochemiczny. Zależny od napięcia kanał chlorkowy C1C-1 jest homologicznym dimerem należącym do tej rodziny i jest widoczny głównie we włóknach mięśni szkieletowych. W przypadku tego kanału prawidłowa depolaryzacja i repolaryzacja za pomocą jonów chlorkowych jest niezbędna do propagacji potencjału czynnościowego.
Kanały jonowe bramkowane ligandem
Kanały jonowe bramkowane ligandem znajdują się w neuronach postsynaptycznych. Domyślnie przyjmują swoją zamkniętą konformację. Kiedy neuron presynaptyczny uwalnia neuroprzekaźniki na końcu potencjału czynnościowego, wiążą się one z kanałami jonowymi bramkowanymi ligandem. Powoduje to, że kanały przyjmują konformację otwartą, umożliwiając przepływ jonów przez kanały w dół ich gradientu stężeń. Kanały jonowe bramkowane ligandem są odpowiedzialne za szybką transmisję synaptyczną w układzie nerwowym i na złączu nerwowo-mięśniowym. Każdy kanał jonowy bramkowany ligandem ma szeroki zakres receptorów o różnych właściwościach biofizycznych, a także wzorcach ekspresji w układzie nerwowym.
Inaktywacja
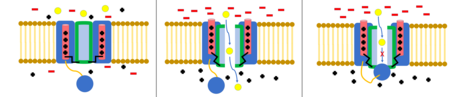
Inaktywacja ma miejsce, gdy przepływ jonów jest blokowany przez mechanizm inny niż zamknięcie kanału. Kanał w stanie otwartym może przestać przepuszczać jony lub kanał w stanie zamkniętym może zostać prewencyjnie dezaktywowany, aby uniemożliwić przepływ jonów. Inaktywacja zwykle występuje, gdy błona komórkowa ulega depolaryzacji, a kończy się, gdy przywracany jest potencjał spoczynkowy.
W kanałach sodowych inaktywacja wydaje się być wynikiem działania helis III-VI, przy czym III i IV działają jak rodzaj pokrywy na zawiasach, która blokuje kanał. Dokładny mechanizm jest słabo poznany, ale wydaje się, że opiera się na cząstce, która ma wysokie powinowactwo do odsłoniętego wnętrza otwartego kanału. Szybka inaktywacja umożliwia kanałowi zatrzymanie przepływu sodu bardzo szybko po przyjęciu konformacji otwartej.
Inaktywacja kulek i łańcuchów
kulki i łańcucha , znany również jako inaktywacja typu N lub dezaktywacja pokrywy zawiasowej, jest mechanizmem bramkującym dla niektórych kanałów jonowych bramkowanych napięciem. Kanały jonowe bramkowane napięciem składają się z 4 [ wątpliwych ] podjednostek α, z których jedna lub więcej będzie miała domenę kulową zlokalizowaną na jej cytoplazmatycznym N-końcu. Domena kuli jest przyciągana elektrostatycznie do domeny kanału wewnętrznego. Kiedy kanał jonowy jest aktywowany, wewnętrzna domena kanału zostaje odsłonięta iw ciągu milisekund łańcuch się zwija, a kula wejdzie do kanału, blokując przenikanie jonów. Kanał powraca do stanu zamkniętego, blokując domenę kanału, a kulka opuszcza por.
Dezaktywacja
Dezaktywacja to powrót kanału jonowego do jego zamkniętej konformacji. W przypadku kanałów bramkowanych napięciem dzieje się tak, gdy różnica napięcia, która pierwotnie spowodowała otwarcie kanału, powraca do wartości spoczynkowej.
W kanałach sodowych bramkowanych napięciem dezaktywacja jest konieczna do wyzdrowienia z inaktywacji.
W kanałach potasowych bramkowanych napięciem sytuacja jest odwrotna, a dezaktywacja spowalnia regenerację kanału po aktywacji. Domyślnie przyjmuje się zamkniętą konformację i obejmuje ona częściowe prostowanie helisy VI przez łącznik IV-V. Mechanizmy powodujące otwieranie i zamykanie nie są w pełni poznane. Konformacja zamknięta wydaje się być konformacją o wyższej energii niż konformacja otwarta, co może również pomóc wyjaśnić, w jaki sposób aktywuje się kanał jonowy.
Ujęcie ilościowe
Ładunek bramkujący można obliczyć, rozwiązując równanie Poissona . Ostatnie badania sugerują metodę opartą na symulacji dynamiki molekularnej w celu określenia ładunku bramkującego poprzez pomiar właściwości kondensatora elektrycznego białek osadzonych w błonie. Aktywność kanałów jonowych znajdujących się w błonie plazmatycznej można zmierzyć po prostu przyłączając szklaną elektrodę kapilarną w sposób ciągły do membrany. Inne kanały jonowe znajdujące się w błonach mitochondriów, lizosomach i aparacie Golgiego można zmierzyć za pomocą nowej techniki, która obejmuje zastosowanie sztucznej dwuwarstwowej błony lipidowej przymocowanej do 16-elektrodowego urządzenia mierzącego aktywność elektryczną.