Potencjał błonowy

Potencjał błonowy (również potencjał transbłonowy lub napięcie błonowe ) to różnica potencjałów elektrycznych między wnętrzem a zewnętrzem komórki biologicznej . Oznacza to, że istnieje różnica w energii wymaganej do przemieszczania się ładunków elektrycznych z wewnętrznego do zewnętrznego środowiska komórkowego i odwrotnie, o ile nie dochodzi do pozyskiwania energii kinetycznej lub wytwarzania promieniowania. Gradienty stężeń ładunków bezpośrednio określają to zapotrzebowanie na energię. Dla zewnętrznej powierzchni komórki, typowe wartości potencjału błonowego, zwykle podawane w jednostkach miliwolty i oznaczone jako mV, mieszczą się w zakresie od –80 mV do –40 mV .
Wszystkie komórki zwierzęce otoczone są błoną składającą się z dwuwarstwy lipidowej z osadzonymi w niej białkami . Membrana służy zarówno jako izolator, jak i bariera dyfuzyjna dla ruchu jonów . Białka transbłonowe , znane również jako transportery jonów lub białka pompy jonowej , aktywnie wypychają jony przez błonę i ustalają gradienty stężeń w poprzek błony, a kanały jonowe umożliwiają jonom przemieszczanie się przez błonę w dół tych gradientów stężeń. Pompy jonowe i kanały jonowe są elektrycznie równoważne zestawowi baterii i rezystorów umieszczonych w membranie, a tym samym wytwarzają napięcie między dwiema stronami membrany.
Prawie wszystkie błony plazmatyczne mają w poprzek siebie potencjał elektryczny, przy czym wnętrze jest zwykle ujemne w stosunku do otoczenia. Potencjał błony ma dwie podstawowe funkcje. Po pierwsze, pozwala komórce działać jako bateria, dostarczając energię do obsługi różnych „urządzeń molekularnych” osadzonych w membranie. komórkach pobudliwych elektrycznie, takich jak neurony i komórki mięśniowe , jest używany do przesyłania sygnałów między różnymi częściami komórki. Sygnały są generowane przez otwieranie lub zamykanie kanałów jonowych w jednym punkcie błony, powodując lokalną zmianę potencjału błony. Ta zmiana pola elektrycznego może być szybko wykryta przez sąsiednie lub bardziej odległe kanały jonowe w membranie. Te kanały jonowe mogą następnie otwierać się lub zamykać w wyniku zmiany potencjału, odtwarzając sygnał.
W komórkach niepobudzalnych iw komórkach pobudliwych w stanie wyjściowym potencjał błonowy jest utrzymywany na stosunkowo stabilnej wartości, zwanej potencjałem spoczynkowym . W przypadku neuronów potencjał spoczynkowy definiuje się jako mieszczący się w zakresie od –80 do –70 miliwoltów; to znaczy, że wnętrze komórki ma ujemne napięcie podstawowe, nieco mniejsze niż jedna dziesiąta wolta. Otwieranie i zamykanie kanałów jonowych może powodować odejście od potencjału spoczynkowego. Nazywa się to depolaryzacją , jeśli napięcie wewnętrzne staje się mniej ujemne (powiedzmy od –70 mV do –60 mV) lub hiperpolaryzacją jeśli napięcie wewnętrzne staje się bardziej ujemne (powiedzmy od –70 mV do –80 mV). W komórkach pobudliwych wystarczająco duża depolaryzacja może wywołać potencjał czynnościowy , w którym potencjał błonowy zmienia się szybko i znacząco w krótkim czasie (rzędu 1 do 100 milisekund), często odwracając swoją polaryzację. Potencjały czynnościowe są generowane przez aktywację niektórych kanałów jonowych bramkowanych napięciem .
W neuronach czynniki wpływające na potencjał błonowy są różnorodne. Obejmują one wiele typów kanałów jonowych, z których niektóre są bramkowane chemicznie, a niektóre bramkowane napięciem. Ponieważ kanały jonowe bramkowane napięciem są kontrolowane przez potencjał błony, podczas gdy na sam potencjał błony wpływają te same kanały jonowe, powstają pętle sprzężenia zwrotnego, które pozwalają na złożoną dynamikę czasową, w tym oscylacje i zdarzenia regeneracyjne, takie jak potencjały czynnościowe.
Podstawa fizyczna
Potencjał błonowy w komórce wynika ostatecznie z dwóch czynników: siły elektrycznej i dyfuzji. Siła elektryczna powstaje w wyniku wzajemnego przyciągania się cząstek o przeciwnych ładunkach elektrycznych (dodatnich i ujemnych) oraz wzajemnego odpychania się cząstek o tym samym ładunku (zarówno dodatnim, jak i ujemnym). Dyfuzja wynika ze statystycznej tendencji cząstek do redystrybucji z obszarów, w których są one bardzo skoncentrowane, do obszarów, w których stężenie jest niskie.
Napięcie
Napięcie, które jest równoznaczne z różnicą potencjałów elektrycznych , to zdolność do kierowania prądu elektrycznego przez rezystancję. Rzeczywiście, najprostszą definicję napięcia podaje prawo Ohma : V=IR, gdzie V to napięcie, I to prąd, a R to rezystancja. Jeśli źródło napięcia, takie jak bateria, zostanie umieszczone w obwodzie elektrycznym, im wyższe napięcie źródła, tym większa ilość prądu, który przepłynie przez dostępny opór. Funkcjonalne znaczenie napięcia polega tylko na różnicach potencjałów między dwoma punktami obwodu. Pomysł napięcia w jednym punkcie jest bez znaczenia. W elektronice zwyczajowo przypisuje się dowolnemu elementowi obwodu napięcie zerowe, a następnie przypisuje się napięcia innym elementom mierzonym względem tego punktu zerowego. Nie ma znaczenia, który element zostanie wybrany jako punkt zerowy – funkcja obwodu zależy tylko od różnic, a nie od napięć per se . Jednak w większości przypadków i zgodnie z konwencją poziom zerowy jest najczęściej przypisywany do części obwodu, która styka się z ziemią.
Ta sama zasada dotyczy napięcia w biologii komórki. W tkance aktywnej elektrycznie różnicę potencjałów między dowolnymi dwoma punktami można zmierzyć, umieszczając elektrodę w każdym punkcie, na przykład jedną wewnątrz, a drugą na zewnątrz komórki, i podłączając obie elektrody do wyprowadzeń czegoś, co w istocie jest wyspecjalizowanym woltomierzem. Zgodnie z konwencją wartość potencjału zerowego jest przypisywana na zewnątrz komórki, a znak różnicy potencjałów między zewnętrzem a wnętrzem jest określany przez potencjał wnętrza względem zera na zewnątrz.
W kategoriach matematycznych definicja napięcia zaczyna się od pojęcia pola elektrycznego E , pola wektorowego przypisującego wielkość i kierunek do każdego punktu w przestrzeni. W wielu sytuacjach pole elektryczne jest polem konserwatywnym , co oznacza, że można je wyrazić jako gradient funkcji skalarnej V , czyli E = –∇ V . To pole skalarne V nazywa się rozkładem napięcia. Definicja dopuszcza dowolną stałą całkowania – dlatego bezwzględne wartości napięcia nie mają znaczenia. Generalnie pola elektryczne można traktować jako konserwatywne tylko wtedy, gdy pola magnetyczne nie mają na nie istotnego wpływu, ale ten warunek zwykle dobrze odnosi się do tkanki biologicznej.
Ponieważ pole elektryczne jest gradientem rozkładu napięcia, szybkie zmiany napięcia w małym obszarze oznaczają silne pole elektryczne; i odwrotnie, jeśli napięcie pozostaje w przybliżeniu takie samo na dużym obszarze, pola elektryczne w tym obszarze muszą być słabe. Silne pole elektryczne, odpowiadające silnemu gradientowi napięcia, oznacza, że na każdą naładowaną cząstkę znajdującą się w tym obszarze działa duża siła.
Jony i siły kierujące ich ruchem

Sygnały elektryczne w organizmach biologicznych są na ogół napędzane przez jony . Najważniejszymi kationami dla potencjału czynnościowego są kationy sodu (Na + ) i potasu (K + ). Oba są jednowartościowymi , które mają jeden ładunek dodatni. Potencjały czynnościowe mogą również obejmować wapń (Ca 2+ ), który jest dwuwartościowym kationem o podwójnym ładunku dodatnim. Anion chlorkowy ( Cl - ) odgrywa ważną rolę w potencjałach czynnościowych niektórych glonów , ale odgrywa znikomą rolę w potencjałach czynnościowych większości zwierząt.
Jony przechodzą przez błonę komórkową pod dwoma wpływami: dyfuzji i pola elektrycznego . Prosty przykład, w którym dwa roztwory — A i B — są oddzielone porowatą barierą, ilustruje, że dyfuzja zapewni ich ostateczne zmieszanie w równe roztwory. To mieszanie zachodzi z powodu różnicy w ich stężeniach. Region o wysokim stężeniu będzie dyfundował w kierunku regionu o niskim stężeniu. Aby rozszerzyć przykład, niech roztwór A zawiera 30 jonów sodu i 30 jonów chlorku. Niech roztwór B zawiera tylko 20 jonów sodu i 20 jonów chlorku. Zakładając, że bariera pozwala na przechodzenie przez nią obu rodzajów jonów, wówczas osiągnięty zostanie stan ustalony, w którym oba roztwory będą zawierały 25 jonów sodu i 25 jonów chlorku. Jeśli jednak porowata bariera jest selektywna, przez którą przepuszczane są jony, to sama dyfuzja nie zadecyduje o powstałym roztworze. Wracając do poprzedniego przykładu, skonstruujmy teraz barierę przepuszczalną tylko dla jonów sodu. Teraz tylko sód może dyfundować przez barierę od jego wyższego stężenia w roztworze A do niższego stężenia w roztworze B. Spowoduje to większą akumulację jonów sodu niż jonów chlorkowych w roztworze B i mniejszą liczbę jonów sodu niż jony sodu niż jony chlorkowe w roztworze B. jony chlorkowe w roztworze A.
Oznacza to, że w roztworze B występuje dodatni ładunek wypadkowy wynikający z wyższego stężenia dodatnio naładowanych jonów sodu niż ujemnie naładowanych jonów chlorkowych. Podobnie, w roztworze A występuje ładunek ujemny netto wynikający z większego stężenia ujemnych jonów chlorkowych niż dodatnich jonów sodu. Ponieważ ładunki przeciwne przyciągają się, a ładunki podobne odpychają, na jony wpływają teraz również pola elektryczne oraz siły dyfuzji. Dlatego dodatnie jony sodu będą rzadziej przemieszczać się do bardziej dodatniego roztworu B i pozostawać w bardziej ujemnym roztworze A. Punkt, w którym siły pól elektrycznych całkowicie przeciwdziałają sile spowodowanej dyfuzją, nazywany jest potencjałem równowagi. W tym momencie przepływ netto określonego jonu (w tym przypadku sodu) wynosi zero.
Membrany plazmowe

Każda komórka jest zamknięta w błonie plazmatycznej , która ma strukturę dwuwarstwy lipidowej , w której osadzonych jest wiele rodzajów dużych cząsteczek. Ponieważ jest zbudowana z cząsteczek lipidów, błona plazmatyczna z natury ma wysoką rezystywność elektryczną, innymi słowy niską wewnętrzną przepuszczalność jonów. Jednak niektóre cząsteczki osadzone w membranie są zdolne do aktywnego transportu jonów z jednej strony membrany na drugą lub do tworzenia kanałów, przez które mogą się poruszać.
W terminologii elektrycznej membrana plazmatyczna działa jako połączony rezystor i kondensator . Opór wynika z faktu, że membrana utrudnia przemieszczanie się po niej ładunków. Pojemność wynika z faktu, że dwuwarstwa lipidowa jest tak cienka, że nagromadzenie naładowanych cząstek po jednej stronie powoduje powstanie siły elektrycznej, która przyciąga przeciwnie naładowane cząstki w kierunku drugiej strony. Na pojemność membrany nie mają wpływu cząsteczki, które są w niej osadzone, więc ma ona mniej więcej niezmienną wartość szacowaną na 2 μF/cm 2 (całkowita pojemność skrawka membrany jest proporcjonalna do jego powierzchni). Z drugiej strony przewodnictwo czystej dwuwarstwy lipidowej jest tak niskie, że w sytuacjach biologicznych zawsze dominuje przewodnictwo alternatywnych szlaków zapewnianych przez cząsteczki osadzone. Zatem pojemność membrany jest mniej więcej stała, ale rezystancja jest bardzo zmienna.
Grubość błony plazmatycznej szacuje się na około 7-8 nanometrów. Ponieważ membrana jest tak cienka, nie potrzeba bardzo dużego napięcia przezbłonowego, aby wytworzyć w niej silne pole elektryczne. Typowe potencjały błonowe w komórkach zwierzęcych są rzędu 100 miliwoltów (czyli jednej dziesiątej wolta), ale obliczenia pokazują, że generuje to pole elektryczne bliskie maksimum, jakie może wytrzymać membrana — obliczono, że napięcie różnica znacznie większa niż 200 miliwoltów może spowodować przebicie dielektryczne , czyli wyładowanie łukowe w poprzek membrany.
Ułatwiona dyfuzja i transport

Odporność czystej dwuwarstwy lipidowej na przechodzenie przez nią jonów jest bardzo wysoka, ale struktury osadzone w błonie mogą znacznie zwiększać ruch jonów, aktywnie lub pasywnie , poprzez mechanizmy zwane ułatwionym transportem i ułatwioną dyfuzją . Dwa rodzaje struktur, które odgrywają największą rolę, to kanały jonowe i pompy jonowe , oba zwykle utworzone z zespołów cząsteczek białek. Kanały jonowe zapewniają kanały, przez które jony mogą się przemieszczać. W większości przypadków kanał jonowy jest przepuszczalny tylko dla określonych rodzajów jonów (na przykład sodu i potasu, ale nie dla chlorków lub wapnia), a czasami przepuszczalność zmienia się w zależności od kierunku ruchu jonów. Pompy jonowe, znane również jako transportery jonów lub białka nośnikowe, aktywnie transportują określone typy jonów z jednej strony błony na drugą, czasami wykorzystując do tego energię pochodzącą z procesów metabolicznych.
Pompy jonowe
Pompy jonowe to integralne białka błonowe , które przeprowadzają aktywny transport , tj. wykorzystują energię komórkową (ATP) do „pompowania” jonów wbrew ich gradientowi stężeń. Takie pompy jonowe pobierają jony z jednej strony membrany (zmniejszając tam jego stężenie) i uwalniają je z drugiej strony (tam zwiększając jego stężenie).
Pompą jonową najbardziej istotną dla potencjału czynnościowego jest pompa sodowo-potasowa , która transportuje trzy jony sodu z komórki i dwa jony potasu do środka. W konsekwencji stężenie jonów potasu K + wewnątrz neuronu jest około 20-krotne większe niż stężenie na zewnątrz, podczas gdy stężenie sodu na zewnątrz jest mniej więcej dziewięciokrotnie większe niż wewnątrz. W podobny sposób inne jony mają różne stężenia wewnątrz i na zewnątrz neuronu, takie jak wapń , chlorek i magnez .
Gdyby liczba każdego rodzaju jonów była równa, pompa sodowo-potasowa byłaby elektrycznie obojętna, ale ze względu na wymianę trzy za dwa daje ruch wypadkowy jednego ładunku dodatniego z wewnątrzkomórkowego do zewnątrzkomórkowego na każdy cykl, przyczyniając się w ten sposób do dodatniej różnicy napięć. Pompa ma trzy efekty: (1) powoduje wysokie stężenie sodu w przestrzeni pozakomórkowej i niskie w przestrzeni wewnątrzkomórkowej; (2) powoduje wysokie stężenie potasu w przestrzeni wewnątrzkomórkowej i niskie w przestrzeni pozakomórkowej; (3) nadaje przestrzeni wewnątrzkomórkowej ujemne napięcie w stosunku do przestrzeni pozakomórkowej.
Pompa sodowo-potasowa pracuje stosunkowo wolno. Gdyby komórka została zainicjowana z równymi stężeniami sodu i potasu wszędzie, ustalenie równowagi zajęłoby pompie wiele godzin. Pompa pracuje w sposób ciągły, ale staje się coraz mniej wydajna w miarę zmniejszania się stężenia sodu i potasu dostępnego do pompowania.
Pompy jonowe wpływają na potencjał czynnościowy jedynie poprzez ustalenie względnego stosunku stężeń jonów wewnątrz i zewnątrzkomórkowo. Potencjał czynnościowy obejmuje głównie otwieranie i zamykanie kanałów jonowych, a nie pomp jonowych. Jeśli pompy jonowe zostaną wyłączone przez usunięcie ich źródła energii lub dodanie inhibitora, takiego jak ouabaina , akson może nadal wystrzelić setki tysięcy potencjałów czynnościowych, zanim ich amplitudy zaczną znacznie spadać. W szczególności pompy jonowe nie odgrywają znaczącej roli w repolaryzacji błony po potencjale czynnościowym.
Inną funkcjonalnie ważną pompą jonową jest wymieniacz sodowo-wapniowy . Pompa ta działa koncepcyjnie podobnie do pompy sodowo-potasowej, z tą różnicą, że w każdym cyklu wymienia trzy Na + z przestrzeni zewnątrzkomórkowej na jeden Ca ++ z przestrzeni wewnątrzkomórkowej. Ponieważ przepływ ładunku netto jest skierowany do wewnątrz, pompa ta w efekcie działa „w dół” i dlatego nie wymaga żadnego źródła energii poza napięciem membranowym. Jego najważniejszym efektem jest pompowanie wapnia na zewnątrz - umożliwia również przepływ sodu do wewnątrz, przeciwdziałając w ten sposób pompie sodowo-potasowej, ale ponieważ ogólne stężenia sodu i potasu są znacznie wyższe niż stężenia wapnia, efekt ten jest stosunkowo nieistotny. Efektem netto wymieniacza sodowo-wapniowego jest to, że w stanie spoczynku wewnątrzkomórkowe stężenie wapnia staje się bardzo niskie.
kanały jonowe
Kanały jonowe to integralne białka błonowe z porami, przez które jony mogą przemieszczać się między przestrzenią pozakomórkową a wnętrzem komórki. Większość kanałów jest specyficzna (selektywna) dla jednego jonu; na przykład większość kanałów potasowych charakteryzuje się stosunkiem selektywności 1000: 1 dla potasu w stosunku do sodu, chociaż jony potasu i sodu mają ten sam ładunek i różnią się tylko nieznacznie promieniem. Pory kanału są zwykle tak małe, że jony muszą przez nie przechodzić w kolejności pojedynczych plików. Pory kanałów mogą być otwarte lub zamknięte dla przepuszczania jonów, chociaż wiele kanałów wykazuje różne poziomy podprzewodnictwa. Kiedy kanał jest otwarty, jony przenikają przez kanał w dół transbłonowego gradientu stężenia dla tego konkretnego jonu. Szybkość przepływu jonów przez kanał, czyli jednokanałowa amplituda prądu, jest określona przez maksymalne przewodnictwo kanału i elektrochemiczną siłę napędową dla tego jonu, która jest różnicą między chwilową wartością potencjału membrany a wartością potencjał odwrotny .
Kanał może mieć kilka różnych stanów (odpowiadających różnym konformacjom białka), ale każdy taki stan jest albo otwarty, albo zamknięty. Ogólnie rzecz biorąc, stany zamknięte odpowiadają albo skurczowi porów, czyniąc je nieprzepuszczalnymi dla jonów, albo oddzielnej części białka, która zatyka pory. Na przykład, zależny od napięcia kanał sodowy ulega inaktywacji , w której część białka przesuwa się do porów, uszczelniając je. Ta inaktywacja odcina prąd sodowy i odgrywa kluczową rolę w potencjale czynnościowym.
Kanały jonowe można klasyfikować według tego, jak reagują na środowisko. Na przykład kanały jonowe zaangażowane w potencjał czynnościowy są kanałami wrażliwymi na napięcie ; otwierają się i zamykają w odpowiedzi na napięcie na membranie. Kanały bramkowane ligandem tworzą kolejną ważną klasę; te kanały jonowe otwierają się i zamykają w odpowiedzi na wiązanie cząsteczki ligandu , takiej jak neuroprzekaźnik . Inne kanały jonowe otwierają się i zamykają pod wpływem sił mechanicznych. Jeszcze inne kanały jonowe — takie jak neurony czuciowe — otwierają się i zamykają w odpowiedzi na inne bodźce, takie jak światło, temperatura lub ciśnienie.
Kanały wycieku
Kanały wyciekowe są najprostszym rodzajem kanałów jonowych, ponieważ ich przepuszczalność jest mniej więcej stała. Rodzaje kanałów wycieku, które mają największe znaczenie w neuronach, to kanały potasowe i chlorkowe. Nawet one nie są idealnie stałe pod względem swoich właściwości: po pierwsze, większość z nich jest zależna od napięcia w tym sensie, że przewodzą lepiej w jednym kierunku niż w drugim (innymi słowy, są to prostowniki ); po drugie, niektóre z nich mogą zostać wyłączone przez ligandy chemiczne, mimo że nie wymagają ligandów do działania.
Kanały bramkowane ligandem
Kanały jonowe bramkowane ligandem to kanały, których przepuszczalność znacznie wzrasta, gdy jakiś rodzaj chemicznego ligandu wiąże się ze strukturą białka. Komórki zwierzęce zawierają setki, jeśli nie tysiące ich rodzajów. Duży podzbiór pełni funkcję receptorów neuroprzekaźników — występują one w miejscach postsynaptycznych , a ligand chemiczny, który je bramkuje, jest uwalniany przez presynaptyczne zakończenie aksonu . Jednym z przykładów tego typu jest receptor AMPA , receptor glutaminianu neuroprzekaźnika który po aktywacji umożliwia przejście jonów sodu i potasu. Innym przykładem jest receptor GABA A , receptor neuroprzekaźnika GABA , który po aktywacji umożliwia przechodzenie jonów chlorkowych.
Receptory neuroprzekaźników są aktywowane przez ligandy, które pojawiają się w obszarze zewnątrzkomórkowym, ale istnieją inne rodzaje kanałów bramkowanych ligandami, które są kontrolowane przez interakcje po stronie wewnątrzkomórkowej.
Kanały zależne od napięcia
Kanały jonowe bramkowane napięciem , znane również jako kanały jonowe zależne od napięcia , to kanały, na których przepuszczalność wpływa potencjał błony. Tworzą kolejną bardzo dużą grupę, w której każdy członek ma określoną selektywność jonową i określoną zależność od napięcia. Wiele z nich jest również zależnych od czasu — innymi słowy, nie reagują natychmiast na zmianę napięcia, ale dopiero po pewnym czasie.
Jednym z najważniejszych członków tej grupy jest rodzaj kanału sodowego bramkowanego napięciem, który leży u podstaw potencjałów czynnościowych - są one czasami nazywane kanałami sodowymi Hodgkina-Huxleya, ponieważ początkowo zostały scharakteryzowane przez Alana Lloyda Hodgkina i Andrew Huxleya w swoich nagrodzonych Nagrodą Nobla badaniach nad fizjologią potencjału czynnościowego. Kanał jest zamknięty na poziomie napięcia spoczynkowego, ale gwałtownie się otwiera, gdy napięcie przekracza określony próg, umożliwiając duży napływ jonów sodu, który powoduje bardzo szybką zmianę potencjału błony. Odzyskiwanie z potencjału czynnościowego jest częściowo zależne od typu kanału potasowego bramkowanego napięciem, który jest zamknięty na poziomie napięcia spoczynkowego, ale otwiera się w wyniku dużej zmiany napięcia wytwarzanej podczas potencjału czynnościowego.
Potencjał odwrócenia
Potencjał odwrócenia (lub potencjał równowagi ) jonu to wartość napięcia transbłonowego, przy którym siły dyfuzyjne i elektryczne równoważą się, tak że nie ma przepływu jonów netto przez membranę. Oznacza to, że napięcie transmembranowe dokładnie przeciwstawia się sile dyfuzji jonu, tak że prąd netto jonu przez membranę jest zerowy i niezmienny. Potencjał odwrócenia jest ważny, ponieważ daje napięcie, które działa na kanały przepuszczalne dla tego jonu — innymi słowy, daje napięcie, które generuje gradient stężenia jonów, gdy działa jak bateria .
Potencjał równowagi danego jonu jest zwykle oznaczony notacją E jon . Potencjał równowagi dowolnego jonu można obliczyć za pomocą równania Nernsta . Na przykład potencjał odwrócenia dla jonów potasu będzie następujący:
Gdzie
- E eq,K + to potencjał równowagi dla potasu, mierzony w woltach
- R jest uniwersalną stałą gazową , równą 8,314 dżuli ·K -1 ·mol -1
- T to temperatura bezwzględna mierzona w kelwinach (= K = stopnie Celsjusza + 273,15)
- z jest liczbą ładunków elementarnych danego jonu biorącego udział w reakcji
- F jest stałą Faradaya równą 96 485 kulombów ·mol -1 lub J ·V -1 ·mol -1
- [K + ] o to pozakomórkowe stężenie potasu, mierzone w mol ·m -3 lub mmol·l -1
- [K + ] i to wewnątrzkomórkowe stężenie potasu
Nawet jeśli dwa różne jony mają ten sam ładunek (tj. K + i Na + ), nadal mogą mieć bardzo różne potencjały równowagi, pod warunkiem, że ich zewnętrzne i/lub wewnętrzne stężenia różnią się. Weźmy na przykład potencjały równowagi potasu i sodu w neuronach. Potencjał równowagi potasu E K wynosi -84 mV z 5 mM potasu na zewnątrz i 140 mM wewnątrz. Z drugiej strony, potencjał równowagi sodu, E Na , wynosi około +66 mV przy około 12 mM sodu wewnątrz i 140 mM na zewnątrz.
Zmiany potencjału błonowego podczas rozwoju
Spoczynkowy potencjał błonowy neuronu faktycznie zmienia się podczas rozwoju organizmu . Aby neuron ostatecznie przyjął swoją pełną dorosłą funkcję, jego potencjał musi być ściśle regulowany podczas rozwoju. W miarę rozwoju organizmu spoczynkowy potencjał błonowy staje się coraz bardziej ujemny. Komórki glejowe również różnicują się i proliferują w miarę rozwoju mózgu . Dodatek tych komórek glejowych zwiększa zdolność organizmu do regulacji pozakomórkowego potasu . Spadek zewnątrzkomórkowego potasu może prowadzić do zmniejszenia potencjału błonowego o 35 mV.
Pobudliwość komórek
Pobudliwość komórek to zmiana potencjału błonowego, która jest niezbędna do odpowiedzi komórkowych w różnych tkankach. Pobudliwość komórek jest właściwością indukowaną podczas wczesnej embriogenezy. Pobudliwość komórki została również zdefiniowana jako łatwość, z jaką można wywołać reakcję. spoczynkowe i progowe stanowią podstawę pobudliwości komórek, a procesy te mają fundamentalne znaczenie dla generowania potencjałów stopniowanych i czynnościowych.
Najważniejszymi regulatorami pobudliwości komórek są zewnątrzkomórkowe stężenia elektrolitów (tj. Na + , K + , Ca 2+ , Cl − , Mg 2+ ) i towarzyszące im białka. Ważnymi białkami regulującymi pobudliwość komórek są bramkowane napięciem kanały jonowe , transportery jonów (np. Na+/K+-ATPaza , transportery magnezu , transportery kwasowo-zasadowe ), receptory błonowe i kanały bramkowane cyklicznymi nukleotydami aktywowane hiperpolaryzacją . Na przykład kanały potasowe i receptory wyczuwające wapń są ważnymi regulatorami pobudliwości w neuronach , miocytach serca i wielu innych komórkach pobudliwych, takich jak astrocyty . Jon wapnia jest również najważniejszym przekaźnikiem wtórnym w sygnalizacji komórek pobudliwych . Aktywacja receptorów synaptycznych inicjuje długotrwałe zmiany w pobudliwości neuronów. Tarczyca , nadnercza a inne hormony również regulują pobudliwość komórek, na przykład progesteron i estrogen modulują pobudliwość komórek mięśni gładkich mięśniówki macicy .
Uważa się, że wiele typów komórek ma błonę pobudliwą. Komórki pobudliwe to neurony, miocyty (sercowe, szkieletowe, gładkie ), komórki śródbłonka naczyń , perycyty , komórki przykłębuszkowe , komórki śródmiąższowe Cajala , wiele rodzajów komórek nabłonka (np. komórki beta , komórki alfa , komórki delta , komórki enteroendokrynne , komórki neuroendokrynne płuc , pinealocyty ), glejowe komórki (np. astrocyty), komórki mechanoreceptorów (np. komórki włosów i komórki Merkla ), komórki chemoreceptorów (np. komórki glomusu , receptory smaku ), niektóre komórki roślinne i prawdopodobnie komórki odpornościowe . Astrocyty wykazują formę nieelektrycznej pobudliwości opartej na wewnątrzkomórkowych zmianach wapnia związanych z ekspresją kilku receptorów, przez które mogą wykrywać sygnał synaptyczny. W neuronach istnieją różne właściwości błony w niektórych częściach komórki, na przykład pobudliwość dendrytyczna zapewnia neuronom zdolność do wykrywania koincydencji przestrzennie oddzielonych danych wejściowych.
Równoważny obwód
Elektrofizjolodzy modelują skutki różnic stężeń jonów, kanałów jonowych i pojemności membrany w kategoriach równoważnego obwodu , który ma reprezentować właściwości elektryczne małego skrawka membrany. Równoważny obwód składa się z kondensatora połączonego równolegle z czterema ścieżkami, z których każda składa się z baterii połączonej szeregowo o zmiennej przewodności. Pojemność jest określona przez właściwości dwuwarstwy lipidowej i przyjmuje się, że jest stała. Każda z czterech równoległych ścieżek pochodzi od jednego z głównych jonów: sodu, potasu, chlorków i wapnia. Napięcie każdej ścieżki jonowej jest określone przez stężenie jonu po każdej stronie membrany; zobacz dotycząca potencjału odwrócenia powyżej. Przewodnictwo każdego szlaku jonowego w dowolnym momencie jest określane przez stany wszystkich kanałów jonowych, które są potencjalnie przepuszczalne dla tego jonu, w tym kanałów wyciekowych, kanałów bramkowanych ligandem i kanałów jonowych bramkowanych napięciem.

W przypadku stałych stężeń jonów i stałych wartości przewodnictwa kanału jonowego obwód równoważny można dalej zredukować, stosując równanie Goldmana, jak opisano poniżej, do obwodu zawierającego pojemność równolegle z baterią i przewodnictwo. Pod względem elektrycznym jest to rodzaj obwodu RC (obwód rezystancyjno-pojemnościowy), a jego właściwości elektryczne są bardzo proste. Począwszy od dowolnego stanu początkowego, prąd płynący przez przewodnictwo lub pojemność zanika wykładniczo w czasie, ze stałą czasową τ = RC , gdzie C to pojemność plastra membrany, a R = 1/g netto to rezystancja netto. W realistycznych sytuacjach stała czasowa zwykle mieści się w zakresie 1–100 milisekund. W większości przypadków zmiany przewodnictwa kanałów jonowych zachodzą w szybszej skali czasowej, więc obwód RC nie jest dobrym przybliżeniem; jednak równanie różniczkowe używane do modelowania plastra membrany jest zwykle zmodyfikowaną wersją równania obwodu RC.
Potencjał spoczynkowy
Kiedy potencjał błonowy komórki utrzymuje się przez długi czas bez znaczących zmian, nazywa się go potencjałem spoczynkowym lub napięciem spoczynkowym. Termin ten jest używany do określenia potencjału błonowego komórek niepobudzalnych, ale także potencjału błonowego komórek pobudliwych przy braku pobudzenia. W komórkach pobudliwych inne możliwe stany to stopniowane potencjały błonowe (o zmiennej amplitudzie) i potencjały czynnościowe, które są duże, wzrost potencjału błonowego typu „wszystko albo nic”, który zwykle przebiega w ustalonym czasie. Komórki pobudliwe obejmują neurony , komórki mięśniowe i niektóre komórki wydzielnicze w gruczołach . Jednak nawet w innych typach komórek napięcie błony może ulegać zmianom w odpowiedzi na bodźce środowiskowe lub wewnątrzkomórkowe. Na przykład depolaryzacja błony plazmatycznej wydaje się być ważnym krokiem w programowanej śmierci komórki .
Oddziaływania generujące potencjał spoczynkowy są modelowane za pomocą równania Goldmana . Jest to podobne w formie do równania Nernsta pokazanego powyżej, ponieważ opiera się na ładunkach omawianych jonów, a także na różnicy między ich stężeniem wewnątrz i na zewnątrz. Jednak bierze również pod uwagę względną przepuszczalność błony plazmatycznej dla każdego omawianego jonu.
Trzy jony występujące w tym równaniu to potas (K + ), sód (Na + ) i chlorek (Cl − ). Wapń jest pomijany, ale można go dodać, aby poradzić sobie z sytuacjami, w których odgrywa znaczącą rolę. Będąc anionem, terminy chlorkowe są traktowane inaczej niż terminy kationowe; stężenie wewnątrzkomórkowe jest w liczniku, a stężenie pozakomórkowe w mianowniku, co jest odwrotne do kationów. P i oznacza względną przepuszczalność jonu typu i.
Zasadniczo wzór Goldmana wyraża potencjał błony jako średnią ważoną potencjałów odwrócenia dla poszczególnych typów jonów, ważoną przepuszczalnością. (Chociaż potencjał błony zmienia się o około 100 mV podczas potencjału czynnościowego, stężenia jonów wewnątrz i na zewnątrz komórki nie zmieniają się znacząco. Pozostają bliskie swoim odpowiednim stężeniom, gdy błona znajduje się w stanie spoczynku). W większości komórek zwierzęcych przepuszczalność potasu jest znacznie większa w stanie spoczynku niż przepuszczalność sodu. W konsekwencji potencjał spoczynkowy jest zwykle zbliżony do potencjału odwrócenia potasu. Przepuszczalność dla chlorków może być wystarczająco wysoka, aby była znacząca, ale w przeciwieństwie do innych jonów, chlorek nie jest aktywnie pompowany, a zatem równoważy się przy potencjale odwrócenia bardzo bliskim potencjałowi spoczynkowemu określonemu przez inne jony.
Wartości spoczynkowego potencjału błonowego w większości komórek zwierzęcych zwykle wahają się od potencjału odwrócenia potasu (zwykle około -80 mV) do około -40 mV. Potencjał spoczynkowy w komórkach pobudliwych (zdolnych do wytwarzania potencjałów czynnościowych) wynosi zwykle około -60 mV - bardziej zdepolaryzowane napięcia prowadziłyby do spontanicznego generowania potencjałów czynnościowych. Komórki niedojrzałe lub niezróżnicowane wykazują bardzo zmienne wartości napięcia spoczynkowego, zwykle znacznie bardziej dodatnie niż w komórkach zróżnicowanych. W takich komórkach wartość potencjału spoczynkowego koreluje ze stopniem zróżnicowania: komórki niezróżnicowane w niektórych przypadkach mogą w ogóle nie wykazywać transbłonowej różnicy napięcia.
Utrzymanie potencjału spoczynkowego może być metabolicznie kosztowne dla komórki ze względu na konieczność aktywnego pompowania jonów w celu przeciwdziałania stratom spowodowanym kanałami wycieku. Koszt jest najwyższy, gdy funkcja ogniwa wymaga szczególnie zdepolaryzowanej wartości napięcia membrany. Na przykład potencjał spoczynkowy fotoreceptorów muchy plujki przystosowanej do światła dziennego ( Calliphora vicina ) może sięgać nawet -30 mV. Ten podwyższony potencjał błony umożliwia komórkom bardzo szybką reakcję na bodźce wzrokowe; koszt jest taki, że utrzymanie potencjału spoczynkowego może pochłonąć ponad 20% całkowitego komórkowego ATP .
Z drugiej strony wysoki potencjał spoczynkowy w komórkach niezróżnicowanych niekoniecznie wiąże się z wysokimi kosztami metabolicznymi. Ten pozorny paradoks można rozwiązać, badając pochodzenie tego potencjału spoczynkowego. Komórki mało zróżnicowane charakteryzują się wyjątkowo wysoką rezystancją wejściową, co oznacza, że na tym etapie życia komórki występuje niewiele kanałów wycieku. W oczywisty sposób przepuszczalność potasu staje się podobna do przepuszczalności jonów sodu, co umieszcza potencjał spoczynkowy pomiędzy potencjałami odwrócenia dla sodu i potasu, jak omówiono powyżej. Zmniejszone prądy upływowe oznaczają również, że nie ma potrzeby aktywnego pompowania w celu kompensacji, a zatem niski koszt metaboliczny.
Stopniowane potencjały
Jak wyjaśniono powyżej, potencjał w dowolnym punkcie błony komórkowej jest określony przez różnice stężeń jonów między obszarami wewnątrzkomórkowymi i zewnątrzkomórkowymi oraz przez przepuszczalność błony dla każdego typu jonów. Stężenia jonów zwykle nie zmieniają się bardzo szybko (z wyjątkiem Ca 2+ , gdzie podstawowe stężenie wewnątrzkomórkowe jest tak niskie, że nawet niewielki napływ może je zwiększyć o rzędy wielkości), ale przepuszczalność jonów może zmieniać się w krótkim czasie. ułamek milisekundy, w wyniku aktywacji kanałów jonowych bramkowanych ligandem. Zmiana potencjału błonowego może być duża lub mała, w zależności od liczby aktywowanych kanałów jonowych i ich typu, i może być długa lub krótka, w zależności od długości czasu, w którym kanały pozostają otwarte. Zmiany tego typu to tzw stopniowane potencjały , w przeciwieństwie do potencjałów czynnościowych, które mają stałą amplitudę i przebieg w czasie.
Jak można wywnioskować z przedstawionego powyżej równania Goldmana , efekt zwiększenia przepuszczalności membrany dla określonego rodzaju jonu przesuwa potencjał błony w kierunku potencjału odwrotnego dla tego jonu. Zatem otwarcie kanałów Na + przesuwa potencjał błony w kierunku potencjału odwrócenia Na + , który zwykle wynosi około +100 mV. Podobnie otwarcie kanałów K + przesuwa potencjał błony w kierunku około –90 mV, a otwarcie kanałów Cl − przesuwa go w kierunku około –70 mV (potencjał spoczynkowy większości błon). Zatem Na + kanały przesuwają potencjał błony w kierunku dodatnim, kanały K + przesuwają go w kierunku ujemnym (z wyjątkiem sytuacji, gdy błona jest hiperpolaryzowana do wartości bardziej ujemnej niż potencjał odwrotny K + ), a kanały Cl - mają tendencję do przesuwania go w kierunku spoczynku potencjał.
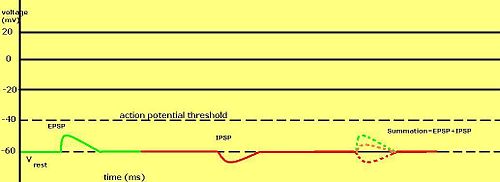
Stopniowe potencjały błonowe są szczególnie ważne w neuronach , gdzie są wytwarzane przez synapsy — tymczasowa zmiana potencjału błonowego wywołana aktywacją synapsy przez pojedynczy stopniowany lub czynnościowy potencjał nazywana jest potencjałem postsynaptycznym . Neuroprzekaźniki , które działają w celu otwarcia kanałów Na + , zwykle powodują, że potencjał błony staje się bardziej dodatni, podczas gdy neuroprzekaźniki, które aktywują kanały K + , zazwyczaj powodują, że staje się on bardziej ujemny; te, które hamują te kanały, mają zwykle odwrotny skutek.
To, czy potencjał postsynaptyczny jest uważany za pobudzający, czy hamujący, zależy od potencjału odwrócenia jonów tego prądu oraz progu, w którym komórka wyzwala potencjał czynnościowy (około –50 mV). Prąd postsynaptyczny z potencjałem odwrócenia powyżej progu, taki jak typowy prąd Na + , jest uważany za pobudzający. Prąd o potencjale odwrotnym poniżej wartości progowej, taki jak typowy prąd K + , jest uważany za hamujący. Prąd o potencjale odwrócenia powyżej potencjału spoczynkowego, ale poniżej progu, sam w sobie nie wywoła potencjałów czynnościowych, ale wytworzy podprogowe oscylacje potencjału błonowego . Zatem neuroprzekaźniki, które działają w celu otwarcia kanałów Na + , wytwarzają pobudzające potencjały postsynaptyczne lub EPSP, podczas gdy neuroprzekaźniki, które działają w celu otwarcia kanałów K + lub Cl - , zazwyczaj wytwarzają hamujące potencjały postsynaptyczne lub IPSP. Kiedy wiele typów kanałów jest otwartych w tym samym okresie czasu, ich potencjały postsynaptyczne sumują się (są sumowane).
Inne wartości
Z punktu widzenia biofizyki spoczynkowy potencjał błony jest jedynie potencjałem błony wynikającym z przepuszczalności błony dominującej w spoczynku komórki. Powyższe równanie średnich ważonych zawsze ma zastosowanie, ale można łatwiej zwizualizować następujące podejście. W dowolnym momencie istnieją dwa czynniki dla jonu, które określają, jak duży wpływ będzie miał ten jon na potencjał błonowy komórki:
- Siła napędowa tego jonu
- Przepuszczalność tego jonu
Jeśli siła napędowa jest duża, jon jest „przepychany” przez membranę. Jeśli przepuszczalność jest wysoka, jon będzie łatwiej dyfundował przez membranę.
- Siła napędowa to siła elektryczna netto dostępna do przesunięcia tego jonu przez membranę. Oblicza się go jako różnicę między napięciem , przy którym jon „chce” być (jego potencjał równowagi) a rzeczywistym potencjałem błony ( Em ). Więc formalnie siła napędowa dla jonu = E m - E jon
- Na przykład, przy naszym wcześniej obliczonym potencjale spoczynkowym -73 mV, siła napędowa działająca na potas wynosi 7 mV: (-73 mV) - (-80 mV) = 7 mV. Siła napędowa działająca na sód wynosiłaby (−73 mV) − (60 mV) = −133 mV.
- Przepuszczalność jest miarą tego, jak łatwo jon może przejść przez membranę. Zwykle jest mierzona jako przewodność (elektryczna), a jednostka siemens odpowiada 1 C·s -1 ·V -1 , czyli jednemu kulombowi na sekundę na wolt potencjału.
Tak więc w błonie spoczynkowej, podczas gdy siła napędowa dla potasu jest niska, jego przepuszczalność jest bardzo wysoka. Sód ma ogromną siłę napędową, ale prawie nie ma przepuszczalności spoczynkowej. W tym przypadku potas przenosi około 20 razy więcej prądu niż sód, a zatem ma 20 razy większy wpływ na E m niż sód.
Rozważmy jednak inny przypadek — szczyt potencjału czynnościowego. Tutaj przepuszczalność Na jest wysoka, a przepuszczalność K jest stosunkowo niska. W ten sposób membrana przesuwa się w pobliże E Na i daleko od E K .
Im więcej jonów jest przepuszczalnych, tym bardziej skomplikowane staje się przewidywanie potencjału błonowego. Można to jednak zrobić za pomocą równania Goldmana-Hodgkina-Katza lub równania średnich ważonych. Podstawiając gradienty stężeń i przepuszczalności jonów w dowolnym momencie, można określić potencjał błony w tym momencie. Równania GHK oznaczają, że w dowolnym momencie wartość potencjału błonowego będzie średnią ważoną potencjałów równowagi wszystkich przenikających jonów. „Ważenie” to względna przepuszczalność jonów przez membranę.
Efekty i implikacje
Podczas gdy komórki zużywają energię na transport jonów i tworzenie potencjału transbłonowego, wykorzystują ten potencjał z kolei do transportu innych jonów i metabolitów, takich jak cukier. Potencjał transbłonowy mitochondriów napędza produkcję ATP , który jest wspólną walutą energii biologicznej.
Komórki mogą czerpać energię, którą przechowują w potencjale spoczynkowym, do napędzania potencjałów czynnościowych lub innych form wzbudzenia. Te zmiany potencjału błonowego umożliwiają komunikację z innymi komórkami (podobnie jak w przypadku potencjałów czynnościowych) lub inicjują zmiany wewnątrz komórki, co zachodzi w komórce jajowej zapłodnionej plemnikiem .
Zmiany we właściwościach dielektrycznych błony plazmatycznej mogą działać jako cecha charakterystyczna stanów podstawowych, takich jak cukrzyca i dyslipidemia.
W komórkach neuronalnych potencjał czynnościowy rozpoczyna się od napływu jonów sodu do komórki przez kanały sodowe, co powoduje depolaryzację, podczas gdy powrót do zdrowia obejmuje przepływ potasu na zewnątrz przez kanały potasowe. Oba te strumienie występują w wyniku pasywnej dyfuzji .
Dawka soli może pobudzić wciąż działające neurony świeżego kawałka mięsa, powodując skurcze mięśni.
Zobacz też
- Bioelektrochemia
- Potencjał chemiosmotyczny
- Potencjał elektrochemiczny
- Równanie Goldmana
- Biofizyka błon
- Układ mikroelektrod
- Przewodnictwo solne
- Potencjał powierzchniowy
- Efekt Gibbsa-Donnana
- Potencjał synaptyczny
Notatki
- ^ Znaki E Na i E K są przeciwne. Dzieje się tak, ponieważ gradient stężenia potasu jest kierowany na zewnątrz komórki, podczas gdy gradient stężenia sodu jest kierowany do komórki. Potencjały błonowe są definiowane w stosunku do zewnętrznej części komórki; zatem potencjał -70 mV oznacza, że wnętrze komórki jest ujemne w stosunku do otoczenia.
Dalsza lektura
- Albertsa i in. Biologia molekularna komórki . Wydawnictwo Garland; Wydanie 4 Bk&Cdr (marzec 2002). ISBN 0-8153-3218-1 . Poziom licencjacki.
- Guyton, Arthur C., John E. Hall. Podręcznik fizjologii medycznej . Firma WB Saunders; Wydanie 10 (15 sierpnia 2000). ISBN 0-7216-8677-X . Poziom licencjacki.
- Hille, B. Ionic Channel of Excitable Membranes Sinauer Associates, Sunderland, MA, USA; Wydanie 1, 1984. ISBN 0-87893-322-0
- Nicholls, JG, Martin, AR i Wallace, BG Od neuronu do mózgu Sinauer Associates, Inc. Sunderland, MA, USA, wydanie 3, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Błony biologiczne: teoria transportu, potencjałów i impulsów elektrycznych . Cambridge University Press (26 września 2002). ISBN 0-521-81018-3 . Poziom wykształcenia.
- Krajowa seria medyczna do niezależnych badań. Fizjologia . Lippincott Williams & Wilkins. Filadelfia, PA, USA, wydanie 4, 2001. ISBN 0-683-30603-0





![E_{eq,K^+} = \frac{RT}{zF} \ln \frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_{m} = \frac{RT}{F} \ln{ \left( \frac{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{out} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{out} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{in}}{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{in} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{in} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{out}} \right) }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)