Długotrwałe wzmocnienie

W neurobiologii długoterminowe wzmacnianie ( LTP ) to trwałe wzmacnianie synaps w oparciu o ostatnie wzorce aktywności . Są to wzorce aktywności synaptycznej, które powodują długotrwały wzrost transmisji sygnału między dwoma neuronami . Przeciwieństwem LTP jest długotrwała depresja , która powoduje długotrwały spadek siły synaptycznej.
Jest to jedno z kilku zjawisk leżących u podstaw plastyczności synaptycznej , czyli zdolności synaps chemicznych do zmiany swojej siły. Ponieważ uważa się, że pamięć jest kodowana przez modyfikację siły synaptycznej , LTP jest powszechnie uważany za jeden z głównych mechanizmów komórkowych leżących u podstaw uczenia się i zapamiętywania .
hipokampie królika przez Terje Lømo w 1966 roku i od tego czasu pozostaje popularnym przedmiotem badań. Wiele współczesnych badań LTP ma na celu lepsze zrozumienie jego podstawowej biologii, podczas gdy inne mają na celu nakreślenie związku przyczynowego między LTP a uczeniem się behawioralnym. Jeszcze inni próbują opracować metody, farmakologiczne lub inne, wzmocnienia LTP w celu poprawy uczenia się i pamięci. LTP jest również przedmiotem badań klinicznych , na przykład w dziedzinie choroby Alzheimera i medycyny uzależnień .
Historia
Wczesne teorie uczenia się

Pod koniec XIX wieku naukowcy ogólnie uznali, że liczba neuronów w dorosłym mózgu (około 100 miliardów) nie wzrasta znacząco wraz z wiekiem, dając neurobiologom dobry powód, by sądzić, że wspomnienia generalnie nie są wynikiem produkcji nowych neuronów. Wraz z tą świadomością pojawiła się potrzeba wyjaśnienia, w jaki sposób wspomnienia mogą powstawać pod nieobecność nowych neuronów.
Hiszpański neuroanatom , Santiago Ramón y Cajal, jako jeden z pierwszych zaproponował mechanizm uczenia się, który nie wymaga tworzenia nowych neuronów . W swoim wykładzie Croonian z 1894 roku zaproponował, że zamiast tego wspomnienia mogą być tworzone poprzez wzmacnianie połączeń między istniejącymi neuronami w celu poprawy skuteczności ich komunikacji. Teoria Hebba , wprowadzona przez Donalda Hebba w 1949 roku powtórzył idee Ramóna y Cajala, proponując ponadto, że komórki mogą tworzyć nowe połączenia lub przechodzić zmiany metaboliczne i synaptyczne, które zwiększają ich zdolność do komunikowania się i tworzenia neuronowej sieci doświadczeń:
Załóżmy, że utrzymywanie się lub powtarzanie aktywności pogłosowej (lub „śladu”) ma tendencję do wywoływania trwałych zmian komórkowych, które zwiększają jej stabilność… Kiedy akson komórki A jest wystarczająco blisko, aby wzbudzić komórkę B i wielokrotnie lub uporczywie bierze udział w jej odpalaniu, w jednej lub obu komórkach zachodzi jakiś proces wzrostu lub przemiana metaboliczna, tak że zwiększa się wydajność A, jako jednej z komórek odpalających B.
Eric Kandel (1964) i współpracownicy byli jednymi z pierwszych badaczy, którzy odkryli długoterminowe wzmocnienie podczas pracy z ślimakiem morskim Aplysia. Próbowali zastosować warunkowanie behawioralne do różnych komórek w sieci neuronowej ślimaka. Ich wyniki wykazały zmiany siły synaptycznej, a badacze zasugerowali, że może to być spowodowane podstawową formą uczenia się występującą w ślimaku.
Chociaż te teorie tworzenia pamięci są obecnie dobrze ugruntowane, były dalekowzroczne jak na swoje czasy: neuronaukowcy i psychologowie z końca XIX i początku XX wieku nie byli wyposażeni w techniki neurofizjologiczne niezbędne do wyjaśnienia biologicznych podstaw uczenia się u zwierząt. Umiejętności te pojawiły się dopiero w drugiej połowie XX wieku, mniej więcej w tym samym czasie, co odkrycie długoterminowego wzmocnienia.
Odkrycie
LTP po raz pierwszy zaobserwował Terje Lømo w 1966 roku w laboratorium Pera Andersena w Oslo w Norwegii . Tam Lømo przeprowadził serię neurofizjologicznych na znieczulonych królikach, aby zbadać rolę hipokampu w pamięci krótkotrwałej .
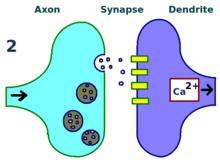
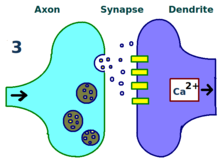
Eksperymenty Lømo koncentrowały się na połączeniach lub synapsach od ścieżki perforacyjnej do zakrętu zębatego . Eksperymenty te przeprowadzono poprzez stymulację włókien presynaptycznych szlaku perforacyjnego i rejestrację odpowiedzi ze zbioru komórek postsynaptycznych zakrętu zębatego. Zgodnie z oczekiwaniami pojedynczy impuls stymulacji elektrycznej włókien szlaku perforacyjnego spowodował pobudzające potencjały postsynaptyczne (EPSP) w komórkach zakrętu zębatego. Lømo nieoczekiwanie zauważył, że odpowiedź komórek postsynaptycznych na te bodźce z pojedynczym impulsem może być wzmocniona przez długi czas, jeśli najpierw dostarczy do włókien presynaptycznych ciąg bodźców o wysokiej częstotliwości . Po zastosowaniu takiego ciągu bodźców, kolejne pojedyncze impulsy wywoływały silniejsze, przedłużone EPSP w populacji komórek postsynaptycznych. Zjawisko to, w którym bodziec o wysokiej częstotliwości może powodować długotrwałe wzmocnienie odpowiedzi komórek postsynaptycznych na kolejne bodźce pojedynczego impulsu, początkowo nazywano „długotrwałym wzmocnieniem”.
Timothy Bliss , który dołączył do laboratorium Andersena w 1968 r., współpracował z Lømo iw 1973 r. obaj opublikowali pierwszą charakterystykę długotrwałego wzmocnienia w hipokampie królika . Bliss i Tony Gardner-Medwin opublikowali podobny raport o długotrwałym wzmocnieniu u obudzonych zwierząt, który pojawił się w tym samym numerze, co raport Bliss i Lømo. W 1975 roku Douglas i Goddard zaproponowali „długotrwałe wzmocnienie” jako nową nazwę zjawiska długotrwałego wzmocnienia. Andersen zasugerował, że autorzy wybrali „długoterminowe wzmocnienie”, być może ze względu na jego łatwy do wymówienia akronim „LTP”.
Modele i teoria
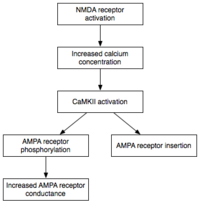
Fizyczny i biologiczny mechanizm LTP nadal nie jest poznany, ale opracowano kilka udanych modeli. [1] Badania kolców dendrytycznych , wystających struktur na dendrytach, które fizycznie rosną i cofają się w ciągu minut lub godzin, sugerują związek między opornością elektryczną kolców a efektywną siłą synaps, ze względu na ich związek z przejściami wapnia wewnątrzkomórkowego . Modele matematyczne, takie jak teoria BCM , która zależy również od wapnia wewnątrzkomórkowego w odniesieniu do bramek napięciowych receptora NMDA , były rozwijane od lat 80. XX wieku i modyfikują tradycyjny aprioryczny hebbowski model uczenia się z uzasadnieniem zarówno biologicznym, jak i eksperymentalnym. Jeszcze inni proponowali przeorganizowanie lub zsynchronizowanie związku między regulacją receptora, LTP i siłą synaptyczną.
typy
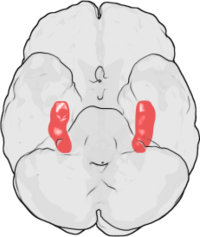
Od czasu jego pierwotnego odkrycia w hipokampie królika, LTP obserwowano w wielu innych strukturach nerwowych, w tym w korze mózgowej , móżdżku , ciele migdałowatym i wielu innych. Robert Malenka , wybitny badacz LTP, zasugerował, że LTP może nawet wystąpić we wszystkich synapsach pobudzających w mózgu ssaków.
Różne obszary mózgu wykazują różne formy LTP. Specyficzny typ LTP wykazywany między neuronami zależy od wielu czynników. Jednym z takich czynników jest wiek organizmu, w którym obserwuje się LTP. Na przykład mechanizmy molekularne LTP w niedojrzałym hipokampie różnią się od mechanizmów leżących u podstaw LTP dorosłego hipokampa. Szlaki sygnalizacyjne wykorzystywane przez konkretną komórkę również przyczyniają się do określonego rodzaju obecnego LTP. Na przykład niektóre rodzaje hipokampa LTP zależą od receptora NMDA , inne mogą zależeć od metabotropowego receptora glutaminianu (mGluR), podczas gdy jeszcze inne zależą całkowicie od innej cząsteczki. Różnorodność szlaków sygnalizacyjnych, które przyczyniają się do LTP i szerokie rozmieszczenie tych różnych szlaków w mózgu, są powodem, dla którego typ LTP wykazywany między neuronami zależy tylko częściowo od lokalizacji anatomicznej, w której obserwuje się LTP. Na przykład LTP w obocznym Schaffera w hipokampie jest zależny od receptora NMDA – zostało to udowodnione przez zastosowanie AP5 , antagonisty receptora NMDA, który zapobiegał LTP w tym szlaku. I odwrotnie, LTP we włóknie omszałym szlak jest niezależny od receptora NMDA, mimo że oba szlaki znajdują się w hipokampie.
Aktywność przed- i postsynaptyczna wymagana do wywołania LTP to inne kryteria, według których klasyfikuje się LTP. Ogólnie rzecz biorąc, pozwala to na klasyfikację LTP na mechanizmy hebbowskie, niehebowskie i antyhebbowskie. Zapożyczając swoją nazwę od postulatu Hebba , podsumowanego maksymą, że „komórki, które razem odpalają, łączą się ze sobą”, Hebbian LTP wymaga jednoczesnej depolaryzacji przed- i postsynaptycznej do swojej indukcji. Non-Hebbian LTP to rodzaj LTP, który nie wymaga takiej jednoczesnej depolaryzacji komórek pre- i postsynaptycznych; przykład tego występuje w ścieżce hipokampa włókien omszałych. Szczególny przypadek niehebbowskiego LTP, anty-Hebbian LTP wyraźnie wymaga jednoczesnej depolaryzacji presynaptycznej i względnej hiperpolaryzacji postsynaptycznej do jego indukcji.
Dzięki przewidywalnej organizacji i łatwo indukowalnemu LTP hipokamp CA1 stał się prototypowym miejscem badań LTP u ssaków. W szczególności LTP zależny od receptora NMDA w dorosłym hipokampie CA1 jest najszerzej badanym typem LTP i dlatego jest przedmiotem tego artykułu.
Nieruchomości
LTP zależny od receptora NMDA wykazuje kilka właściwości, w tym specyficzność wejściową, asocjatywność, kooperatywność i trwałość.
- Specyficzność wejściowa
- Po wywołaniu LTP w jednej synapsie nie rozprzestrzenia się na inne synapsy; raczej LTP jest specyficzne dla danych wejściowych . Długotrwała potencjacja jest propagowana tylko do tych synaps zgodnie z zasadami asocjatywności i kooperatywności. Jednak specyficzność wejściowa LTP może być niekompletna na krótkich odległościach. [ potrzebne źródło ] Jeden model wyjaśniający specyficzność wejściową LTP został przedstawiony przez Freya i Morrisa w 1997 roku i nosi nazwę hipotezy znakowania synaptycznego i wychwytywania .
- Asocjatywność
- Asocjatywność odnosi się do obserwacji, że gdy słaba stymulacja pojedynczego szlaku jest niewystarczająca do indukcji LTP, jednoczesna silna stymulacja innego szlaku wywoła LTP w obu szlakach.
- Kooperatywność
- LTP może być indukowana albo przez silną stymulację tężcową pojedynczej drogi prowadzącej do synapsy, albo wspólnie poprzez słabszą stymulację wielu. Kiedy jedna ścieżka prowadząca do synapsy jest słabo stymulowana, powoduje to niewystarczającą depolaryzację postsynaptyczną do wywołania LTP. W przeciwieństwie do tego, gdy słabe bodźce są stosowane do wielu szlaków, które zbiegają się na pojedynczym skrawku błony postsynaptycznej, poszczególne generowane depolaryzacje postsynaptyczne mogą wspólnie depolaryzować komórkę postsynaptyczną na tyle, aby wspólnie wywołać LTP. Znakowanie synaptyczne, omówione później, może być powszechnym mechanizmem leżącym u podstaw asocjatywności i kooperatywności. Bruce'a McNaughtona twierdzi, że jakakolwiek różnica między asocjatywnością a kooperatywnością jest ściśle semantyczna. Eksperymenty przeprowadzone przez stymulację szeregu pojedynczych kolców dendrytycznych wykazały, że współpraca synaptyczna za pomocą zaledwie dwóch sąsiednich kolców dendrytycznych zapobiega długotrwałej depresji (LTD), pozwalając jedynie na LTP.
- Trwałość
- LTP jest trwała , trwa od kilku minut do wielu miesięcy i właśnie ta trwałość odróżnia LTP od innych form plastyczności synaptycznej .
Wczesna faza
Konserwacja
Podczas gdy indukcja pociąga za sobą przejściową aktywację CaMKII i PKC , utrzymanie E-LTP (wczesna postać LTP) charakteryzuje się ich trwałą aktywacją. Na tym etapie PKMz ( kinaza białkowa Mζ ), która nie jest zależna od wapnia, staje się autonomicznie aktywna. W związku z tym są w stanie przeprowadzać zdarzenia fosforylacji, które leżą u podstaw ekspresji E-LTP.
Wyrażenie
Fosforylacja to reakcja chemiczna, w której mała grupa fosforanowa jest dodawana do innej cząsteczki w celu zmiany aktywności tej cząsteczki. Autonomicznie aktywne CaMKII i PKC wykorzystują fosforylację do przeprowadzenia dwóch głównych mechanizmów leżących u podstaw ekspresji E-LTP. Po pierwsze i najważniejsze, fosforylują istniejące receptory AMPA , aby zwiększyć ich aktywność. Po drugie, pośredniczą lub modulują wstawianie dodatkowych receptorów AMPA do błony postsynaptycznej. Co ważne, dostarczanie receptorów AMPA do synapsy podczas E-LTP jest niezależne od syntezy białek . Osiąga się to poprzez posiadanie niesynaptycznej puli receptorów AMPA w sąsiedztwie błony postsynaptycznej. Kiedy pojawia się odpowiedni bodziec indukujący LTP, niesynaptyczne receptory AMPA są szybko przemieszczane do błony postsynaptycznej pod wpływem kinaz białkowych. Jak wspomniano wcześniej, receptory AMPA są najobficiej występującymi receptorami glutaminianu w mózgu i pośredniczą w większości jego aktywności pobudzającej. Zwiększając wydajność i liczbę receptorów AMPA w synapsie, przyszłe bodźce pobudzające generują większe odpowiedzi postsynaptyczne.
Chociaż powyższy model E-LTP opisuje całkowicie postsynaptyczne mechanizmy indukcji, utrzymania i ekspresji, dodatkowy składnik ekspresji może wystąpić presynaptycznie. Jedna z hipotez tego presynaptycznego ułatwienia głosi, że utrzymująca się aktywność CaMKII w komórce postsynaptycznej podczas E-LTP może prowadzić do syntezy „przekaźnika wstecznego”, omówionego później. Zgodnie z tą hipotezą nowo zsyntetyzowany posłaniec przemieszcza się przez szczelinę synaptyczną z komórki postsynaptycznej do presynaptycznej, prowadząc do łańcucha zdarzeń, które ułatwiają odpowiedź presynaptyczną na kolejne bodźce. Takie zdarzenia mogą obejmować wzrost liczby pęcherzyków neuroprzekaźnika, prawdopodobieństwo uwolnienia pęcherzyków lub jedno i drugie. Oprócz przekaźnika wstecznego leżącego u podstaw ekspresji presynaptycznej w wczesny LTP , przekaźnik wsteczny może również odgrywać rolę w ekspresji późnego LTP.
Późna faza
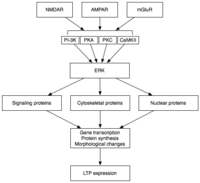
Późne LTP (L-LTP) jest naturalnym przedłużeniem E-LTP. W przeciwieństwie do E-LTP, który jest niezależny od syntezy białek, L-LTP wymaga transkrypcji genów i syntezy białek w komórce postsynaptycznej. Istnieją dwie fazy L-LTP: pierwsza zależy od syntezy białek, podczas gdy druga zależy zarówno od transkrypcji genów, jak i syntezy białek. Fazy te są czasami nazywane odpowiednio LTP2 i LTP3, przy czym E-LTP określa się w tej nomenklaturze jako LTP1.
Wprowadzenie
Późne LTP jest indukowane przez zmiany w ekspresji genów i syntezie białek spowodowane trwałą aktywacją kinaz białkowych aktywowanych podczas E-LTP, takich jak MAPK. W rzeczywistości MAPK - konkretnie kinaza regulowana sygnałem zewnątrzkomórkowym (ERK) podrodzina MAPK - może być łącznikiem molekularnym między E-LTP i L-LTP, ponieważ wiele kaskad sygnalizacyjnych zaangażowanych w E-LTP, w tym CaMKII i PKC, może zbiegać się w ERK. Ostatnie badania wykazały, że indukcja L-LTP może zależeć od zbieżnych zdarzeń molekularnych, mianowicie aktywacji PKA i napływu wapnia, które zbiegają się w CRTC1 (TORC1), silnym koaktywatorze transkrypcyjnym dla białka wiążącego element odpowiedzi cAMP (CREB ) . Ten wymóg molekularnego zbiegu okoliczności doskonale wyjaśnia asocjacyjną naturę LTP i przypuszczalnie uczenia się.
Konserwacja
Po aktywacji ERK może fosforylować szereg cząsteczek cytoplazmatycznych i jądrowych, co ostatecznie prowadzi do syntezy białek i zmian morfologicznych obserwowanych w L-LTP. Te cytoplazmatyczne i jądrowe cząsteczki mogą zawierać czynniki transkrypcyjne, takie jak CREB. Zależne od ERK zmiany w aktywności czynnika transkrypcyjnego mogą wywołać syntezę białek, które leżą u podstaw utrzymania L-LTP. Jedną z takich cząsteczek może być kinaza białkowa Mζ (PKMζ), trwale aktywna kinaza, której synteza wzrasta po indukcji LTP. PKMζ jest nietypową izoformą PKC, która nie posiada podjednostki regulacyjnej, a zatem pozostaje konstytutywnie aktywna. W przeciwieństwie do innych kinaz, które pośredniczą w LTP, PKMζ jest aktywny nie tylko w ciągu pierwszych 30 minut po indukcji LTP; raczej PKMζ staje się wymogiem utrzymania LTP tylko w późnej fazie LTP. PKMζ wydaje się zatem ważny dla trwałości pamięci i oczekuje się, że będzie ważny w utrzymaniu pamięci długotrwałej . Rzeczywiście, podanie inhibitora PKMζ do hipokampa szczura powoduje amnezję wsteczną z nienaruszoną pamięcią krótkotrwałą ; PKMζ nie odgrywa roli w powstawaniu pamięci krótkotrwałej. Niedawno wykazano, że PKMζ leży u podstaw utrzymania L-LTP poprzez kierowanie handlem i reorganizacją białek w rusztowaniu synaptycznym, które leży u podstaw ekspresji L-LTP. Jeszcze niedawno transgeniczne myszy pozbawione PKMζ wykazują normalny LTP, kwestionując konieczność PKMζ.
O długoterminowej stabilizacji zmian synaptycznych decyduje również równoległy wzrost struktur pre- i postsynaptycznych, takich jak buton aksonalny , kolce dendrytyczne i gęstość postsynaptyczna . Na poziomie molekularnym wykazano , że wzrost postsynaptycznych białek rusztowania PSD-95 i Homer1c koreluje ze stabilizacją powiększenia synaptycznego.
Wyrażenie
Znana jest tożsamość tylko kilku białek syntetyzowanych podczas L-LTP. Niezależnie od ich tożsamości uważa się, że przyczyniają się one do wzrostu kolców dendrytycznych , pola powierzchni i wrażliwości postsynaptycznej na neuroprzekaźnik związany z ekspresją L-LTP. To ostatnie może być spowodowane częściowo przez zwiększoną syntezę receptorów AMPA podczas L-LTP. Późne LTP jest również związane z presynaptyczną syntezą synaptotagminy i wzrostem pęcherzyków synaptycznych liczba, co sugeruje, że L-LTP indukuje syntezę białek nie tylko w komórkach postsynaptycznych, ale także w komórkach presynaptycznych. Jak wspomniano wcześniej, aby postsynaptyczna indukcja LTP doprowadziła do presynaptycznej syntezy białek, musi istnieć komunikacja z komórki postsynaptycznej do presynaptycznej. Może to nastąpić poprzez syntezę wstecznego posłańca, omówioną później.
Nawet w badaniach ograniczonych do zdarzeń postsynaptycznych badacze nie określili lokalizacji syntezy białek leżącej u podstaw L-LTP. W szczególności nie jest jasne, czy synteza białek zachodzi w ciele komórki postsynaptycznej , czy w jej dendrytach . Pomimo zaobserwowania rybosomów (główne składniki maszynerii syntezy białek) w dendrytach już w latach 60. XX wieku panowała opinia, że ciało komórki jest dominującym miejscem syntezy białek w neuronach. To rozumowanie nie zostało poważnie zakwestionowane aż do lat 80. XX wieku, kiedy badacze donieśli o zaobserwowaniu syntezy białek w dendrytach, których połączenie z ciałem komórkowym zostało zerwane. Niedawno badacze wykazali, że ten typ lokalnej syntezy białek jest niezbędny dla niektórych typów LTP.
Jednym z powodów popularności hipotezy lokalnej syntezy białek jest to, że zapewnia ona możliwy mechanizm specyficzności związanej z LTP. W szczególności, jeśli rzeczywiście lokalna synteza białek leży u podstaw L-LTP, tylko kolce dendrytyczne otrzymujące bodźce indukujące LTP będą podlegać LTP; wzmocnienie nie zostanie przeniesione do sąsiednich synaps. Natomiast globalna synteza białek zachodząca w ciele komórki wymaga, aby białka zostały wysłane do każdego obszaru komórki, w tym do synaps, które nie otrzymały bodźców indukujących LTP. Podczas gdy lokalna synteza białek zapewnia mechanizm specyficzności, wydaje się, że globalna synteza białek bezpośrednio go osłabia. Jednak, jak omówiono później, hipoteza znakowania synaptycznego z powodzeniem godzi globalną syntezę białek, specyficzność synaps i asocjatywność.
Sygnalizacja wsteczna
Sygnalizacja wsteczna to hipoteza, która próbuje wyjaśnić, że chociaż LTP jest indukowany i wyrażany postsynaptycznie, niektóre dowody sugerują, że jest on również wyrażany presynaptycznie. Hipoteza ma swoją nazwę, ponieważ normalna transmisja synaptyczna jest kierunkowa i przechodzi od komórki presynaptycznej do komórki postsynaptycznej. Aby indukcja zachodziła postsynaptycznie i była częściowo wyrażana presynaptycznie, wiadomość musi przejść z komórki postsynaptycznej do komórki presynaptycznej w ruchu wstecznym. (odwrotny kierunek. Tam wiadomość przypuszczalnie inicjuje kaskadę zdarzeń, która prowadzi do presynaptycznego składnika ekspresji, takiego jak zwiększone prawdopodobieństwo pęcherzyka neuroprzekaźnika .
Sygnalizacja wsteczna jest obecnie przedmiotem kontrowersji, ponieważ niektórzy badacze nie wierzą, że komórka presynaptyczna w ogóle przyczynia się do ekspresji LTP. Nawet wśród zwolenników tej hipotezy istnieją kontrowersje co do tożsamości posłańca. Wczesne myśli koncentrowały się na tlenku azotu , podczas gdy najnowsze dowody wskazują na białka adhezyjne komórek .
Znakowanie synaptyczne
Zanim hipoteza lokalnej syntezy białek zyskała znaczące poparcie, panowała powszechna zgoda co do tego, że synteza białek leżąca u podstaw L-LTP zachodzi w ciele komórki. Ponadto sądzono, że produkty tej syntezy są transportowane w całej komórce w sposób niespecyficzny. W związku z tym konieczne stało się wyjaśnienie, w jaki sposób synteza białek może zachodzić w ciele komórki bez uszczerbku dla specyficzności wejściowej LTP. Hipoteza znakowania synaptycznego próbuje rozwiązać trudny problem komórki polegający na syntezie białek w ciele komórki, ale zapewniając, że docierają one tylko do synaps, które otrzymały bodźce indukujące LTP.
Hipoteza znakowania synaptycznego sugeruje, że „znacznik synaptyczny” jest syntetyzowany w synapsach, które otrzymały bodźce indukujące LTP, i że ten znacznik synaptyczny może służyć do wychwytywania białek związanych z plastycznością wysyłanych w całej komórce z ciała komórki. Badania LTP u ślimaka morskiego Aplysia californica implikują znakowanie synaptyczne jako mechanizm specyficzności wejściowej LTP. Istnieją pewne dowody na to, że biorąc pod uwagę dwie szeroko oddalone synapsy, bodziec indukujący LTP w jednej synapsie napędza kilka kaskad sygnalizacyjnych (opisanych wcześniej), które inicjują ekspresję genów w jądrze komórkowym. W tej samej synapsie (ale nie w synapsie niestymulowanej) lokalna synteza białek tworzy krótkotrwały (mniej niż trzy godziny) znacznik synaptyczny. Produkty ekspresji genów są transportowane globalnie przez komórkę, ale są wychwytywane tylko przez synapsy, które wyrażają znacznik synaptyczny. W ten sposób wzmacniane są tylko synapsy odbierające bodźce indukujące LTP, co wskazuje na specyficzność wejściową LTP.
Hipoteza znacznika synaptycznego może również wyjaśniać asocjatywność i kooperatywność LTP. Asocjatywność ( patrz Właściwości ) obserwuje się, gdy jedna synapsa jest pobudzana stymulacją indukującą LTP, podczas gdy oddzielna synapsa jest tylko słabo stymulowana. Podczas gdy można by oczekiwać, że tylko silnie stymulowana synapsa ulegnie LTP (ponieważ sama słaba stymulacja jest niewystarczająca do wywołania LTP w obu synapsach), obie synapsy faktycznie przejdą LTP. Podczas gdy słabe bodźce nie są w stanie wywołać syntezy białka w ciele komórki, mogą wywołać syntezę znacznika synaptycznego. Jednoczesna silna stymulacja oddzielnego szlaku, zdolnego do indukowania syntezy białek ciała komórki, może następnie pobudzić produkcję białek związanych z plastycznością, które są transportowane w całej komórce. Gdy obie synapsy wykazują ekspresję znacznika synaptycznego, obie wychwytują produkty białkowe powodujące ekspresję LTP zarówno w silnie stymulowanych, jak i słabo stymulowanych szlakach.
Współpracę obserwuje się, gdy dwie synapsy są aktywowane przez słabe bodźce, które nie są w stanie wywołać LTP, gdy są stymulowane indywidualnie. Ale przy jednoczesnej słabej stymulacji obie synapsy przechodzą LTP w kooperacyjny sposób. Znakowanie synaptyczne nie wyjaśnia, w jaki sposób wiele słabych bodźców może skutkować zbiorowym bodźcem wystarczającym do wywołania LTP (wyjaśnia to opisane wcześniej postsynaptyczne sumowanie EPSP). Oznaczanie synaptyczne wyjaśnia raczej zdolność słabo stymulowanych synaps, z których żadna nie jest zdolna do niezależnego generowania LTP, do przyjmowania produktów syntezy białek inicjowanych zbiorowo. Tak jak poprzednio, można to osiągnąć poprzez syntezę lokalnego znacznika synaptycznego po słabej stymulacji synaptycznej.
Modulacja
| Modulator | Cel |
|---|---|
| Receptor β-adrenergiczny | amplifikacja cAMP, MAPK |
| Syntaza tlenku azotu | Cyklaza guanylanowa, PKG, NMDAR |
| Receptor dopaminy | amplifikacja cAMP, MAPK |
| Metabotropowy receptor glutaminianu | Amplifikacja PKC, MAPK |
Jak opisano wcześniej, cząsteczki leżące u podstaw LTP można sklasyfikować jako mediatory lub modulatory. Mediatorem LTP jest cząsteczka, taka jak receptor NMDA lub wapń, której obecność i aktywność jest niezbędna do wytworzenia LTP w prawie każdych warunkach. Natomiast modulator jest cząsteczką, która może zmieniać LTP, ale nie jest niezbędna do jego wytwarzania lub ekspresji.
Oprócz opisanych powyżej szlaków sygnałowych, hipokamp LTP może być zmieniany przez różne modulatory. Na przykład hormon steroidowy estradiol może zwiększać LTP poprzez napędzanie fosforylacji CREB i późniejszy wzrost kolców dendrytycznych . Ponadto receptora β-adrenergicznego, tacy jak norepinefryna , mogą zmieniać zależną od syntezy białek późną fazę LTP. Aktywność syntazy tlenku azotu może również skutkować późniejszą aktywacją cyklazy guanylowej i PKG. Podobnie aktywacja receptorów dopaminy może wzmacniać LTP poprzez szlak sygnałowy cAMP/PKA.
Związek z pamięcią behawioralną
Podczas gdy długotrwałe wzmacnianie synaps w hodowli komórkowej wydaje się zapewniać eleganckie podłoże do uczenia się i zapamiętywania, wkładu LTP w uczenie się behawioralne – to znaczy uczenie się na poziomie całego organizmu – nie można po prostu ekstrapolować z badań in vitro . Z tego powodu wiele wysiłku poświęcono ustaleniu, czy LTP jest warunkiem uczenia się i zapamiętywania żywych zwierząt. Z tego powodu LTP odgrywa również kluczową rolę w przetwarzaniu strachu .
Pamięć przestrzenna

W 1986 roku Richard Morris przedstawił jedne z pierwszych dowodów na to, że LTP jest rzeczywiście wymagane do tworzenia wspomnień in vivo . Przetestował pamięć przestrzenną szczurów, modyfikując farmakologicznie ich hipokamp, strukturę mózgu, której rola w uczeniu się przestrzennym jest dobrze ugruntowana. Szczury trenowano w labiryncie wodnym Morrisa , zadaniu pamięci przestrzennej, w którym szczury pływają w kałuży mętnej wody, dopóki nie zlokalizują platformy ukrytej pod jej powierzchnią. Oczekuje się, że podczas tego ćwiczenia normalne szczury skojarzą lokalizację ukrytej platformy z wyraźnymi wskazówkami umieszczonymi w określonych miejscach na obwodzie labiryntu. Po treningu jednej grupie szczurów kąpano hipokamp w blokerze receptora NMDA APV , podczas gdy druga grupa służyła jako kontrola . Obie grupy zostały następnie poddane zadaniu pamięci przestrzennej labiryntu wodnego. Szczury z grupy kontrolnej były w stanie zlokalizować platformę i uciec z basenu, podczas gdy wydajność szczurów, którym podawano APV, była znacznie osłabiona. Co więcej, gdy skrawki hipokampu pobrano z obu grup, LTP było łatwo indukowane w grupie kontrolnej, ale nie mogło być indukowane w mózgach szczurów leczonych APV. Dostarczyło to wczesnych dowodów na to, że receptor NMDA – a co za tym idzie, LTP – był wymagany przynajmniej dla niektórych rodzajów uczenia się i zapamiętywania.
Podobnie Susumu Tonegawa wykazał w 1996 r., że obszar CA1 hipokampa ma kluczowe znaczenie dla tworzenia pamięci przestrzennej u żywych myszy. Tak zwane komórki miejsca znajdujące się w tym regionie stają się aktywne tylko wtedy, gdy szczur znajduje się w określonym miejscu — zwanym polem miejsca - w otoczeniu. Ponieważ te pola miejsc są rozmieszczone w całym środowisku, jedną z interpretacji jest to, że grupy komórek miejsc tworzą mapy w hipokampie. Dokładność tych map określa, jak dobrze szczur uczy się o swoim środowisku, a tym samym jak dobrze może się w nim poruszać. Tonegawa odkrył, że poprzez upośledzenie receptora NMDA, a konkretnie poprzez genetyczne usunięcie podjednostki NR1 w regionie CA1, wygenerowane pola miejsca były znacznie mniej specyficzne niż w grupie kontrolnej. Oznacza to, że myszy wytwarzały błędne mapy przestrzenne, gdy ich receptory NMDA były osłabione. Zgodnie z oczekiwaniami myszy te radziły sobie bardzo słabo w zadaniach przestrzennych w porównaniu z grupą kontrolną, co dodatkowo potwierdza rolę LTP w uczeniu się przestrzennym.
Wykazano również, że zwiększona aktywność receptora NMDA w hipokampie powoduje zwiększone LTP i ogólną poprawę uczenia się przestrzennego. W 1999 roku Tang i in . stworzyli linię myszy ze wzmocnioną funkcją receptora NMDA poprzez nadekspresję NR2B w hipokampie. Powstałe inteligentne myszy, nazywane „myszami Doogie” na cześć fikcyjnego cudownego lekarza Doogie Howsera , miały większy LTP i celowały w zadaniach uczenia się przestrzennego, wzmacniając znaczenie LTP w tworzeniu wspomnień zależnych od hipokampu.
Unikanie hamowania
W 2006 roku Jonathan Whitlock i współpracownicy opisali serię eksperymentów, które dostarczyły prawdopodobnie najsilniejszych dowodów na rolę LTP w pamięci behawioralnej, argumentując, że aby stwierdzić, że LTP leży u podstaw uczenia się behawioralnego, oba procesy muszą zarówno naśladować, jak i blokować się nawzajem. Wykorzystując hamujący paradygmat uczenia się unikania, naukowcy szkolili szczury w dwukomorowym aparacie z jasnymi i ciemnymi komorami, przy czym ten ostatni był wyposażony w urządzenie, które dostarczało wstrząs stopy szczurowi po wejściu. Analiza synaps hipokampa CA1 wykazała, że hamujący trening unikania indukował in vivo fosforylacja receptora AMPA tego samego typu, co obserwowana w LTP in vitro ; to znaczy hamujący trening unikania naśladował LTP. Ponadto synapsy wzmocnione podczas treningu nie mogły być dalej wzmacniane przez eksperymentalne manipulacje, które w przeciwnym razie wywołałyby LTP; to znaczy hamujący trening unikania zablokował LTP. W odpowiedzi na artykuł Timothy Bliss i współpracownicy zauważyli, że te i powiązane eksperymenty „znacząco rozwijają argumenty przemawiające za LTP jako neuronowym mechanizmem pamięci”.
Znaczenie kliniczne
Rola LTP w chorobie jest mniej jasna niż w podstawowych mechanizmach plastyczności synaptycznej . Jednak zmiany w LTP mogą przyczyniać się do wielu chorób neurologicznych , w tym depresji , choroby Parkinsona , padaczki i bólu neuropatycznego . Upośledzony LTP może również odgrywać rolę w chorobie Alzheimera i uzależnieniu od narkotyków .
choroba Alzheimera

LTP zyskało wiele uwagi wśród tych, którzy badają chorobę Alzheimera (AD), chorobę neurodegeneracyjną , która powoduje znaczny spadek funkcji poznawczych i demencję . Wiele z tego pogorszenia występuje w związku ze zmianami zwyrodnieniowymi w hipokampie i innych przyśrodkowych strukturach płata skroniowego . Ze względu na dobrze ugruntowaną rolę hipokampa w LTP, niektórzy sugerują, że pogorszenie funkcji poznawczych obserwowane u osób z AD może wynikać z upośledzenia LTP.
W przeglądzie literatury z 2003 r. Rowan i in. zaproponowali jeden model wpływu LTP na AD. AD wydaje się wynikać, przynajmniej częściowo, z niewłaściwego przetwarzania białka prekursorowego amyloidu (APP). Wynikiem tego nieprawidłowego przetwarzania jest nagromadzenie fragmentów tego białka, zwanego amyloidem β (Aβ). Aβ występuje zarówno w postaci rozpuszczalnej, jak i fibrylarnej. Niewłaściwe przetwarzanie APP skutkuje akumulacją rozpuszczalnego Aβ, co zgodnie z hipotezą Rowana upośledza LTP w hipokampie i może prowadzić do pogorszenia funkcji poznawczych obserwowanego we wczesnym stadium AD.
AD może również upośledzać LTP poprzez mechanizmy różne od Aβ. Na przykład jedno badanie wykazało, że enzym PKMζ gromadzi się w splotach neurofibrylarnych , które są patologicznym markerem AD. PKMζ jest enzymem o krytycznym znaczeniu w utrzymaniu późnego LTP .
Uzależnienie od narkotyków
Badania z zakresu medycyny uzależnień prowadzone są również w ostatnim czasie [ kiedy? ] skupił się na LTP, ze względu na hipotezę, że uzależnienie od narkotyków stanowi potężną formę uczenia się i zapamiętywania. Uzależnienie jest złożonym zjawiskiem neurobehawioralnym obejmującym różne części mózgu, takie jak brzuszny obszar nakrywki (VTA) i jądro półleżące (NAc). Badania wykazały, że synapsy VTA i NAc są zdolne do ulegania LTP i że to LTP może być odpowiedzialne za zachowania charakteryzujące uzależnienie.
Zobacz też
- Neuroplastyczność
- Przebudowa aktyny neuronów
- Przezczaszkowa stymulacja prądem stałym
- Wzmocnienie po tężcowe
Dalsza lektura
- Bliss T, Collingridge G, Morris R (2004). Długoterminowe wzmocnienie: wzmacnianie neuronauki przez 30 lat . Oksford: Oxford University Press. ISBN 978-0-19-853030-5 .
- Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J (2007). Książka Hipokamp . Oksford: Oxford University Press. s. 350–474. ISBN 978-0-19-510027-3 .
Linki zewnętrzne
- Naukowcy dostarczają pierwszych dowodów na mechanizm uczenia się , raport PhysOrg.com z badań przeprowadzonych w 2006 roku przez Beara i współpracowników.
- Krótki film dokumentalny o myszach Doogie. ( format RealPlayer )
- „Smart Mouse”, odcinek telewizji Quantum ABC o myszach Doogie.
- Długoterminowe + wzmocnienie w amerykańskiej Narodowej Bibliotece Medycznej Nagłówki przedmiotów medycznych (MeSH)